高中化学苏教版选修三 3.2 离子键 离子晶体 (共21张PPT)
文档属性
| 名称 | 高中化学苏教版选修三 3.2 离子键 离子晶体 (共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-01 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
专题三
微粒间作用力与物质性质
学习目标
1、能说明离子键的形成。
2、能根据离子化合物的结构特征解释其物理性质。
3、了解离子晶体的特征。
4、了解晶格能的应用。
一、离子键的形成
NaCl形成的微观过程
电子
转移
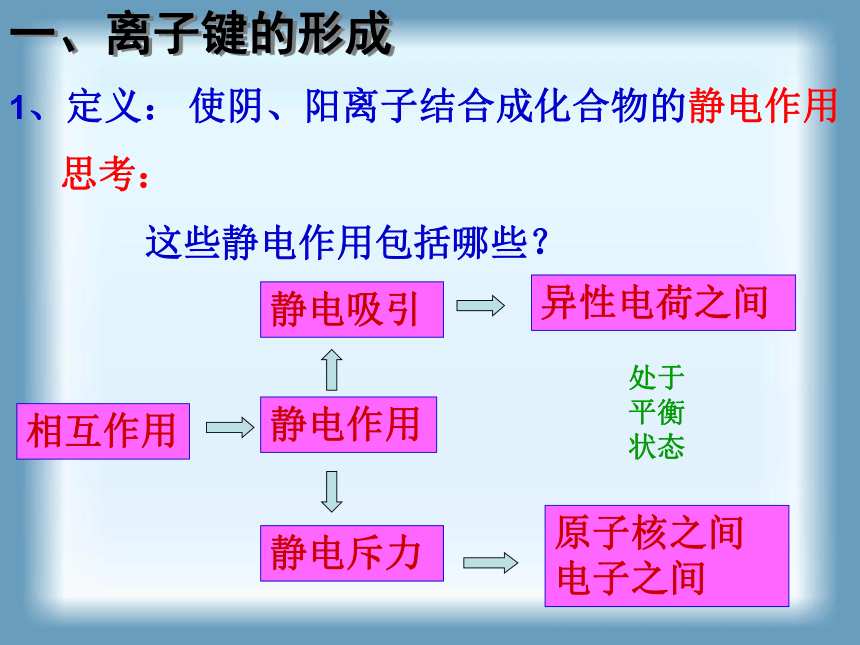
使阴、阳离子结合成化合物的静电作用
思考:
这些静电作用包括哪些?
相互作用
静电作用
静电吸引
静电斥力
异性电荷之间
原子核之间
电子之间
处于平衡状态
一、离子键的形成
1、定义:
成键粒子:
阴、阳离子
成键元素(一般情况):
成键本质:
静电作用(引力与斥力)
活泼金属元素(IA、
IIA)
活泼非金属元素(VIA、VIIA)
{形成化合物的元素的电负性的差>1.7}
转化成自由移动的离子,离子键即被破坏。
特
征:
无方向性和饱和性
一、离子键的形成
例1
下列化合物中含有离子键
(
)
①MgO
②Al2O3
③MgCl2
④AlCl3
⑤NaCl
⑥NaOH
⑦KOH
⑧BaSO4
除
④
外
2、离子化合物:含有离子键的化合物
注意区分:
用电子式表示物质
用电子式表示物质形成过程
强碱、大多数盐(AlCl3除外)、典型金属氧化物等
离子化合物包括:
一、离子键的形成
1、书写下列物质的电子式
NaCl
Na2O2
MgCl2
2、用电子式表示下列物质的形成过程。
NaCl
K2S
MgBr2
原子:
离子:
离子化合物:
电子式:
在元素符号周围用小黑点(或×)来表示的原子的最外层电子,这种式子叫做电子式。
用电子式表示离子化合物的形成过程:
1、离子必须表明电荷数;
2、相同的原子可以合并写,相同的离子必须要单个写;
3、阴离子必须用方括号括起;
5、用箭头表明电子转移的方向。
NaCl
K2S
MgBr2
明矾
KAl(SO4)2
萤石
CaF2
胆矾
CuSO4·5H2O
几种常见的离子晶体:
1、定义:离子间通过离子键结合而成的晶体。
注意:无单个分子存在;NaCl不表示分子式。
2、性质:熔沸点较高,硬度较大,难挥发难压缩
水溶液或者熔融状态下均导电。
3、包括:强碱、部分金属氧化物、部分盐类。
二、离子晶体
4、晶格能(符号为U)--衡量离子键的强弱
拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。
交流与讨论P40
分析影响晶格能的因素
讨论离子晶体的晶格能与其熔点等物理性质的关系
例如:
NaCl(s)
→Na+(g)+Cl-(g)
U=786kl/mol
晶格能越大,晶体中离子键越牢固,一般情况下,晶格能越大,离子晶体的熔点越高、硬度越大。
MgO—优良的耐高温材料。
练习
1、比较下列离子化合物的熔点
NaF
NaCl
NaBr
NaF
MgF2
AlF3
2、比较下列离子化合物的晶格能
(1)Na2O
K2O
(2)
MgCl2
MgO
(3)
NaF
CsBr
>
>
>
>
<
<
<
离子半径越小、离子所带电荷越多,离子键就越强,其形成化合物的熔沸点也就越高。
(1)每个晶胞中含几个Na+和几个Cl-?
5、两种常见的晶体结构类型
(2)Na+和Cl-的配位数是多少?
氯化钠的晶胞
NaCl晶体中阴、阳离子配位数
氯化铯的晶胞
问题解决P40-41
1、每个氯化铯晶胞中含有几个CS+和几个Cl-?
2、氯化铯晶胞中,每个离子周围带相反电荷离子数目?
找出CsCl、NaCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
科学探究:
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
离子晶体中的离子配位数
阴、阳离子半径比与配位数的关系
拓展视野
离子晶体中离子配位数的多少主要取决于阴、阳离子的相对大小。
r+/r-
配位数
实例
0.225~0.414
4
ZnS
0.414~0.732
6
NaCl
0.732~1.0
8
CsCl
>1.0
12
CsF
简单立方
面心立方
立方体
八面体
四面体
8:8
6:6
4:4
阴离子
堆积方式
离子晶体
类型
阳离子所占空隙
阴、阳离子配位数
阴、阳离子半径比(r+/r-)
晶体实例
CsCl型
0.732~1
CsCl
CsBr
NH4Cl等
NaCl型
0.414~
0.732
KCl
NaBr
CaO等
ZnS型
0.225~
0.414
ZnS
ZnO
BeO等
专题三
微粒间作用力与物质性质
学习目标
1、能说明离子键的形成。
2、能根据离子化合物的结构特征解释其物理性质。
3、了解离子晶体的特征。
4、了解晶格能的应用。
一、离子键的形成
NaCl形成的微观过程
电子
转移
使阴、阳离子结合成化合物的静电作用
思考:
这些静电作用包括哪些?
相互作用
静电作用
静电吸引
静电斥力
异性电荷之间
原子核之间
电子之间
处于平衡状态
一、离子键的形成
1、定义:
成键粒子:
阴、阳离子
成键元素(一般情况):
成键本质:
静电作用(引力与斥力)
活泼金属元素(IA、
IIA)
活泼非金属元素(VIA、VIIA)
{形成化合物的元素的电负性的差>1.7}
转化成自由移动的离子,离子键即被破坏。
特
征:
无方向性和饱和性
一、离子键的形成
例1
下列化合物中含有离子键
(
)
①MgO
②Al2O3
③MgCl2
④AlCl3
⑤NaCl
⑥NaOH
⑦KOH
⑧BaSO4
除
④
外
2、离子化合物:含有离子键的化合物
注意区分:
用电子式表示物质
用电子式表示物质形成过程
强碱、大多数盐(AlCl3除外)、典型金属氧化物等
离子化合物包括:
一、离子键的形成
1、书写下列物质的电子式
NaCl
Na2O2
MgCl2
2、用电子式表示下列物质的形成过程。
NaCl
K2S
MgBr2
原子:
离子:
离子化合物:
电子式:
在元素符号周围用小黑点(或×)来表示的原子的最外层电子,这种式子叫做电子式。
用电子式表示离子化合物的形成过程:
1、离子必须表明电荷数;
2、相同的原子可以合并写,相同的离子必须要单个写;
3、阴离子必须用方括号括起;
5、用箭头表明电子转移的方向。
NaCl
K2S
MgBr2
明矾
KAl(SO4)2
萤石
CaF2
胆矾
CuSO4·5H2O
几种常见的离子晶体:
1、定义:离子间通过离子键结合而成的晶体。
注意:无单个分子存在;NaCl不表示分子式。
2、性质:熔沸点较高,硬度较大,难挥发难压缩
水溶液或者熔融状态下均导电。
3、包括:强碱、部分金属氧化物、部分盐类。
二、离子晶体
4、晶格能(符号为U)--衡量离子键的强弱
拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。
交流与讨论P40
分析影响晶格能的因素
讨论离子晶体的晶格能与其熔点等物理性质的关系
例如:
NaCl(s)
→Na+(g)+Cl-(g)
U=786kl/mol
晶格能越大,晶体中离子键越牢固,一般情况下,晶格能越大,离子晶体的熔点越高、硬度越大。
MgO—优良的耐高温材料。
练习
1、比较下列离子化合物的熔点
NaF
NaCl
NaBr
NaF
MgF2
AlF3
2、比较下列离子化合物的晶格能
(1)Na2O
K2O
(2)
MgCl2
MgO
(3)
NaF
CsBr
>
>
>
>
<
<
<
离子半径越小、离子所带电荷越多,离子键就越强,其形成化合物的熔沸点也就越高。
(1)每个晶胞中含几个Na+和几个Cl-?
5、两种常见的晶体结构类型
(2)Na+和Cl-的配位数是多少?
氯化钠的晶胞
NaCl晶体中阴、阳离子配位数
氯化铯的晶胞
问题解决P40-41
1、每个氯化铯晶胞中含有几个CS+和几个Cl-?
2、氯化铯晶胞中,每个离子周围带相反电荷离子数目?
找出CsCl、NaCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?
6
6
8
8
科学探究:
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
离子晶体中的离子配位数
阴、阳离子半径比与配位数的关系
拓展视野
离子晶体中离子配位数的多少主要取决于阴、阳离子的相对大小。
r+/r-
配位数
实例
0.225~0.414
4
ZnS
0.414~0.732
6
NaCl
0.732~1.0
8
CsCl
>1.0
12
CsF
简单立方
面心立方
立方体
八面体
四面体
8:8
6:6
4:4
阴离子
堆积方式
离子晶体
类型
阳离子所占空隙
阴、阳离子配位数
阴、阳离子半径比(r+/r-)
晶体实例
CsCl型
0.732~1
CsCl
CsBr
NH4Cl等
NaCl型
0.414~
0.732
KCl
NaBr
CaO等
ZnS型
0.225~
0.414
ZnS
ZnO
BeO等
