高中化学沪科版高一下学期 5.3硫酸(共24张PPT)
文档属性
| 名称 | 高中化学沪科版高一下学期 5.3硫酸(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-01 22:37:09 | ||
图片预览








文档简介
(共24张PPT)
5.3
硫酸
H2SO4(稀)
指示剂变色
FeSO4+H2↑
Fe2(SO4)3
+H2O
Na2SO4+H2O
Na2SO4
+H2O+CO2
↑
知识回顾:稀硫酸的性质
H2SO4=2H++SO42-
硫酸是强酸,在水中
Na2CO3
NaOH
Fe2O3
Fe
指示剂
安能辨我是浓稀?
硫酸
硫酸
浓硫酸对水的告白1
亲爱的水:
请允许我这样叫你,这么长时间以来,我一直暗恋你。在这我毫无保留把自己的展现给你,我承认我没有颜色、很粘且油油的,而且体重较大,但我还有很突出的优点:我对你的心是始终如一的,因为我是不挥发的,这点我比盐酸和硝酸都强。每当遇见你,我就有种沸腾的感觉,全身会放出大量热。
98℅的浓硫酸
颜
色
:
状
态
:
挥发性:
溶解性:
密
度
:
无
色
油状粘稠液体
比水大(1.84g/mL)
难挥发(沸点338
?C
)
易溶于水,能与水以任意比混合。溶解时放出大量的热。
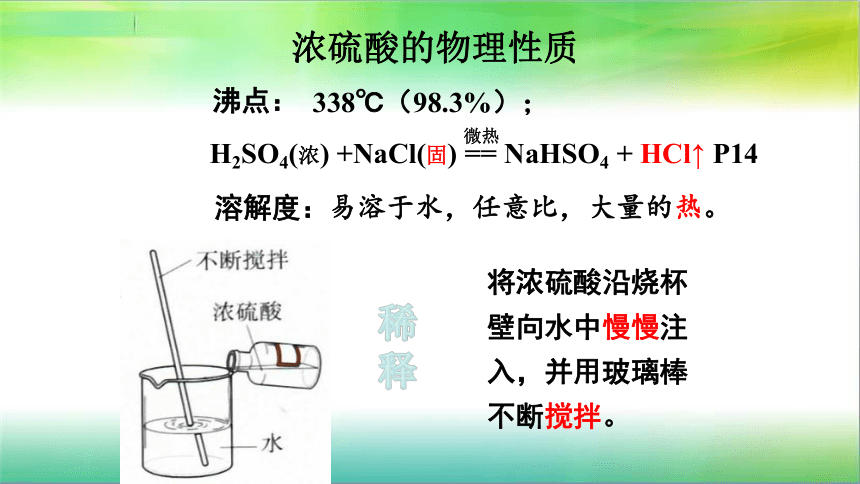
一、浓硫酸的物理性质
(98.3%)
易溶于水,任意比,大量的热。
沸点:
溶解度:
将浓硫酸沿烧杯
壁向水中慢慢注
入,并用玻璃棒
不断搅拌。
稀
释
浓硫酸的物理性质
338℃(98.3%);
H2SO4(浓)
+NaCl(固)
==
NaHSO4
+
HCl↑
P14
微热
水,当我见不到你时,我甚至会在空气中寻找你的蛛丝马迹,
最终要和你在一起。水,就算你改头换面隐藏在有机物中,我也会从中夺取氢、氧来合成你。我愿意为你付出一切,就算为了你,我变成稀硫酸,那我也不会后悔。
98℅的浓硫酸
浓硫酸对水的告白2
固体由蓝色变为白色
浓硫酸具有吸水性
【实验探究1】向表面皿中加入少量(约一药匙)
胆矾,再加入1ml(约20滴)浓硫酸,玻璃
棒搅拌,观察实验现象。
CuSO4·5H2O
CuSO4
浓硫酸
实验现象:
实验原理:
实验结论:
二、浓硫酸的特性:
友情提醒:使用浓硫酸时要小心,不要溅在皮肤和衣服上!
小结:利用浓硫酸的吸水性可以用浓硫酸做干燥剂。浓硫酸可以吸收物质中存在的水分,也可以吸收结晶水合物中的结晶水,甚至是空气中游离态的水。
?
利用浓硫酸的吸水性,有哪些应用?
1.吸水性
吸水性的应用——干燥气体
可以用来干燥:
H2
、O2、N2
、
CO
Cl2、
CO2
、
SO2
等
不能用来干燥:
碱性气体:
如NH3等
还原性气体:H2S、HI、HBr等
【实验探究2】用玻璃棒蘸取浓硫酸涂在火柴棒
上【主要成分(C6H10O5)n】,观察实验现象。
火柴棒变黑
浓硫酸具有脱水性
实验现象:
实验原理:
实验结论:
浓硫酸将有机物中的氢氧元素按原子个数比2:1脱去水的性质,同时生成黑色的碳,这种现象叫做“炭化”。
二、浓硫酸的特性:
2、脱水性
(含C、H、O等)
浓硫酸
有机物
将H、O按H2O组成比脱去
脱水(炭化)
浓硫酸的腐蚀性主要原因:脱水性
浓硫酸不慎沾到皮肤上应该立即用大量的水冲洗。
亲爱的水:
我会一辈子对你好,听说你在我和硝酸之间犹豫,不要再考虑了,我有很多硝酸所不具备的优点。比如我用蔗糖会做你最喜欢吃的“好利来黑面包”啊!
98℅的浓硫酸
浓硫酸对水的告白3
【实验:自制黑面包】
实验步骤:
实验现象:
往小烧杯中加入白糖(20g),加两滴管水,搅拌均匀,再加15mL浓硫酸,迅速搅拌
颜色由白变棕变黑
烧杯壁热
体积膨胀,呈疏松海绵状
有刺激性气味气体生成
二、浓硫酸的特性:
实验原理:
C
+
2H2SO4(浓)==CO2
↑+
2SO2
↑+
2H2O
△
实验结论:
浓硫酸具有吸水性、脱水性、强氧化性
C12H22O11
12C
+
11H2O
浓硫酸
亲爱的水:
虽然有人认为我脾气不好,这是我+6价硫原子决定的氧化性脾气,常温下钝化了铁、铝两位兄弟,但我及时踩了刹车。我头脑一热连不活泼的铜都不放过的,但我没有欺负你们女孩子喜欢的铂、金啊!
98℅的浓硫酸
浓硫酸对水的告白4
【实验探究4】
将一根铜丝放入放入具支试管中,然
后加入2mL浓硫酸,如图所示。加热,将产生的气体通入
品红溶液中,观察实验现象。
(注意观察品红溶液和硫酸溶液)
二、浓硫酸的特性:
(1)、实验现象
生成的气体使品红溶液为无色、试管中固体呈灰白色,将试管中液体倒入烧杯加水呈蓝色
(2)、通过现象判断可能生成物
Cu
+
H2SO4(浓)
====
?
CuSO4+
SO2↑
+
2H2O
2
3.强氧化性
工业上可以用铝槽车盛放、运输浓硫酸!
二、浓硫酸的特性:
常温下Al、Fe与浓硫酸接触表面生成致密的氧化物薄膜,薄膜隔断了金属与浓硫酸的进一步接触而导致反应不能继续进行,这就是钝化。
在加热条件下,可与绝大多数金属反应(Au、Pt除外),产生的气体是SO2气体,不是
H2
。
金属+浓硫酸
硫酸盐+
SO2
↑
+
H2O
△
二、浓硫酸的特性:
反应通式:
浓硫酸溶液和稀硫酸溶液中硫酸的存在形式不同。
稀H2SO4溶液:
H+、SO42-
酸的通性
浓H2SO4溶液:
H2SO4
(大量)
H+、SO42-
(少量)
结构
性质
决定
决定
用途
三、浓硫酸的用途
①
浓硫酸常温使纸片变黑:
;
②
浓硫酸与铜共热产生气体:
;
③
浓硫酸使蔗糖变成“黑面包”:
;
④
浓硫酸常温下使铁铝钝化:
;
⑤
浓硫酸使胆矾变成白色粉末:
;
思考.硫酸在下列用途或现象中所表现的性质是:
A.
酸性
B.
吸水性
C.
脱水性
D.
强氧化性
C
C.D
A
A.D
B
设计一套实验装置,验证C和浓硫酸反应的产物。
探究作业
谢谢,再见!
5.3
硫酸
H2SO4(稀)
指示剂变色
FeSO4+H2↑
Fe2(SO4)3
+H2O
Na2SO4+H2O
Na2SO4
+H2O+CO2
↑
知识回顾:稀硫酸的性质
H2SO4=2H++SO42-
硫酸是强酸,在水中
Na2CO3
NaOH
Fe2O3
Fe
指示剂
安能辨我是浓稀?
硫酸
硫酸
浓硫酸对水的告白1
亲爱的水:
请允许我这样叫你,这么长时间以来,我一直暗恋你。在这我毫无保留把自己的展现给你,我承认我没有颜色、很粘且油油的,而且体重较大,但我还有很突出的优点:我对你的心是始终如一的,因为我是不挥发的,这点我比盐酸和硝酸都强。每当遇见你,我就有种沸腾的感觉,全身会放出大量热。
98℅的浓硫酸
颜
色
:
状
态
:
挥发性:
溶解性:
密
度
:
无
色
油状粘稠液体
比水大(1.84g/mL)
难挥发(沸点338
?C
)
易溶于水,能与水以任意比混合。溶解时放出大量的热。
一、浓硫酸的物理性质
(98.3%)
易溶于水,任意比,大量的热。
沸点:
溶解度:
将浓硫酸沿烧杯
壁向水中慢慢注
入,并用玻璃棒
不断搅拌。
稀
释
浓硫酸的物理性质
338℃(98.3%);
H2SO4(浓)
+NaCl(固)
==
NaHSO4
+
HCl↑
P14
微热
水,当我见不到你时,我甚至会在空气中寻找你的蛛丝马迹,
最终要和你在一起。水,就算你改头换面隐藏在有机物中,我也会从中夺取氢、氧来合成你。我愿意为你付出一切,就算为了你,我变成稀硫酸,那我也不会后悔。
98℅的浓硫酸
浓硫酸对水的告白2
固体由蓝色变为白色
浓硫酸具有吸水性
【实验探究1】向表面皿中加入少量(约一药匙)
胆矾,再加入1ml(约20滴)浓硫酸,玻璃
棒搅拌,观察实验现象。
CuSO4·5H2O
CuSO4
浓硫酸
实验现象:
实验原理:
实验结论:
二、浓硫酸的特性:
友情提醒:使用浓硫酸时要小心,不要溅在皮肤和衣服上!
小结:利用浓硫酸的吸水性可以用浓硫酸做干燥剂。浓硫酸可以吸收物质中存在的水分,也可以吸收结晶水合物中的结晶水,甚至是空气中游离态的水。
?
利用浓硫酸的吸水性,有哪些应用?
1.吸水性
吸水性的应用——干燥气体
可以用来干燥:
H2
、O2、N2
、
CO
Cl2、
CO2
、
SO2
等
不能用来干燥:
碱性气体:
如NH3等
还原性气体:H2S、HI、HBr等
【实验探究2】用玻璃棒蘸取浓硫酸涂在火柴棒
上【主要成分(C6H10O5)n】,观察实验现象。
火柴棒变黑
浓硫酸具有脱水性
实验现象:
实验原理:
实验结论:
浓硫酸将有机物中的氢氧元素按原子个数比2:1脱去水的性质,同时生成黑色的碳,这种现象叫做“炭化”。
二、浓硫酸的特性:
2、脱水性
(含C、H、O等)
浓硫酸
有机物
将H、O按H2O组成比脱去
脱水(炭化)
浓硫酸的腐蚀性主要原因:脱水性
浓硫酸不慎沾到皮肤上应该立即用大量的水冲洗。
亲爱的水:
我会一辈子对你好,听说你在我和硝酸之间犹豫,不要再考虑了,我有很多硝酸所不具备的优点。比如我用蔗糖会做你最喜欢吃的“好利来黑面包”啊!
98℅的浓硫酸
浓硫酸对水的告白3
【实验:自制黑面包】
实验步骤:
实验现象:
往小烧杯中加入白糖(20g),加两滴管水,搅拌均匀,再加15mL浓硫酸,迅速搅拌
颜色由白变棕变黑
烧杯壁热
体积膨胀,呈疏松海绵状
有刺激性气味气体生成
二、浓硫酸的特性:
实验原理:
C
+
2H2SO4(浓)==CO2
↑+
2SO2
↑+
2H2O
△
实验结论:
浓硫酸具有吸水性、脱水性、强氧化性
C12H22O11
12C
+
11H2O
浓硫酸
亲爱的水:
虽然有人认为我脾气不好,这是我+6价硫原子决定的氧化性脾气,常温下钝化了铁、铝两位兄弟,但我及时踩了刹车。我头脑一热连不活泼的铜都不放过的,但我没有欺负你们女孩子喜欢的铂、金啊!
98℅的浓硫酸
浓硫酸对水的告白4
【实验探究4】
将一根铜丝放入放入具支试管中,然
后加入2mL浓硫酸,如图所示。加热,将产生的气体通入
品红溶液中,观察实验现象。
(注意观察品红溶液和硫酸溶液)
二、浓硫酸的特性:
(1)、实验现象
生成的气体使品红溶液为无色、试管中固体呈灰白色,将试管中液体倒入烧杯加水呈蓝色
(2)、通过现象判断可能生成物
Cu
+
H2SO4(浓)
====
?
CuSO4+
SO2↑
+
2H2O
2
3.强氧化性
工业上可以用铝槽车盛放、运输浓硫酸!
二、浓硫酸的特性:
常温下Al、Fe与浓硫酸接触表面生成致密的氧化物薄膜,薄膜隔断了金属与浓硫酸的进一步接触而导致反应不能继续进行,这就是钝化。
在加热条件下,可与绝大多数金属反应(Au、Pt除外),产生的气体是SO2气体,不是
H2
。
金属+浓硫酸
硫酸盐+
SO2
↑
+
H2O
△
二、浓硫酸的特性:
反应通式:
浓硫酸溶液和稀硫酸溶液中硫酸的存在形式不同。
稀H2SO4溶液:
H+、SO42-
酸的通性
浓H2SO4溶液:
H2SO4
(大量)
H+、SO42-
(少量)
结构
性质
决定
决定
用途
三、浓硫酸的用途
①
浓硫酸常温使纸片变黑:
;
②
浓硫酸与铜共热产生气体:
;
③
浓硫酸使蔗糖变成“黑面包”:
;
④
浓硫酸常温下使铁铝钝化:
;
⑤
浓硫酸使胆矾变成白色粉末:
;
思考.硫酸在下列用途或现象中所表现的性质是:
A.
酸性
B.
吸水性
C.
脱水性
D.
强氧化性
C
C.D
A
A.D
B
设计一套实验装置,验证C和浓硫酸反应的产物。
探究作业
谢谢,再见!
