高中化学沪科版高一上学期 2.2.1 探究气体体积的规律 课件(19张PPT)(共19张PPT)
文档属性
| 名称 | 高中化学沪科版高一上学期 2.2.1 探究气体体积的规律 课件(19张PPT)(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 423.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-02 21:57:47 | ||
图片预览






文档简介
(共19张PPT)
探究气体体积的规律
15:07
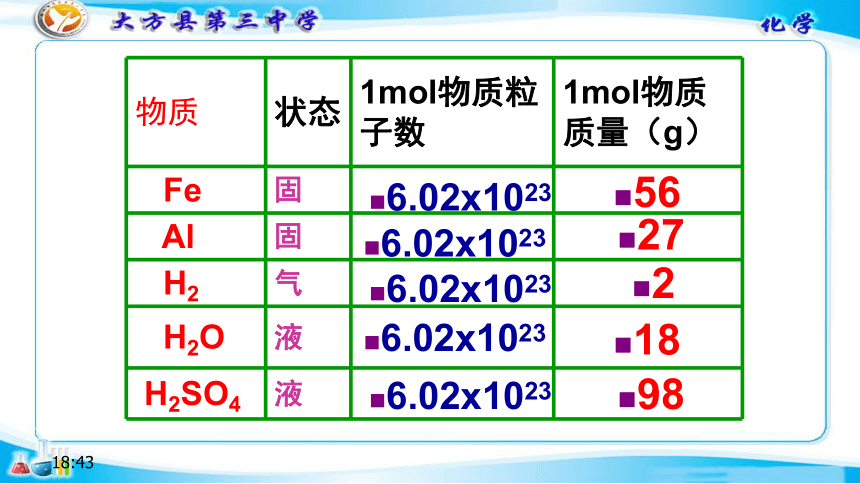
物质
状态
1mol物质粒子数
1mol物质质量(g)
Fe
固
Al
固
H2
气
H2O
液
H2SO4
液
6.02x1023
6.02x1023
6.02x1023
6.02x1023
6.02x1023
56
27
2
18
98
15:07
想一想:
通过上表我们知道1mol不同物质的质量一般不同,那么不同物质的体积是否相同呢?
15:07
以下是1mol物质在00C、101KPa下的体积,
由体积数据结合物质状态你得出什么结论?
物质
状态
密度
体积
Fe
固体
7.8g/cm3
7.2cm3
Al
固体
2.7g/cm3
10cm3
H2O
液体
1g/cm3
18cm3
H2SO4
液体
1.83g/cm3
53.6cm3
H2
气体
0.0893g/L
22.4L
O2
气体
1.429g/L
22.4L
CO2
气体
1.965g/L
22.4L
N2
气体
1.25g/L
22.4L
15:07
结论:
1.
在相同条件下,1mol固体或液体的体积不相同。
15:07
2.
在相同条件下,1mol气体的体积基本相同。
为什么?
在相同状况下,为什么1mol不同的固态和液态物质的体积不同,而气态物质的体积却几乎相同呢?决定物质体积的因素有哪些?
15:07
决定物质体积大小的因素有哪些?
15:07
物质体积大小的决定因素
粒子数目
粒子大小
粒子间距
数目相同的两种固态物质
数目相同的两种液态物质
固态或液态物质
粒子数目
粒子大小
粒子间距(忽略)
15:07
分子直径
分子间的平均距离
气态物质
粒子数目
粒子大小(忽略)
粒子间距
15:07
温度升高,气体分子间的平均距离增大,体积增大。
15:07
压强增大,气体分子间的平均距离减小,体积减小。
15:07
P不变,T升高
分子间平均距离增大
气体体积变大
T不变,P增大
分子间距离减小
气体体积变小
分析:
温度和压强如何决定一定物质的量的气体的体积?
T不变,P不变
分子间距离不变
气体体积变吗?
15:07
请根据你刚才所学的知识解释1mol气体在00C、101KPa下的体积为什么相同。
名称
状态
密
度(g/L)
质量(g)
体积(L)
H2
气体
0.0893
2
22.4
O2
气体
1.429
32
22.4
CO2
气体
1.965
44
22.4
N2
气体
1.25
28
22.4
15:07
为什么在00C、101KPa下1mol任何气体所占的体积都相同呢?
标准状况(S.T.P):温度(0℃,273K)
压强(101KPa)
T.P相同
间距相同
V相同(约为22.4L)
15:07
结
论
在标准状况下,1mol任何气体所占的体积都约为22.4L。
标准状况:
0℃、101KPa
15:07
二.气体摩尔体积
概念:单位物质的量气体所占的体积。
符号:
公式:
Vm=
V
n
在标准状况下,气体摩尔体积约为22.4L/mol
单位:
15:07
L/mol(或L·mol-1)
Vm
合作探究四:
判断下列说法是否正确?为什么?
(1)气体的摩尔体积约为22.4L/mol
(2)标准状况下任何气体的体积都约是22.4L
(3)1mol
CO2占有的体积一定为22.4L
(4)
1mol
H2O在标准状况下的体积约为22.4L
(5)标准状况下,1mol
O2和N2混合气体的
体积约为22.4L。
(6)标准状况下,气体的摩尔体积约为22.4L。
错
错
错
错
对
错
15:07
条件:标准状况(0℃,101KPa)
对象:任何气体(单一气体或混合气体)
物质的量:1mol
体积:约为22.4L
标准状况下气体摩尔体积要点:
15:07
课堂小结
绘制思维导图
15:07
探究气体体积的规律
15:07
物质
状态
1mol物质粒子数
1mol物质质量(g)
Fe
固
Al
固
H2
气
H2O
液
H2SO4
液
6.02x1023
6.02x1023
6.02x1023
6.02x1023
6.02x1023
56
27
2
18
98
15:07
想一想:
通过上表我们知道1mol不同物质的质量一般不同,那么不同物质的体积是否相同呢?
15:07
以下是1mol物质在00C、101KPa下的体积,
由体积数据结合物质状态你得出什么结论?
物质
状态
密度
体积
Fe
固体
7.8g/cm3
7.2cm3
Al
固体
2.7g/cm3
10cm3
H2O
液体
1g/cm3
18cm3
H2SO4
液体
1.83g/cm3
53.6cm3
H2
气体
0.0893g/L
22.4L
O2
气体
1.429g/L
22.4L
CO2
气体
1.965g/L
22.4L
N2
气体
1.25g/L
22.4L
15:07
结论:
1.
在相同条件下,1mol固体或液体的体积不相同。
15:07
2.
在相同条件下,1mol气体的体积基本相同。
为什么?
在相同状况下,为什么1mol不同的固态和液态物质的体积不同,而气态物质的体积却几乎相同呢?决定物质体积的因素有哪些?
15:07
决定物质体积大小的因素有哪些?
15:07
物质体积大小的决定因素
粒子数目
粒子大小
粒子间距
数目相同的两种固态物质
数目相同的两种液态物质
固态或液态物质
粒子数目
粒子大小
粒子间距(忽略)
15:07
分子直径
分子间的平均距离
气态物质
粒子数目
粒子大小(忽略)
粒子间距
15:07
温度升高,气体分子间的平均距离增大,体积增大。
15:07
压强增大,气体分子间的平均距离减小,体积减小。
15:07
P不变,T升高
分子间平均距离增大
气体体积变大
T不变,P增大
分子间距离减小
气体体积变小
分析:
温度和压强如何决定一定物质的量的气体的体积?
T不变,P不变
分子间距离不变
气体体积变吗?
15:07
请根据你刚才所学的知识解释1mol气体在00C、101KPa下的体积为什么相同。
名称
状态
密
度(g/L)
质量(g)
体积(L)
H2
气体
0.0893
2
22.4
O2
气体
1.429
32
22.4
CO2
气体
1.965
44
22.4
N2
气体
1.25
28
22.4
15:07
为什么在00C、101KPa下1mol任何气体所占的体积都相同呢?
标准状况(S.T.P):温度(0℃,273K)
压强(101KPa)
T.P相同
间距相同
V相同(约为22.4L)
15:07
结
论
在标准状况下,1mol任何气体所占的体积都约为22.4L。
标准状况:
0℃、101KPa
15:07
二.气体摩尔体积
概念:单位物质的量气体所占的体积。
符号:
公式:
Vm=
V
n
在标准状况下,气体摩尔体积约为22.4L/mol
单位:
15:07
L/mol(或L·mol-1)
Vm
合作探究四:
判断下列说法是否正确?为什么?
(1)气体的摩尔体积约为22.4L/mol
(2)标准状况下任何气体的体积都约是22.4L
(3)1mol
CO2占有的体积一定为22.4L
(4)
1mol
H2O在标准状况下的体积约为22.4L
(5)标准状况下,1mol
O2和N2混合气体的
体积约为22.4L。
(6)标准状况下,气体的摩尔体积约为22.4L。
错
错
错
错
对
错
15:07
条件:标准状况(0℃,101KPa)
对象:任何气体(单一气体或混合气体)
物质的量:1mol
体积:约为22.4L
标准状况下气体摩尔体积要点:
15:07
课堂小结
绘制思维导图
15:07
