高中化学苏教版选修三 4.1 分子构型与物质的性质 (2)(共30张PPT)
文档属性
| 名称 | 高中化学苏教版选修三 4.1 分子构型与物质的性质 (2)(共30张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-02 00:00:00 | ||
图片预览






文档简介
(共30张PPT)
分子构型与物质性质
苏教版
《物质结构与性质》专题四第一单元
一、推断分子或离子立体构型“三步曲”
第一步:确定中心原子上的价层电子对数(
ABm型分子)
第二步:确定价层电子对的立体构型
第三步:分子立体构型的确定
第一步:确定中心原子上的价层电子对数(
ABm型分子)
一、推断分子或离子立体构型“三步曲”
①其中中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子提供1个电子,氧、硫原子按不提供电子计算。②对于复杂离子,在计算价电子对数时,还应加上阴离子的电荷数或减去阳离子的电荷数;
n=成键电子对数+孤电子对数
成键电子对数=
m
孤电子对数=n-m
练习
BF3
CH4
SO2
SO42-
SO32-
NH4+
注意:
四面体形
平面三角形
直线形
第二步:确定价层电子对的立体构型(VSEPR模型)
价电子对数(n)
推断分子或离子立体构型“三步曲”
即:去掉孤电子对后只有成键电子时的立体构型
第三步:分子立体构型的确定
n=价电子对
m=成键电子对
n-m=孤电子对
n=4
n=3
n=2
例如:
CH4
NH3
H2O
例如:BF3
SO2
CO32-
例如:CO2
BeCl2
4
4
0
正四面体
正四面体
4
3
1
四面体
三角锥
4
2
2
四面体
V形
4
4
0
正四面体
正四面体
3
3
0
平面三角形
平面三角形
3
2
1
平面三角形
V形
4
3
1
四面体
三角锥形
2
2
0
直线形
直线形
2
2
0
直线形
直线形
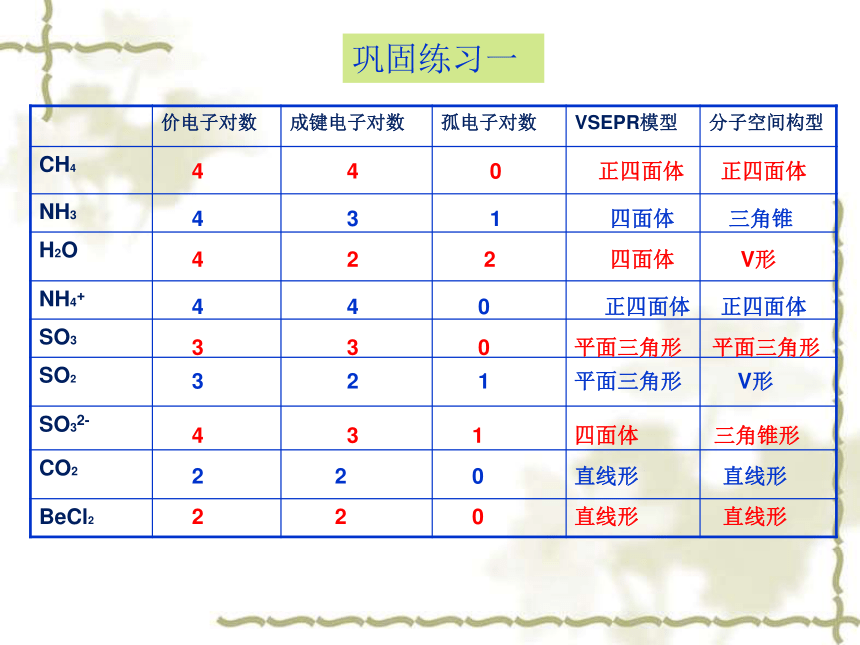
巩固练习一
价电子对数
成键电子对数
孤电子对数
VSEPR模型
分子空间构型
CH4
NH3
H2O
NH4+
SO3
SO2
SO32-
CO2
BeCl2
BeCl2、CO2
BF3、SO3
SO2
CH4、CCl4
H2O
NH3、PCl3
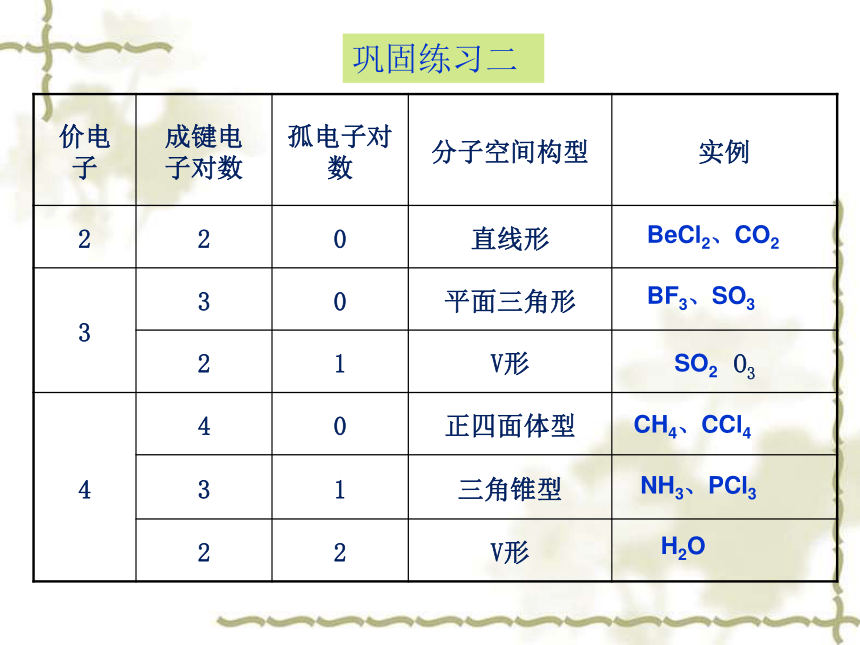
巩固练习二
价电
子
成键电
子对数
孤电子对数
分子空间构型
实例
2
2
0
直线形
3
3
0
平面三角形
2
1
V形
O3
4
4
0
正四面体型
3
1
三角锥型
2
2
V形
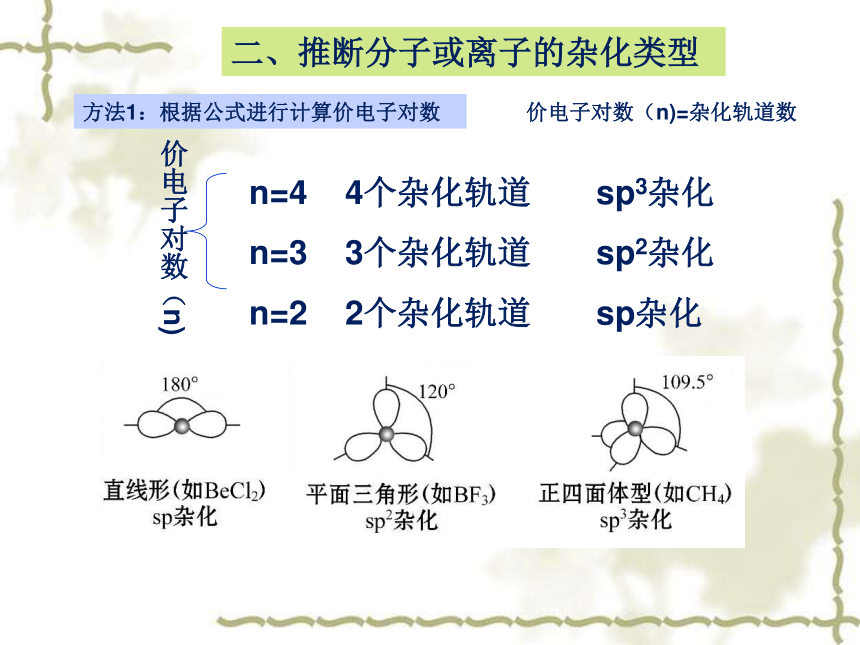
二、推断分子或离子的杂化类型
n=4
4个杂化轨道
sp3杂化
n=3
3个杂化轨道
sp2杂化
n=2
2个杂化轨道
sp杂化
价电子对数(n)
价电子对数(n)=杂化轨道数
方法1:根据公式进行计算价电子对数
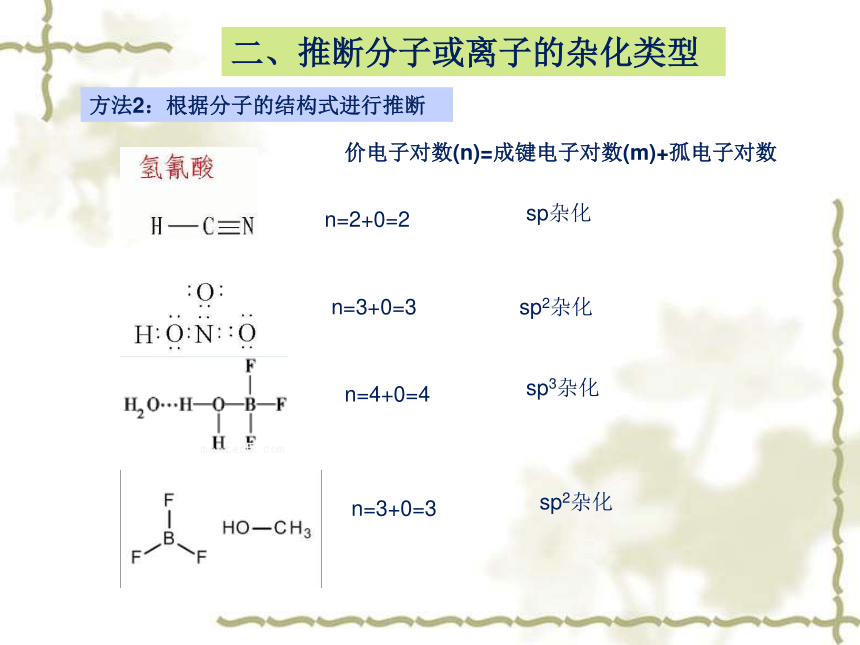
方法2:根据分子的结构式进行推断
价电子对数(n)=成键电子对数(m)+孤电子对数
n=2+0=2
sp杂化
n=3+0=3
sp2杂化
n=4+0=4
sp3杂化
sp2杂化
n=3+0=3
二、推断分子或离子的杂化类型
方法3:根据分子空间构型推断杂化方式
分子空间构型
正四面体形
sp3杂化
平面三角形
sp2杂化
直线形
sp杂化
CH4
金刚石
SO3
BF3
HCHO
HCN
BeCl2
硫的含氧酸根中,中心原子采用sp3杂化,且有一对孤电子对的离子化学式:
SO32-
综合练习:
二、推断分子或离子的杂化类型
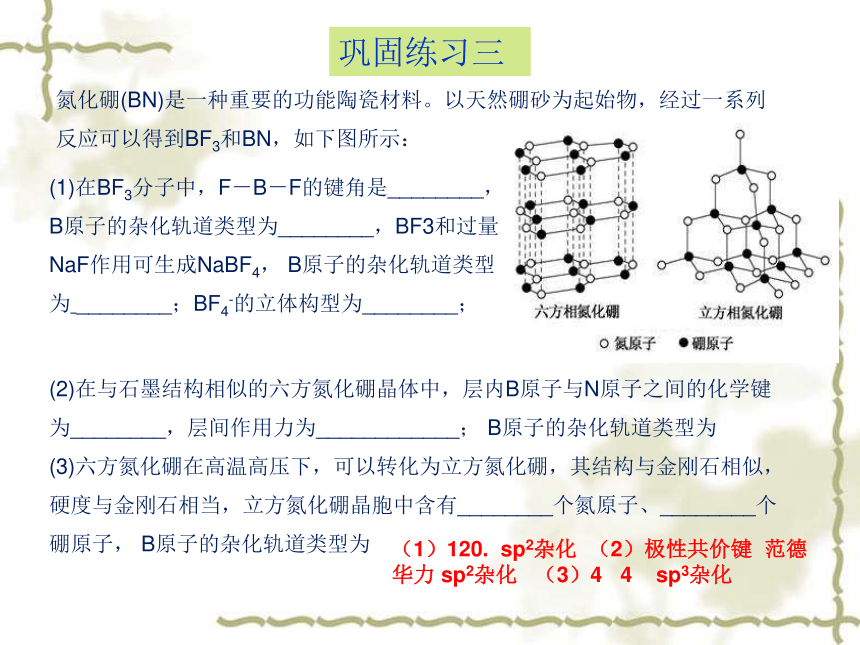
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
(1)在BF3分子中,F-B-F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,
B原子的杂化轨道类型为
________;BF4-的立体构型为________;
(2)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为____________;
B原子的杂化轨道类型为
(3)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶胞中含有________个氮原子、________个硼原子,
B原子的杂化轨道类型为
(1)120.
sp2杂化
(2)极性共价键
范德华力
sp2杂化
(3)4
4
sp3杂化
巩固练习三
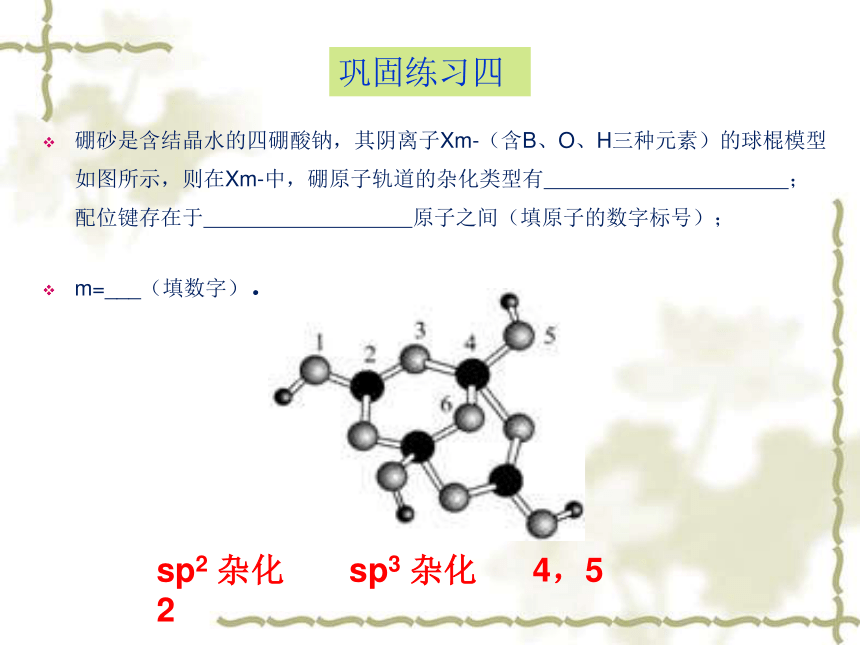
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有
;配位键存在于
原子之间(填原子的数字标号);
m=___(填数字).
巩固练习四
sp2
杂化
sp3
杂化
4,5
2
肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
(1)NH3分子的空间构型是________氮原子轨道的杂化类型是________。
(2)NH4+的空间构型是
氮原子轨道的杂化类型是________。
(3)N2H4的结构式为
分子中氮原子轨道的杂化类型是________
(1)三角锥形
sp3杂化
(2)正四面体形
sp3杂化
(3)
sp3杂化
巩固练习五
三聚氰胺是“三鹿奶粉事件”的罪魁祸首,其结构式如下图所示。下列关于三聚氰胺的说法正确的是
下列关于三聚氰胺分子的说法中正确的是
.
A.所有碳原子采用sp2杂化.所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.三聚氰胺分子中的所有原子均位于同一平面上
D.形成的晶体熔点较高
E
.三聚氰胺的分子式为C3H6N6
F.在乳品中添加三聚氰胺可提高乳品的营养成分
G.三聚氰胺具有碱性,能与盐酸反应生成盐?
H、三聚氰胺的核磁共振氢谱图中有一个峰
I.三聚氰胺分子中6个氮原子所处的地位并不是完全相同的
J.三聚氰胺属于芳香烃?
B
E
G
H
I
巩固练习六
MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,
X射线衍射实验测得MgO的晶胞参数为a=0.420
nm,
则r(O2-)为 nm。MnO也属于NaCl型结构,
晶胞参数为a'=0.448
nm,则r(Mn2+)为 nm。
加餐练习
0.148
0.076
对于ABm型分子(A为中心原子,B为配位原子),分子的价电子对数可以通过下式确定:
一、根据价电子对数进行推断
总原则:价电子对数(n)=杂化轨道数
价电子对数(n)
价电子对数(n)
n=4
4个杂化轨道
sp3杂化
n=3
3个杂化轨道
sp2杂化
n=2
2个杂化轨道
sp杂化
注意:①其中中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子提供1个电子,氧、硫原子按不提供电子计算。②对于复杂离子,在计算价电子对数时,还应加上阴离子的电荷数或减去阳离子的电荷数;
题型一:已知分子式推断分子构型及杂化类型
价电子对数(n)
n=4
4个杂化轨道
sp3杂化
n=3
3个杂化轨道
sp2杂化
n=2
2个杂化轨道
sp杂化
价电子对数(n)
总原则:价电子对数(n)=杂化轨道数
题型一:已知分子式推断分子构型及杂化类型
总原则:价电子对数(n)=杂化轨道数
总原则:价电子对数(n)=杂化轨道数
总原则:价电子对数(n)=杂化轨道数
总原则:价电子对数(n)=杂化轨道数
题型二:根据分子的空间构型推断杂化方式
3.根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式分别为 ( )
A.直线形、sp杂化
B.三角形、sp2杂化
C.三角锥型、sp2杂化
D.三角锥型、sp3杂化
【解析】选D。氮原子的杂化轨道数为3+1=4,采用sp3杂化。氮原子
的价电子对数为
=4,氮原子结合了3个原子,故该分子呈三角锥型。
第一步:确定中心原子上的价层电子对数(
ABm型分子)
第二步:确定价层电子对的立体构型
第三步:分子立体构型的确定
n=4
四面体形
例如:
CH4
CCl4
SO42-
n=3
平面三角形
例如:BF3
SO3
CO32-
n=2
直线形
例如:CO2
BeCl2
价电子对数(n)
即:去掉孤电子对后成键电子的立体构型
n=价电子对
m=成键电子对
n-m=孤电子对
第一步:确定中心原子上的价层电子对数(
ABm型分子)
推断分子或离子立体构型“三步曲”
第二步:确定价层电子对的立体构型
价电子对数(n)
第二步:确定价层电子对的立体构型
价电子对数(n)
第三步:分子立体构型的确定
n=价电子对
m=成键电子对
n-m=孤电子对
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(2)
(3)在BF3分子中,F-B-F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,
的立体构型为________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为____________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
练习一
BF3与一定量的水可形成(H2O)2·BF3晶体,结构如下图所示则(H2O)2·BF3晶体中各种微粒间的作用力不涉及
A.共价键????????B.离子键
C.配位键????????D.范德华力
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
A、正硼酸晶体中只存在氢键B、H3BO3分子的稳定性与氢键有关C、分子中硼原子最外层为8e-稳定结构D、含1molH3BO3的晶体中有3mol氢键
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)
若该反应中有4
mol
N—H键断裂,则形成的π键有________mol。③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在________(填标号)。
a.离子键?
????????????????????????????????
b.共价键
c.配位键?
????????????????????????????????
d.范德华力
(2)(2012·新课标全国节选)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为____________,SO
离子的立体构型为____________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
H2SeO4比H2SeO3酸性强的原因:______________________________________
_________________________________________________________。
答案 (1)①三角锥形 sp3 ②3 ③d (2)①强 平面三角形 三角锥形 ②H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是()A.分子中N、O间形成的共价键是非极性键B.分子中四个氮原子共平面C.该物质既有氧化性又有还原性D.15.2g该物质含有6.02×1022个原子
E.该分子中不连接O原子的N原子是sp3杂化
(2)sp杂化和sp2杂化的两种形式中,原子还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对。
(2)根据n值判断杂化类型。
n=2时,sp杂化,如BeCl2,n=
×(2+2)=2;
n=3时,sp2杂化,如N
,n=
×(5+1)=3;
n=4时,sp3杂化,如N
,n=
×(5+4-1)=4。
【点拨】
(1)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(2)杂化前后轨道数目不变。
(3)只有能量相近的轨道才能杂化(如2s和2p)。
(4)杂化轨道成键时要满足化学键间最小排斥原理。杂化轨道间的夹角决定分子的空间构型。
(5)杂化轨道所形成的化学键全部为σ键。
2)sp杂化和sp2杂化的两种形式中,原子还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对。
分子构型与物质性质
苏教版
《物质结构与性质》专题四第一单元
一、推断分子或离子立体构型“三步曲”
第一步:确定中心原子上的价层电子对数(
ABm型分子)
第二步:确定价层电子对的立体构型
第三步:分子立体构型的确定
第一步:确定中心原子上的价层电子对数(
ABm型分子)
一、推断分子或离子立体构型“三步曲”
①其中中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子提供1个电子,氧、硫原子按不提供电子计算。②对于复杂离子,在计算价电子对数时,还应加上阴离子的电荷数或减去阳离子的电荷数;
n=成键电子对数+孤电子对数
成键电子对数=
m
孤电子对数=n-m
练习
BF3
CH4
SO2
SO42-
SO32-
NH4+
注意:
四面体形
平面三角形
直线形
第二步:确定价层电子对的立体构型(VSEPR模型)
价电子对数(n)
推断分子或离子立体构型“三步曲”
即:去掉孤电子对后只有成键电子时的立体构型
第三步:分子立体构型的确定
n=价电子对
m=成键电子对
n-m=孤电子对
n=4
n=3
n=2
例如:
CH4
NH3
H2O
例如:BF3
SO2
CO32-
例如:CO2
BeCl2
4
4
0
正四面体
正四面体
4
3
1
四面体
三角锥
4
2
2
四面体
V形
4
4
0
正四面体
正四面体
3
3
0
平面三角形
平面三角形
3
2
1
平面三角形
V形
4
3
1
四面体
三角锥形
2
2
0
直线形
直线形
2
2
0
直线形
直线形
巩固练习一
价电子对数
成键电子对数
孤电子对数
VSEPR模型
分子空间构型
CH4
NH3
H2O
NH4+
SO3
SO2
SO32-
CO2
BeCl2
BeCl2、CO2
BF3、SO3
SO2
CH4、CCl4
H2O
NH3、PCl3
巩固练习二
价电
子
成键电
子对数
孤电子对数
分子空间构型
实例
2
2
0
直线形
3
3
0
平面三角形
2
1
V形
O3
4
4
0
正四面体型
3
1
三角锥型
2
2
V形
二、推断分子或离子的杂化类型
n=4
4个杂化轨道
sp3杂化
n=3
3个杂化轨道
sp2杂化
n=2
2个杂化轨道
sp杂化
价电子对数(n)
价电子对数(n)=杂化轨道数
方法1:根据公式进行计算价电子对数
方法2:根据分子的结构式进行推断
价电子对数(n)=成键电子对数(m)+孤电子对数
n=2+0=2
sp杂化
n=3+0=3
sp2杂化
n=4+0=4
sp3杂化
sp2杂化
n=3+0=3
二、推断分子或离子的杂化类型
方法3:根据分子空间构型推断杂化方式
分子空间构型
正四面体形
sp3杂化
平面三角形
sp2杂化
直线形
sp杂化
CH4
金刚石
SO3
BF3
HCHO
HCN
BeCl2
硫的含氧酸根中,中心原子采用sp3杂化,且有一对孤电子对的离子化学式:
SO32-
综合练习:
二、推断分子或离子的杂化类型
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
(1)在BF3分子中,F-B-F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,
B原子的杂化轨道类型为
________;BF4-的立体构型为________;
(2)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为____________;
B原子的杂化轨道类型为
(3)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶胞中含有________个氮原子、________个硼原子,
B原子的杂化轨道类型为
(1)120.
sp2杂化
(2)极性共价键
范德华力
sp2杂化
(3)4
4
sp3杂化
巩固练习三
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有
;配位键存在于
原子之间(填原子的数字标号);
m=___(填数字).
巩固练习四
sp2
杂化
sp3
杂化
4,5
2
肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
(1)NH3分子的空间构型是________氮原子轨道的杂化类型是________。
(2)NH4+的空间构型是
氮原子轨道的杂化类型是________。
(3)N2H4的结构式为
分子中氮原子轨道的杂化类型是________
(1)三角锥形
sp3杂化
(2)正四面体形
sp3杂化
(3)
sp3杂化
巩固练习五
三聚氰胺是“三鹿奶粉事件”的罪魁祸首,其结构式如下图所示。下列关于三聚氰胺的说法正确的是
下列关于三聚氰胺分子的说法中正确的是
.
A.所有碳原子采用sp2杂化.所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.三聚氰胺分子中的所有原子均位于同一平面上
D.形成的晶体熔点较高
E
.三聚氰胺的分子式为C3H6N6
F.在乳品中添加三聚氰胺可提高乳品的营养成分
G.三聚氰胺具有碱性,能与盐酸反应生成盐?
H、三聚氰胺的核磁共振氢谱图中有一个峰
I.三聚氰胺分子中6个氮原子所处的地位并不是完全相同的
J.三聚氰胺属于芳香烃?
B
E
G
H
I
巩固练习六
MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,
X射线衍射实验测得MgO的晶胞参数为a=0.420
nm,
则r(O2-)为 nm。MnO也属于NaCl型结构,
晶胞参数为a'=0.448
nm,则r(Mn2+)为 nm。
加餐练习
0.148
0.076
对于ABm型分子(A为中心原子,B为配位原子),分子的价电子对数可以通过下式确定:
一、根据价电子对数进行推断
总原则:价电子对数(n)=杂化轨道数
价电子对数(n)
价电子对数(n)
n=4
4个杂化轨道
sp3杂化
n=3
3个杂化轨道
sp2杂化
n=2
2个杂化轨道
sp杂化
注意:①其中中心原子的价电子数等于中心原子的最外层电子数,配位原子中卤素原子、氢原子提供1个电子,氧、硫原子按不提供电子计算。②对于复杂离子,在计算价电子对数时,还应加上阴离子的电荷数或减去阳离子的电荷数;
题型一:已知分子式推断分子构型及杂化类型
价电子对数(n)
n=4
4个杂化轨道
sp3杂化
n=3
3个杂化轨道
sp2杂化
n=2
2个杂化轨道
sp杂化
价电子对数(n)
总原则:价电子对数(n)=杂化轨道数
题型一:已知分子式推断分子构型及杂化类型
总原则:价电子对数(n)=杂化轨道数
总原则:价电子对数(n)=杂化轨道数
总原则:价电子对数(n)=杂化轨道数
总原则:价电子对数(n)=杂化轨道数
题型二:根据分子的空间构型推断杂化方式
3.根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式分别为 ( )
A.直线形、sp杂化
B.三角形、sp2杂化
C.三角锥型、sp2杂化
D.三角锥型、sp3杂化
【解析】选D。氮原子的杂化轨道数为3+1=4,采用sp3杂化。氮原子
的价电子对数为
=4,氮原子结合了3个原子,故该分子呈三角锥型。
第一步:确定中心原子上的价层电子对数(
ABm型分子)
第二步:确定价层电子对的立体构型
第三步:分子立体构型的确定
n=4
四面体形
例如:
CH4
CCl4
SO42-
n=3
平面三角形
例如:BF3
SO3
CO32-
n=2
直线形
例如:CO2
BeCl2
价电子对数(n)
即:去掉孤电子对后成键电子的立体构型
n=价电子对
m=成键电子对
n-m=孤电子对
第一步:确定中心原子上的价层电子对数(
ABm型分子)
推断分子或离子立体构型“三步曲”
第二步:确定价层电子对的立体构型
价电子对数(n)
第二步:确定价层电子对的立体构型
价电子对数(n)
第三步:分子立体构型的确定
n=价电子对
m=成键电子对
n-m=孤电子对
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
(1)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(2)
(3)在BF3分子中,F-B-F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,
的立体构型为________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为____________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA)。
练习一
BF3与一定量的水可形成(H2O)2·BF3晶体,结构如下图所示则(H2O)2·BF3晶体中各种微粒间的作用力不涉及
A.共价键????????B.离子键
C.配位键????????D.范德华力
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
A、正硼酸晶体中只存在氢键B、H3BO3分子的稳定性与氢键有关C、分子中硼原子最外层为8e-稳定结构D、含1molH3BO3的晶体中有3mol氢键
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)
若该反应中有4
mol
N—H键断裂,则形成的π键有________mol。③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在________(填标号)。
a.离子键?
????????????????????????????????
b.共价键
c.配位键?
????????????????????????????????
d.范德华力
(2)(2012·新课标全国节选)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为____________,SO
离子的立体构型为____________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
H2SeO4比H2SeO3酸性强的原因:______________________________________
_________________________________________________________。
答案 (1)①三角锥形 sp3 ②3 ③d (2)①强 平面三角形 三角锥形 ②H2SeO3和H2SeO4可表示为(HO)2SeO和(HO)2SeO2,H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是()A.分子中N、O间形成的共价键是非极性键B.分子中四个氮原子共平面C.该物质既有氧化性又有还原性D.15.2g该物质含有6.02×1022个原子
E.该分子中不连接O原子的N原子是sp3杂化
(2)sp杂化和sp2杂化的两种形式中,原子还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对。
(2)根据n值判断杂化类型。
n=2时,sp杂化,如BeCl2,n=
×(2+2)=2;
n=3时,sp2杂化,如N
,n=
×(5+1)=3;
n=4时,sp3杂化,如N
,n=
×(5+4-1)=4。
【点拨】
(1)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(2)杂化前后轨道数目不变。
(3)只有能量相近的轨道才能杂化(如2s和2p)。
(4)杂化轨道成键时要满足化学键间最小排斥原理。杂化轨道间的夹角决定分子的空间构型。
(5)杂化轨道所形成的化学键全部为σ键。
2)sp杂化和sp2杂化的两种形式中,原子还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对。
