高中化学沪科版高一下学期7.3.1盐溶液的酸碱性(盐类的水解)(共21张PPT)
文档属性
| 名称 | 高中化学沪科版高一下学期7.3.1盐溶液的酸碱性(盐类的水解)(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 573.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-02 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
苏打水是碳酸氢钠(NaHCO?,俗称小苏打)的水溶液,也叫弱碱性水,是带有弱碱性的饮料。
7.3盐溶液的酸碱性
(ACIDITY
AND
BASICCITY
OF
SALT
SOLUTIONS)
取决于c(H+)和c(OH-
)的相对大小。
水溶液的酸碱性取决于什么?
回顾与思考
c(H+)
>c(OH-
)
酸性
c(H+)
)
碱性
c(H+)
=c(OH-
)
中性
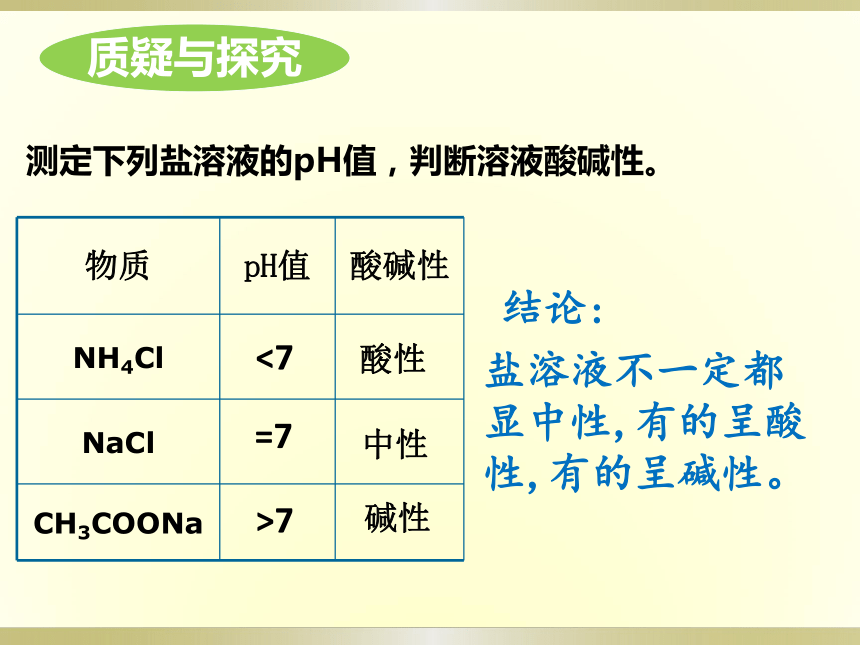
测定下列盐溶液的pH值,判断溶液酸碱性。
物质
pH值
酸碱性
NH4Cl
NaCl
CH3COONa
结论:
盐溶液不一定都显中性,有的呈酸性,有的呈碱性。
<7
=7
>7
酸性
碱性
中性
质疑与探究
探究与实践
盐溶液的酸碱性判断
用pH探头测定0.1mol/L硝酸钾、碳酸钠、硫酸铝、硫酸钠、氯化铁和硫化钠溶液的pH
值。判断溶液的酸碱性。
实验结果汇报
实验结果
溶液呈酸性的有________、
________溶液;
溶液呈中性的有________
、
________溶液;
溶液呈碱性的有________
、
________溶液;
硫酸铝
氯化铁
硝酸钾
硫酸钠
碳酸钠
硫化钠
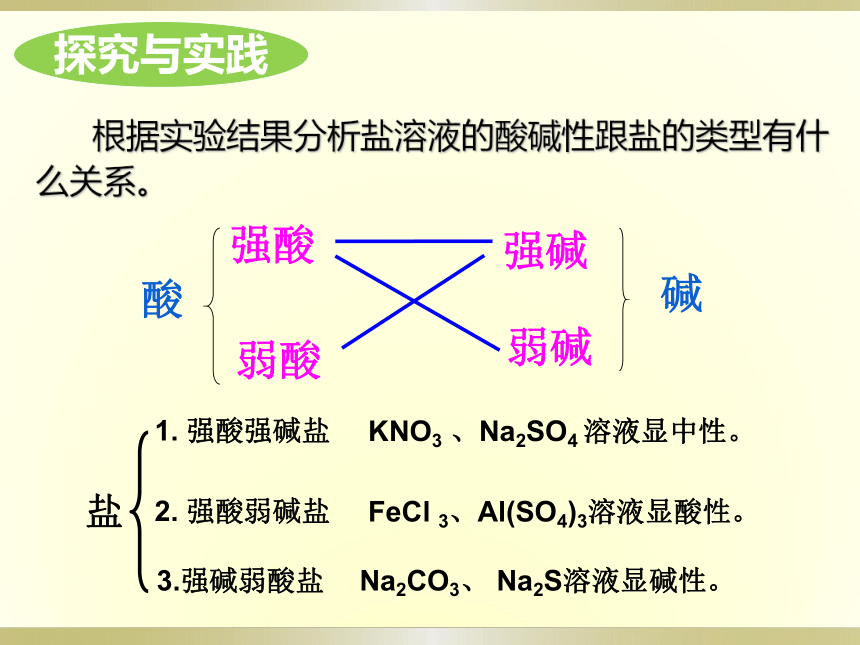
根据实验结果分析盐溶液的酸碱性跟盐的类型有什么关系。
酸
强酸
弱酸
弱碱
强碱
碱
盐
1.
强酸强碱盐
2.
强酸弱碱盐
3.强碱弱酸盐
KNO3
、Na2SO4
溶液显中性。
FeCl
3、Al(SO4)3溶液显酸性。
Na2CO3、
Na2S溶液显碱性。
探究与实践
1、下列盐的水溶液中,哪些呈酸性(
)
哪些呈碱性(
),哪些呈中性(
)
A.
FeCl3
B.
NaClO
C.
(NH4)2SO4
D.
Na2S
E.K2SO4
F.
KI
G.
NaF
AC
BDG
小试身手
EF
NH4Cl
=
Cl-
+
NH4+
H2O
H+
+
OH-
+
NH3·H2O
NH4+
+
H2O
NH3·H2O
+
H+
所以导致溶液中c(H+)
>
c(OH-)溶液显酸性
NH4Cl
+
H2O
NH3·H2O
+
HCl
平衡向右移动
离子方程式:
化学方程式:
CH3COONa溶液显碱性的原因:
(1)CH3COONa溶液中存在哪些电离?
(2)
CH3COONa溶液中存在哪些离子?
(3)哪些微粒可能发生相互作用?
探
究
CH3COONa
CH3COO-
H2O
H+
+
CH3COOH
平衡向右移动
Na+
+
OH-
+
所以导致溶液中c(
OH-
)>c(
H+
)溶液显碱性。
CH3COO-+H2O
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
离子方程式:
三、盐类的水解
1.定义:在溶液中盐电离产生的离子与水电离
产生的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.实质:盐电离出的离子与水电离出的离子反应生成弱电解质,破坏了水的电离平衡,促进了水的电离。破坏了H+和OH-浓度的等量关
系使溶液呈酸性或碱性。
弱酸阴离子或
弱碱阳离子
归纳
总结
探究
NaCl溶液为什么呈中性:
NaCl
Na+
+
Cl-
溶液存在四种离子:
Na+、Cl-
、H+、OH-,它们会相互反应吗?
所以:c(H+)
=
c(OH-)
溶液显中性
对水的电离平衡有影响么?
无
不反应
H2O
OH-
+
H+
酸
碱
盐的类型
是否水解
盐溶液的
酸碱性
强酸
强碱
弱酸
强碱
强酸
弱碱
弱酸
弱碱
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
弱酸弱碱盐
否
中性
是
碱性
(NaCl)
(CH3COONa)
(NH4Cl)
是
(CH3COONH4)
酸性
是
拓展
延伸
盐类水解有何规律?
中性
(3)盐类水解的规律:
有___才水解
都___都水解
无___不水解
同___显中性
越___越水解
谁___显谁性
注意:水解程度都是微弱的。
(填强或弱)
弱
弱
强
强
弱
弱
条件:
结果:
程度:
2、在溶液中,不能发生水解的离子是( )
A、ClO
-
B、CO32-
C、Fe3+
D、SO42--
D
小试身手
越弱越水解
酸性:H2CO3<CH3COOH
小试身手
3、CH3COONa、Na2CO3同样为强碱弱酸盐溶液,溶液都显碱性但相同浓度的两种溶液Na2CO3溶液碱性强,这是为什么?
随堂练习
相同物质的量溶度稀溶液pH有小到大顺序是:
二元强酸<一元强酸<弱酸<强酸弱碱盐<强酸强碱盐<强碱弱酸盐<弱碱<一元强碱<二元强碱
借题发挥
1.
(盐类)水解的实质:溶液中盐电离出来的离子跟____
电离出来的H+或OH-结合生成___________
的反应;
2.
只有_____________离子或___________离子才能与
水中H+或OH-结合生成弱电解质;
水
弱电解质
弱酸酸根
弱碱阳
小
结
苏打水是碳酸氢钠(NaHCO?,俗称小苏打)的水溶液,也叫弱碱性水,是带有弱碱性的饮料。
7.3盐溶液的酸碱性
(ACIDITY
AND
BASICCITY
OF
SALT
SOLUTIONS)
取决于c(H+)和c(OH-
)的相对大小。
水溶液的酸碱性取决于什么?
回顾与思考
c(H+)
>c(OH-
)
酸性
c(H+)
碱性
c(H+)
=c(OH-
)
中性
测定下列盐溶液的pH值,判断溶液酸碱性。
物质
pH值
酸碱性
NH4Cl
NaCl
CH3COONa
结论:
盐溶液不一定都显中性,有的呈酸性,有的呈碱性。
<7
=7
>7
酸性
碱性
中性
质疑与探究
探究与实践
盐溶液的酸碱性判断
用pH探头测定0.1mol/L硝酸钾、碳酸钠、硫酸铝、硫酸钠、氯化铁和硫化钠溶液的pH
值。判断溶液的酸碱性。
实验结果汇报
实验结果
溶液呈酸性的有________、
________溶液;
溶液呈中性的有________
、
________溶液;
溶液呈碱性的有________
、
________溶液;
硫酸铝
氯化铁
硝酸钾
硫酸钠
碳酸钠
硫化钠
根据实验结果分析盐溶液的酸碱性跟盐的类型有什么关系。
酸
强酸
弱酸
弱碱
强碱
碱
盐
1.
强酸强碱盐
2.
强酸弱碱盐
3.强碱弱酸盐
KNO3
、Na2SO4
溶液显中性。
FeCl
3、Al(SO4)3溶液显酸性。
Na2CO3、
Na2S溶液显碱性。
探究与实践
1、下列盐的水溶液中,哪些呈酸性(
)
哪些呈碱性(
),哪些呈中性(
)
A.
FeCl3
B.
NaClO
C.
(NH4)2SO4
D.
Na2S
E.K2SO4
F.
KI
G.
NaF
AC
BDG
小试身手
EF
NH4Cl
=
Cl-
+
NH4+
H2O
H+
+
OH-
+
NH3·H2O
NH4+
+
H2O
NH3·H2O
+
H+
所以导致溶液中c(H+)
>
c(OH-)溶液显酸性
NH4Cl
+
H2O
NH3·H2O
+
HCl
平衡向右移动
离子方程式:
化学方程式:
CH3COONa溶液显碱性的原因:
(1)CH3COONa溶液中存在哪些电离?
(2)
CH3COONa溶液中存在哪些离子?
(3)哪些微粒可能发生相互作用?
探
究
CH3COONa
CH3COO-
H2O
H+
+
CH3COOH
平衡向右移动
Na+
+
OH-
+
所以导致溶液中c(
OH-
)>c(
H+
)溶液显碱性。
CH3COO-+H2O
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
离子方程式:
三、盐类的水解
1.定义:在溶液中盐电离产生的离子与水电离
产生的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.实质:盐电离出的离子与水电离出的离子反应生成弱电解质,破坏了水的电离平衡,促进了水的电离。破坏了H+和OH-浓度的等量关
系使溶液呈酸性或碱性。
弱酸阴离子或
弱碱阳离子
归纳
总结
探究
NaCl溶液为什么呈中性:
NaCl
Na+
+
Cl-
溶液存在四种离子:
Na+、Cl-
、H+、OH-,它们会相互反应吗?
所以:c(H+)
=
c(OH-)
溶液显中性
对水的电离平衡有影响么?
无
不反应
H2O
OH-
+
H+
酸
碱
盐的类型
是否水解
盐溶液的
酸碱性
强酸
强碱
弱酸
强碱
强酸
弱碱
弱酸
弱碱
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
弱酸弱碱盐
否
中性
是
碱性
(NaCl)
(CH3COONa)
(NH4Cl)
是
(CH3COONH4)
酸性
是
拓展
延伸
盐类水解有何规律?
中性
(3)盐类水解的规律:
有___才水解
都___都水解
无___不水解
同___显中性
越___越水解
谁___显谁性
注意:水解程度都是微弱的。
(填强或弱)
弱
弱
强
强
弱
弱
条件:
结果:
程度:
2、在溶液中,不能发生水解的离子是( )
A、ClO
-
B、CO32-
C、Fe3+
D、SO42--
D
小试身手
越弱越水解
酸性:H2CO3<CH3COOH
小试身手
3、CH3COONa、Na2CO3同样为强碱弱酸盐溶液,溶液都显碱性但相同浓度的两种溶液Na2CO3溶液碱性强,这是为什么?
随堂练习
相同物质的量溶度稀溶液pH有小到大顺序是:
二元强酸<一元强酸<弱酸<强酸弱碱盐<强酸强碱盐<强碱弱酸盐<弱碱<一元强碱<二元强碱
借题发挥
1.
(盐类)水解的实质:溶液中盐电离出来的离子跟____
电离出来的H+或OH-结合生成___________
的反应;
2.
只有_____________离子或___________离子才能与
水中H+或OH-结合生成弱电解质;
水
弱电解质
弱酸酸根
弱碱阳
小
结
