原子核外电子排布 教学课件
图片预览






文档简介
(共18张PPT)
专题2 原子结构与元素的性质
原子核外电子的排布
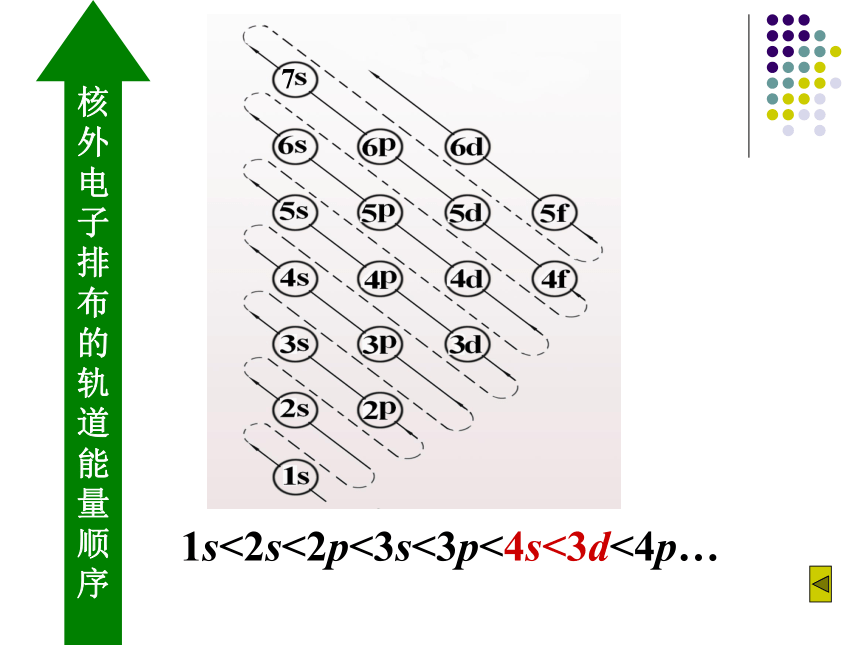
1. 比较下列原子轨道的能量高低:
(1)3s、3p、 3d
(2)2p、3p、 4p
(3)2px、2py 、2pz
(4)1s、2p、3p、2s、3s、3d、4s 、4p
3s<3p<3d
2p<3p<4p
2px=2py =2pz
1s < 2s < 2p < 3s < 3p
< 4s < 3d < 4p …
↑↓
1s
2s
2p
↑↓
↑
2. 写出碳原子、镁原子的轨道表示式和电子排布式
6C
↑
1s2 2s2 2p2
12Mg
↑↓
↑↓
↑↓
1s
2s
↑↓
↑↓
2p
↑↓
3s
3.写出铬原子和铜原子的电子排布式及“原子实”表示法
24Cr
[ Ar ]3d54s1
29Cu
[ Ar ]3d104s1
1H
1s1
电子排布式
2s1
×
(1)能量最低原理
原子核外电子先占有能量低的轨道,然后再依次进入能量高的轨道,这样使整个原子处于最低的能量状态。
原子核外电子排布所遵循的原理
核 外 电 子 排
布
的
轨
道
能
量
顺
序
1s<2s<2p<3s<3p<4s<3d<4p…
7
2He
电子排布式
1s2
轨道表示式
↑↑
1s
↑↓
1s
×
1s1 2s1
×
…
能量最低原理
每个原子轨道上最多只能容纳两个自旋状态不同的电子。
(2)泡利(Pauli)不相容原理
3Li
6C
1s2 2s1
试一试 你能行
1s2 2s22p2
1s
2s
1s
2s
2p
↑↓
↑↓
?
↑↓
↑
写出下列原子的核外电子排布式和轨道表示式。
6C可能轨道表示式
↑↓
1s
2s
2p
↑↓
↑↑
√
↑↓
1s
2s
2p
↑↓
↑↓
↑↓
1s
2s
2p
↑↓
↑
↑
↑↓
1s
2s
2p
↑↓
↑
↓
洪特规则
(3)洪特规则
电子在能量相同的各个轨道上排布时,尽可能分占不同的原子轨道,且自旋状态相同,使整个原子能量最低。
原子核外电子排布所遵循的原理
1.下列轨道表示式能表示氮原子(7N)的最低能量状态的是( )
A、
B、
C、
D、
E、
↑↓
↑
↑↓
↑
1s
2s
2p
↑↓
↑↓
↑
↓
1s
2s
2p
↑
↑↓
↑↓
↑↓
↑
1s
2s
2p
↑↓
↑↑
↑
↑
1s
2s
2p
↑
↑
↑↓
↑↓
↑
↑
1s
2s
2p
↑
E
试一试 你能行
写出下列原子的核外电子排布式和轨道表示式。
氟(9F)
镁(12Mg)
问题解决
↑↓
↑↓
↑↓
1s
2s
↑↓
↑↓
2p
↑↓
3s
↑↓
↑↓
↑↓
↑↓
1s
2s
2p
↑
11Na
12Mg
13Al
14Si
15P
16S
17Cl
18Ar
交流与讨论:
第三周期元素的原子核外电子排布有哪些规律?
(相同点、不同点)
原子实
外围电子排布式
3s1
3s2
3s13p1
试一试 你能行
1、写出下列原子的电子排布式
从第四周期开始出现能级交错现象,3d和4s轨道的能级之差很小,同时还由于洪特规则的作用,因此,情况比较复杂。
19K
20Ca
21Sc
24Cr
1s22s22p63s23p64s1
1s22s22p63s23p64s2
1s22s22p63s23p63d14s2
[ Ar ]4s1
[ Ar ]4s2
[ Ar ]3d14s2
[ Ar ]3d54s1
当能量相同的原子轨道处于半充满或全充满状态时,整个体系能量最低。
洪特规则特例:
全充满
半充满
29Cu
本课总结:
一、原子核外电子排布遵循的原理和规则
二、原子核外电子排布的表示式
原子核外电子的排布
能量最低原理
泡利不相容原理
洪特规则
电子排布式
轨道表示式
专题2 原子结构与元素的性质
原子核外电子的排布
1. 比较下列原子轨道的能量高低:
(1)3s、3p、 3d
(2)2p、3p、 4p
(3)2px、2py 、2pz
(4)1s、2p、3p、2s、3s、3d、4s 、4p
3s<3p<3d
2p<3p<4p
2px=2py =2pz
1s < 2s < 2p < 3s < 3p
< 4s < 3d < 4p …
↑↓
1s
2s
2p
↑↓
↑
2. 写出碳原子、镁原子的轨道表示式和电子排布式
6C
↑
1s2 2s2 2p2
12Mg
↑↓
↑↓
↑↓
1s
2s
↑↓
↑↓
2p
↑↓
3s
3.写出铬原子和铜原子的电子排布式及“原子实”表示法
24Cr
[ Ar ]3d54s1
29Cu
[ Ar ]3d104s1
1H
1s1
电子排布式
2s1
×
(1)能量最低原理
原子核外电子先占有能量低的轨道,然后再依次进入能量高的轨道,这样使整个原子处于最低的能量状态。
原子核外电子排布所遵循的原理
核 外 电 子 排
布
的
轨
道
能
量
顺
序
1s<2s<2p<3s<3p<4s<3d<4p…
7
2He
电子排布式
1s2
轨道表示式
↑↑
1s
↑↓
1s
×
1s1 2s1
×
…
能量最低原理
每个原子轨道上最多只能容纳两个自旋状态不同的电子。
(2)泡利(Pauli)不相容原理
3Li
6C
1s2 2s1
试一试 你能行
1s2 2s22p2
1s
2s
1s
2s
2p
↑↓
↑↓
?
↑↓
↑
写出下列原子的核外电子排布式和轨道表示式。
6C可能轨道表示式
↑↓
1s
2s
2p
↑↓
↑↑
√
↑↓
1s
2s
2p
↑↓
↑↓
↑↓
1s
2s
2p
↑↓
↑
↑
↑↓
1s
2s
2p
↑↓
↑
↓
洪特规则
(3)洪特规则
电子在能量相同的各个轨道上排布时,尽可能分占不同的原子轨道,且自旋状态相同,使整个原子能量最低。
原子核外电子排布所遵循的原理
1.下列轨道表示式能表示氮原子(7N)的最低能量状态的是( )
A、
B、
C、
D、
E、
↑↓
↑
↑↓
↑
1s
2s
2p
↑↓
↑↓
↑
↓
1s
2s
2p
↑
↑↓
↑↓
↑↓
↑
1s
2s
2p
↑↓
↑↑
↑
↑
1s
2s
2p
↑
↑
↑↓
↑↓
↑
↑
1s
2s
2p
↑
E
试一试 你能行
写出下列原子的核外电子排布式和轨道表示式。
氟(9F)
镁(12Mg)
问题解决
↑↓
↑↓
↑↓
1s
2s
↑↓
↑↓
2p
↑↓
3s
↑↓
↑↓
↑↓
↑↓
1s
2s
2p
↑
11Na
12Mg
13Al
14Si
15P
16S
17Cl
18Ar
交流与讨论:
第三周期元素的原子核外电子排布有哪些规律?
(相同点、不同点)
原子实
外围电子排布式
3s1
3s2
3s13p1
试一试 你能行
1、写出下列原子的电子排布式
从第四周期开始出现能级交错现象,3d和4s轨道的能级之差很小,同时还由于洪特规则的作用,因此,情况比较复杂。
19K
20Ca
21Sc
24Cr
1s22s22p63s23p64s1
1s22s22p63s23p64s2
1s22s22p63s23p63d14s2
[ Ar ]4s1
[ Ar ]4s2
[ Ar ]3d14s2
[ Ar ]3d54s1
当能量相同的原子轨道处于半充满或全充满状态时,整个体系能量最低。
洪特规则特例:
全充满
半充满
29Cu
本课总结:
一、原子核外电子排布遵循的原理和规则
二、原子核外电子排布的表示式
原子核外电子的排布
能量最低原理
泡利不相容原理
洪特规则
电子排布式
轨道表示式
