第三节 氧化剂和还原剂
图片预览








文档简介
(共29张PPT)
第三节 氧化剂和还原剂
第1课时 氧化还原反应
[知识目标]
(1)通过化学反应的分析,从化合价的变化认识并建立氧化还原反应的概念。
(2)通过实验事实和思考,初步理解氧化还原反应的本质是电子转移。
(3)联系生活、生产实际,初步了解氧化还原反应对人类社会的利弊。
[能力目标]
学会用化合价的变化或电子转移来判断氧化还原反应。
[情感目标]
培养学生能用辨证的对立统一的观点分析事物的意识。
[教学重点]
(1)认识并建立氧化还原反应的概念。
(2)理解氧化还原反应的本质是电子转移。
[教学难点]
从化合价的变化,认识并建立氧化还原反应的概念。
写出下列反应化学方程式,标出各元素的化合价。
[交流研讨]
0
0
-2
+2
2Cu + O2 = 2CuO
1、铜与氧气反应。
2、氧化铜与氢气反应。
3、碳酸钙高温分解。
4、铁与硫酸铜溶液反应。
5、NaCl溶液与AgNO3溶液反应。
CuO + H2 = Cu + H2O
+2
-2
0
0
+1
-2
CaCO3 = CaO + CO2
高温
+2
+2
+4
+4
-2
-2
-2
Fe + CuSO4 = FeSO4 + Cu
0
+2
+6
-2
+2
+6
-2
0
NaCl + AgNO3 = AgCl ↓ + NaNO3
+1
-1
+1
-1
+1
+1
+5
-2
+5
-2
[讨论]
分析每一个反应各反应物和生成物所含元素的化合
价的变化情况。探讨元素的化合价变化的实质是什么?
一、氧化还原反应
什么是氧化反应,什么是还原反应?
2Cu + O2 = 2CuO
CuO + H2 = Cu + H2O
[特征]
1、元素的化合价在有些化学反应中有变化。
氧化反应与还原反应的关系
CuO + H2 = Cu + H2O
+2
-2
0
0
+1
-2
⑶、分析氧化还原反应的实质是什么?
⑷、讨论化合价升降与电子转移有何关系?
[活动探究]
①铁与硫酸铜溶液作用
⑴、写出Fe与CuSO4反应的现象和离子方程式。
⑵、讨论电流计的指针为什么会偏转?
电流计的指针发生偏转,说明有电流产生,说明反
应过程中电子发生定向运动。
氧化还原反应的实质是电子转移。
反应物失去电子,所含元素化合价升高,反应过程
称为氧化反应。反应物得到电子,所含元素化合价降低,
反应过程称为还原反应。
铁表面有红色物质产生。Cu + Fe = Cu + Fe
2+
2+
2、氧化还原反应
①概念
②实质
③表现形式
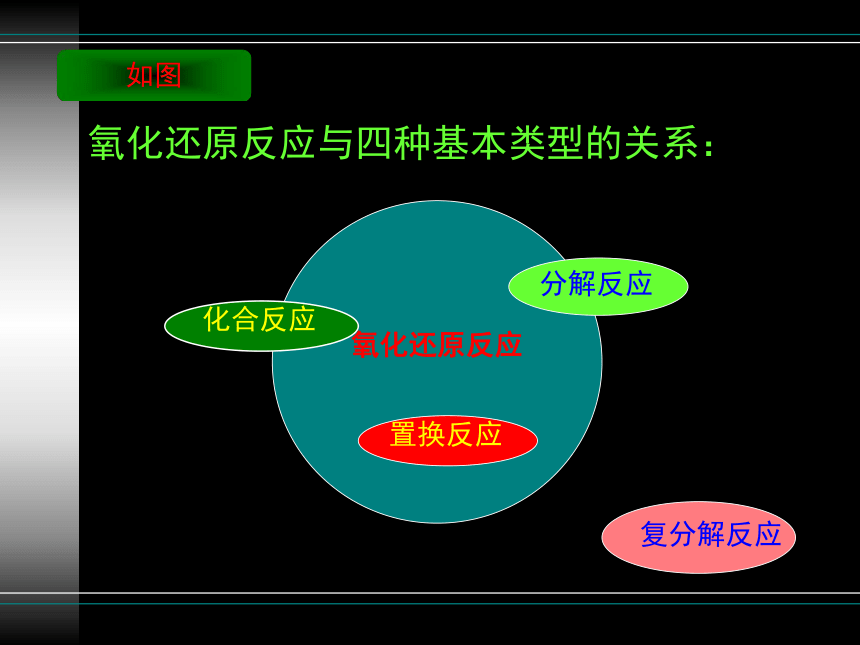
④氧化还原反应与四种基本反应类型有何关系?
D、所有的复分解反应都是非氧化还原反应。
B、有单质生成的分解反应是氧化还原反应。
A、有单质参与的化合反应是氧化还原反应。
C、所有的置换反应都是氧化还原反应。
反应物所含元素化合价升高的反应称为氧化反应;
反应物所含元素化合价降低的反应称为还原反应。
在反应过程中有元素化合价变化的化学反应叫做氧化还原反应
电子的转移
反应物所含元素化合价升降。
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应与四种基本类型的关系:
如图
第2课时 氧化剂和还原剂
知识目标
(1)通过化学反应的分析,能从化合价变化和电子转移认识并建立氧化剂、还原剂的概念。
(2)通过实验事实和思考,初步了解化合价与氧化剂、还原剂关系的一般规律。
(3)了解常见的氧化剂、还原剂。
能力目标
学会用化合价的变化或电子转移来判断氧化剂、还原剂,根据元素的化合价推断物质的性质。
情感目标
培养学生能用辨证的对立统一的观点分析事物的意识。
2.在以上的氧化还原反应中,哪些元素的化合价升高
了?哪些元素的化合价降低了?指出含有这些元素的具
体物质。
[练习]
1.下列化学反应中,哪些属于氧化还原反应?为什么?
Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO
还原剂是所含元素的化合价升高的反应物。
二、氧化剂和还原剂
1、氧化剂是所含元素的化合价降低的反应物。
2、氧化剂得到电子,化合价降低,发生还原反应。
还原剂失去电子,化合价升高,发生氧化反应。
氧化性是氧化剂具有性质,即具有使还原剂发生氧化反应的性质。
还原性是还原剂具有性质,即具有使氧化剂发生还原反应的性质。
[问]从化合价升降和电子转移角度讨论,氧化剂、还原剂
与氧化还原反应有何关系?
下列化学反应中,哪些属于氧化还原反应?
哪些是氧化剂?哪些是还原剂?
Fe+4HNO3 == Fe(NO3)3+2H2O+NO↑
BaCl2 + H2SO4 == BaSO4↓+ 2HCl
2H2O2 == 2H2O +O2↑
Fe2O3+3CO == 2Fe + 3CO2
[问]分析练习中元素的价态与氧化剂还原剂的关系。
[讨论]以KMnO4和KI为例,讨论元素的化合价与物质的
氧化性、还原性有何关系?
3、元素的化合价与物质的氧化性、还原性关系
含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性又有还原性。
在一般情况下,下列物质反应中是氧化剂,还是
还原剂?
O2、Cl2、H2、Na、Cu、SO2、S 、HNO3、浓H2SO4、
Fe 、HCl
2-
3+
[迁移 应用]
4、常见的氧化剂和还原剂
[概括 整合]
氧化还原反应对立统一关系
反应物 反应物性质 实质 元素(判断依据) 反应过程
还原剂 → 还原性 → 失e- → 化合价升高 → 氧化反应
氧化剂 → 氧化性 → 得e- → 化合价降低 → 还原反应
第3课时
探究铁及其化合物
的氧化性和还原性
[教学难点] 实验方案的设计
[知识目标]
(1)通过实验探究,使学生掌握金属铁、氯化亚铁、氯化铁的相互转化关系。
(2)通过金属铁、氯化亚铁、氯化铁的性质实验探究,进一步巩固氧化还原反应的知识。
[能力目标]
通过实验探究,使学生学会用“用已知物质的性质验证未知物性质”的科学方法。
[情感目标]
培养学生与他人合作的意识和品质。
[教学重点]
(1)实验方案的设计
(2)金属铁、氯化亚铁、氯化铁的相互转化关系。
[考察注意力]
课前展示的图片中涉及哪些铁的化合物?
指出这些过程中铁元素发生了什么变化?
写出常见铁的化合物的化学式,并标出铁的化合价。
[涉及知识点]
冶炼钢铁、铁的腐蚀、铁矿石、金属铁、
铁的氧化物、铁的氢氧化物、铁盐。
[有关物质]
FeS2、 Fe2O3、 Fe3O4、 FeSO4 H2O、 Fe(OH)2、
Fe(OH)3、 FeCl3 H2O
3Fe + 2O2 = Fe3O4
点燃
Fe2O3 + 3CO = 2Fe +3CO2
高温
[有关反应]
2Fe + 2H2O + O2 = 2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe(OH)3→Fe2O3 xH2O
4FeS2+11O2 = 8SO2+2Fe2O3
煅烧
Fe + Fe2(SO4)3 = 3FeSO4
在铁单质和铁的化合物中,哪些具有氧化性?
哪些具有还原性?(以金属铁、氯化亚铁、氯化铁为例
进行探究。 )
[问题探究]
3、如何证明物质具有氧化性或还原性?
[思考]
1、金属铁、氯化亚铁、氯化铁三种样品的颜色特征
是什么?
2、FeCl3如何检验?有何现象?
[实验探究]
铁单质和铁的化合物的性质
铁及其化合物的氧化性和还原性
Fe FeCl2 FeCl3
预测与假设:
具有氧化性的物质:
具有还原性的物质:
既具有氧化性又具有还原性:
Fe
FeCl2
FeCl3
提供的药品:
稀硫酸、稀硝酸、氯水
锌、铜
KSCN(硫氰化钾)
0
+2
+3
活动·探究
实验内容 实验现象 实验结论
铁 + 稀硫酸
铁粉溶解,有无色气体生成溶液由无色变成淡绿色
铁单质有还原性
铜 +
FeCl3溶液
溶液由黄色变成淡绿色
FeCl3
有氧化性
锌+
FeCl2溶液
溶液有淡绿色变成无色
FeCl2
有氧化性
FeCl2溶液+氯水+KSCN
溶液变红
FeCl2
有还原性
[交流 探讨]
1、铁有还原性,与稀硫酸、稀硝酸反应生成是Fe 还是
Fe ?
2+
3+
Fe + H2SO4 = FeSO4 + H2↑
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O
2、Fe 有氧化性,与Cu、Zn反应生成是Fe 还是Fe?
2+
3+
2Fe + Fe = 3Fe
2+
3+
2Fe + Zn = 2Fe + Zn
2+
3+
2+
2Fe + Cu = 2Fe + Cu
3+
2+
2+
[概括 整合]
1、为什么工业上利用氯化铁溶液腐蚀铜箔制印刷线
路板?
2、为什么在FeSO4溶液中常常加入铁钉或铁粉?
[拓展延伸]
Fe
Fe2+
Fe3+
弱氧化剂
强氧化剂
强氧化剂
Zn
Zn
CuFe
铁三角
第三节 氧化剂和还原剂
第1课时 氧化还原反应
[知识目标]
(1)通过化学反应的分析,从化合价的变化认识并建立氧化还原反应的概念。
(2)通过实验事实和思考,初步理解氧化还原反应的本质是电子转移。
(3)联系生活、生产实际,初步了解氧化还原反应对人类社会的利弊。
[能力目标]
学会用化合价的变化或电子转移来判断氧化还原反应。
[情感目标]
培养学生能用辨证的对立统一的观点分析事物的意识。
[教学重点]
(1)认识并建立氧化还原反应的概念。
(2)理解氧化还原反应的本质是电子转移。
[教学难点]
从化合价的变化,认识并建立氧化还原反应的概念。
写出下列反应化学方程式,标出各元素的化合价。
[交流研讨]
0
0
-2
+2
2Cu + O2 = 2CuO
1、铜与氧气反应。
2、氧化铜与氢气反应。
3、碳酸钙高温分解。
4、铁与硫酸铜溶液反应。
5、NaCl溶液与AgNO3溶液反应。
CuO + H2 = Cu + H2O
+2
-2
0
0
+1
-2
CaCO3 = CaO + CO2
高温
+2
+2
+4
+4
-2
-2
-2
Fe + CuSO4 = FeSO4 + Cu
0
+2
+6
-2
+2
+6
-2
0
NaCl + AgNO3 = AgCl ↓ + NaNO3
+1
-1
+1
-1
+1
+1
+5
-2
+5
-2
[讨论]
分析每一个反应各反应物和生成物所含元素的化合
价的变化情况。探讨元素的化合价变化的实质是什么?
一、氧化还原反应
什么是氧化反应,什么是还原反应?
2Cu + O2 = 2CuO
CuO + H2 = Cu + H2O
[特征]
1、元素的化合价在有些化学反应中有变化。
氧化反应与还原反应的关系
CuO + H2 = Cu + H2O
+2
-2
0
0
+1
-2
⑶、分析氧化还原反应的实质是什么?
⑷、讨论化合价升降与电子转移有何关系?
[活动探究]
①铁与硫酸铜溶液作用
⑴、写出Fe与CuSO4反应的现象和离子方程式。
⑵、讨论电流计的指针为什么会偏转?
电流计的指针发生偏转,说明有电流产生,说明反
应过程中电子发生定向运动。
氧化还原反应的实质是电子转移。
反应物失去电子,所含元素化合价升高,反应过程
称为氧化反应。反应物得到电子,所含元素化合价降低,
反应过程称为还原反应。
铁表面有红色物质产生。Cu + Fe = Cu + Fe
2+
2+
2、氧化还原反应
①概念
②实质
③表现形式
④氧化还原反应与四种基本反应类型有何关系?
D、所有的复分解反应都是非氧化还原反应。
B、有单质生成的分解反应是氧化还原反应。
A、有单质参与的化合反应是氧化还原反应。
C、所有的置换反应都是氧化还原反应。
反应物所含元素化合价升高的反应称为氧化反应;
反应物所含元素化合价降低的反应称为还原反应。
在反应过程中有元素化合价变化的化学反应叫做氧化还原反应
电子的转移
反应物所含元素化合价升降。
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应与四种基本类型的关系:
如图
第2课时 氧化剂和还原剂
知识目标
(1)通过化学反应的分析,能从化合价变化和电子转移认识并建立氧化剂、还原剂的概念。
(2)通过实验事实和思考,初步了解化合价与氧化剂、还原剂关系的一般规律。
(3)了解常见的氧化剂、还原剂。
能力目标
学会用化合价的变化或电子转移来判断氧化剂、还原剂,根据元素的化合价推断物质的性质。
情感目标
培养学生能用辨证的对立统一的观点分析事物的意识。
2.在以上的氧化还原反应中,哪些元素的化合价升高
了?哪些元素的化合价降低了?指出含有这些元素的具
体物质。
[练习]
1.下列化学反应中,哪些属于氧化还原反应?为什么?
Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO
还原剂是所含元素的化合价升高的反应物。
二、氧化剂和还原剂
1、氧化剂是所含元素的化合价降低的反应物。
2、氧化剂得到电子,化合价降低,发生还原反应。
还原剂失去电子,化合价升高,发生氧化反应。
氧化性是氧化剂具有性质,即具有使还原剂发生氧化反应的性质。
还原性是还原剂具有性质,即具有使氧化剂发生还原反应的性质。
[问]从化合价升降和电子转移角度讨论,氧化剂、还原剂
与氧化还原反应有何关系?
下列化学反应中,哪些属于氧化还原反应?
哪些是氧化剂?哪些是还原剂?
Fe+4HNO3 == Fe(NO3)3+2H2O+NO↑
BaCl2 + H2SO4 == BaSO4↓+ 2HCl
2H2O2 == 2H2O +O2↑
Fe2O3+3CO == 2Fe + 3CO2
[问]分析练习中元素的价态与氧化剂还原剂的关系。
[讨论]以KMnO4和KI为例,讨论元素的化合价与物质的
氧化性、还原性有何关系?
3、元素的化合价与物质的氧化性、还原性关系
含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性又有还原性。
在一般情况下,下列物质反应中是氧化剂,还是
还原剂?
O2、Cl2、H2、Na、Cu、SO2、S 、HNO3、浓H2SO4、
Fe 、HCl
2-
3+
[迁移 应用]
4、常见的氧化剂和还原剂
[概括 整合]
氧化还原反应对立统一关系
反应物 反应物性质 实质 元素(判断依据) 反应过程
还原剂 → 还原性 → 失e- → 化合价升高 → 氧化反应
氧化剂 → 氧化性 → 得e- → 化合价降低 → 还原反应
第3课时
探究铁及其化合物
的氧化性和还原性
[教学难点] 实验方案的设计
[知识目标]
(1)通过实验探究,使学生掌握金属铁、氯化亚铁、氯化铁的相互转化关系。
(2)通过金属铁、氯化亚铁、氯化铁的性质实验探究,进一步巩固氧化还原反应的知识。
[能力目标]
通过实验探究,使学生学会用“用已知物质的性质验证未知物性质”的科学方法。
[情感目标]
培养学生与他人合作的意识和品质。
[教学重点]
(1)实验方案的设计
(2)金属铁、氯化亚铁、氯化铁的相互转化关系。
[考察注意力]
课前展示的图片中涉及哪些铁的化合物?
指出这些过程中铁元素发生了什么变化?
写出常见铁的化合物的化学式,并标出铁的化合价。
[涉及知识点]
冶炼钢铁、铁的腐蚀、铁矿石、金属铁、
铁的氧化物、铁的氢氧化物、铁盐。
[有关物质]
FeS2、 Fe2O3、 Fe3O4、 FeSO4 H2O、 Fe(OH)2、
Fe(OH)3、 FeCl3 H2O
3Fe + 2O2 = Fe3O4
点燃
Fe2O3 + 3CO = 2Fe +3CO2
高温
[有关反应]
2Fe + 2H2O + O2 = 2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe(OH)3→Fe2O3 xH2O
4FeS2+11O2 = 8SO2+2Fe2O3
煅烧
Fe + Fe2(SO4)3 = 3FeSO4
在铁单质和铁的化合物中,哪些具有氧化性?
哪些具有还原性?(以金属铁、氯化亚铁、氯化铁为例
进行探究。 )
[问题探究]
3、如何证明物质具有氧化性或还原性?
[思考]
1、金属铁、氯化亚铁、氯化铁三种样品的颜色特征
是什么?
2、FeCl3如何检验?有何现象?
[实验探究]
铁单质和铁的化合物的性质
铁及其化合物的氧化性和还原性
Fe FeCl2 FeCl3
预测与假设:
具有氧化性的物质:
具有还原性的物质:
既具有氧化性又具有还原性:
Fe
FeCl2
FeCl3
提供的药品:
稀硫酸、稀硝酸、氯水
锌、铜
KSCN(硫氰化钾)
0
+2
+3
活动·探究
实验内容 实验现象 实验结论
铁 + 稀硫酸
铁粉溶解,有无色气体生成溶液由无色变成淡绿色
铁单质有还原性
铜 +
FeCl3溶液
溶液由黄色变成淡绿色
FeCl3
有氧化性
锌+
FeCl2溶液
溶液有淡绿色变成无色
FeCl2
有氧化性
FeCl2溶液+氯水+KSCN
溶液变红
FeCl2
有还原性
[交流 探讨]
1、铁有还原性,与稀硫酸、稀硝酸反应生成是Fe 还是
Fe ?
2+
3+
Fe + H2SO4 = FeSO4 + H2↑
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O
2、Fe 有氧化性,与Cu、Zn反应生成是Fe 还是Fe?
2+
3+
2Fe + Fe = 3Fe
2+
3+
2Fe + Zn = 2Fe + Zn
2+
3+
2+
2Fe + Cu = 2Fe + Cu
3+
2+
2+
[概括 整合]
1、为什么工业上利用氯化铁溶液腐蚀铜箔制印刷线
路板?
2、为什么在FeSO4溶液中常常加入铁钉或铁粉?
[拓展延伸]
Fe
Fe2+
Fe3+
弱氧化剂
强氧化剂
强氧化剂
Zn
Zn
CuFe
铁三角
