高中化学苏教版选修三 4.1.2 第一单元 分子构型与物质的性质 分子的性质(共31张PPT)
文档属性
| 名称 | 高中化学苏教版选修三 4.1.2 第一单元 分子构型与物质的性质 分子的性质(共31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 43.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-02 00:00:00 | ||
图片预览









文档简介
(共44张PPT)
D
农安实验中学
王敬微
选修3
物质结构与性质
第二章
分子结构与性质
第三节
分子的性质
第1课时
江西省鹰潭市第一中学
桂耀荣
非极性键:
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
极性键:
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl)
H2O(H-O-H)
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
2、共用电子对不偏向或有偏向是由什么因素引起的呢?
这是由于原子对共用电子对的吸引力不同造成的(元素的电负性不同)。
1、键的极性的判断依据是什么?
共用电子对是否有偏向
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
判断方法:
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
指出下列物质中的共价键类型
1、O2
2
、CH4
3
、CO2
4、
H2O2
5
、Na2O2
6
、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?
分子的极性又是根据什么来判定呢?
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验用品:
气球
盛有水或四氯化碳碘溶液的酸式滴定管
烧杯
实验步骤:
一位同学用手摩擦气球10秒,另一位同学在快摩擦完时迅速打开酸式滴定管,将气球靠近液体流,观察。
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验现象:
水流受气球吸引,发生偏转。
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验现象:
四氯化碳液体流不受气球吸引,不发生偏转。
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验结论:
说明H2O分子与CCl4分子不同,H2O中正负电荷中心不重合,而CCl4中正负电荷中心重合。
为什么水流受气球吸引,而四氯化碳不受气球吸引呢?
江西省鹰潭市第一中学
桂耀荣
一、键的极性和分子的极性
非极性分子:
电荷分布均匀对称的分子
(正电中心与负电中心重合)
极性分子:
电荷分布不均匀不对称的分子
(正电中心与负电中心不重合)
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
Cl2分子中,共用电子对不偏向,Cl原子都不显电性,为非极性分子
∴以非极性键结合的分子均为非极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子
δ+
δ-
∴以极性键结合的双原子分子为极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
含有极性键的分子一定
是极性分子吗?
分析方法:物理模型法
(从力的角度分析)
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),
F合≠0,为极性分子(极性不抵消)
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消(
F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子
180?
F1
F2
F合=0
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
104?30'
F1
F2
F合≠0
O-H键是极性键,共用电子对偏O原子,由于分子是V型,两个O-H键的极性不能抵消(
F合≠0),∴整个分子电荷分布不均匀,是极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
NH3:
107?18'
三角锥型,
不对称,键的极性不能抵消,是极性分子
F合
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
BF3:
120?
F1
F2
F3
F’
平面三角形,对称,键的极性互相抵消,是非极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
109?28'
正四面体型
,对称结构,C-H键的极性互相抵消(
F合=0)
,是非极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
2、ABn型分子极性的判断方法
①物理模型法:从受力的角度分析
②根据含键的类型和分子的空间构型判断:当ABn型分子的空间构型是空间对称结构时,由于分子的正负电荷中心重合,故为非极性分子,如:CO2、BF3、CH4,当分子的空间构型不是空间对称结构时,一般为极性分子,如:H2O、NH3。
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
③化合价法:中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,其分子为极性分子。
键的极性和分子的极性
化学式
BF3
CO2
PCl5
SO3
H2O
NH3
SO2
中心原子化合价绝对值
3
4
5
6
2
3
4
中心原子价电子数
3
4
5
6
6
5
6
分子极性
非极性
非极性
非极性
非极性
极性
极性
极性
江西省鹰潭市第一中学
桂耀荣
3、常见分子的构型及分子的极性
双原子分子
H2、Cl2
非极性
无
直线型
非极性
HCl
极性
无
直线型
极性
H2O
极性
104?30’
V型
极性
CO2
极性
180?
直线型
非极性
三原子分子
四原子分子
NH3
极性
107?18'
三角锥型
极性
BF3
极性
120?
平面三角形
非极性
CH4
极性
109?28
'
正四面体型
非极性
五原子分子
键的极性和分子的极性
常见分子
键的极性
键角
分子构型
分子类型
江西省鹰潭市第一中学
桂耀荣
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、IBr
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正四面体:CH4、CCl4、CF4
空间对称
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
二.溶解性——相似相溶规律:
相似相溶规律:
非极性溶质一般能溶于非极性溶剂
极性溶质一般能溶于极性溶剂
极性越相似的物质,互溶性越好
江西省鹰潭市第一中学
桂耀荣
新闻真假辨析:
2014年8月的一天,杭州一公园内,一位60多岁的阿婆带着他的小孙子在公园休息。小孙子手中拿着一个气球坐在阿婆腿上,而阿婆正在给孩子剥橙子吃。突然,孩子手中的气球发生爆炸。
橙子会使气球爆炸吗?
江西省鹰潭市第一中学
桂耀荣
橙子使气球爆炸的原因:
【启示】玩气球时要远离柑橘类水果。
资料卡片:
柠檬皮、橙子皮分泌出一种易挥发的物质,是弱极性的有机物质,气球中的橡胶质是弱极性的有机高分子。
请同学们根据资料卡片的提示,解释橙子使气球爆炸的原因。
江西省鹰潭市第一中学
桂耀荣
自我提高
2.下列各组分子中,都属于含极性键的非极性分子是(
)
A、CO2
H2S
B、C2H4
CH4
C、Cl2
C2H4
D
、NH3
HCl
C
B
基础练习
1.下列叙述正确的是
A.含有极性键的分子是极性分子
B.分子中一定含有共价键
C.只含有非极性键的分子一定是非极性分子
D.非极性分子中一定含有非极性键
江西省鹰潭市第一中学
桂耀荣
自我提高
4.常温条件下三氯化氮(NCl3)是一种淡黄色液体,以下关于NCl3的说法中正确的是
A.分子中N-Cl键是非极性键
B.分子中不存在孤对电子
C.三氯化氮分子结构呈三角锥形
D.
三氯化氮分子是非极性分子
学·科网
D
C
巩固练习
3.
下列物质中,既含有极性共价键,又含有非极性共价键的是
A、CCl4
B、CO2
C、NH4Cl
D、C2H4
江西省鹰潭市第一中学
桂耀荣
自学:
科学视野—表面活性剂和细胞膜
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
1、什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?
2、什么是单分子膜?双分子膜?举例说明。
3、为什么双分子膜以头向外而尾向内的方式排列?
思考:
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
Thanks
谢谢大家!
江西省鹰潭市第一中学
桂耀荣
D
农安实验中学
王敬微
选修3
物质结构与性质
第二章
分子结构与性质
第三节
分子的性质
第1课时
江西省鹰潭市第一中学
桂耀荣
非极性键:
共用电子对无偏向(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
极性键:
共用电子对有偏向(电荷分布不均匀)
如:HCl(H-Cl)
H2O(H-O-H)
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
2、共用电子对不偏向或有偏向是由什么因素引起的呢?
这是由于原子对共用电子对的吸引力不同造成的(元素的电负性不同)。
1、键的极性的判断依据是什么?
共用电子对是否有偏向
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
判断方法:
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
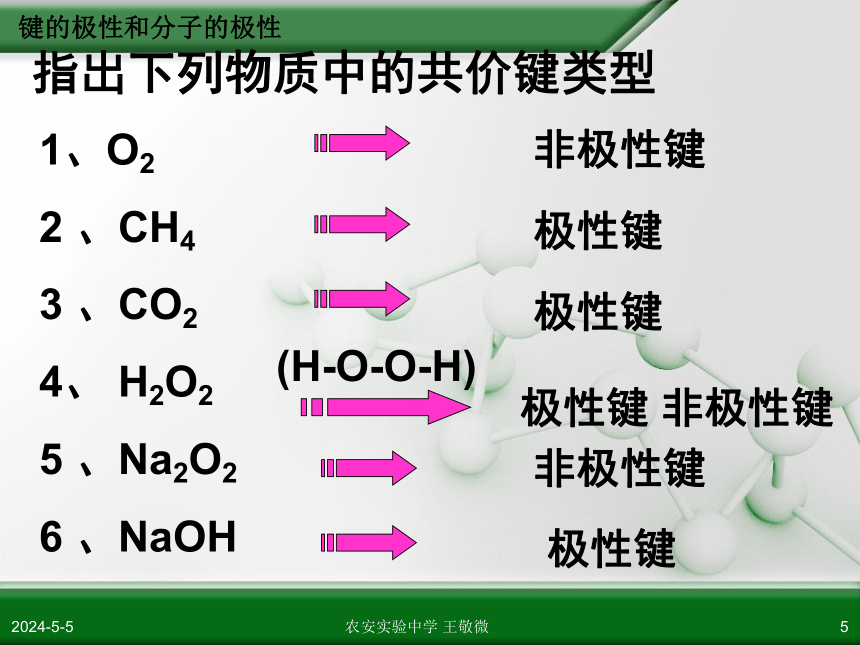
指出下列物质中的共价键类型
1、O2
2
、CH4
3
、CO2
4、
H2O2
5
、Na2O2
6
、NaOH
非极性键
极性键
极性键
(H-O-O-H)
极性键
非极性键
非极性键
极性键
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?
分子的极性又是根据什么来判定呢?
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验用品:
气球
盛有水或四氯化碳碘溶液的酸式滴定管
烧杯
实验步骤:
一位同学用手摩擦气球10秒,另一位同学在快摩擦完时迅速打开酸式滴定管,将气球靠近液体流,观察。
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验现象:
水流受气球吸引,发生偏转。
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验现象:
四氯化碳液体流不受气球吸引,不发生偏转。
江西省鹰潭市第一中学
桂耀荣
课堂实验:探究水和四氯化碳分子的极性
实验结论:
说明H2O分子与CCl4分子不同,H2O中正负电荷中心不重合,而CCl4中正负电荷中心重合。
为什么水流受气球吸引,而四氯化碳不受气球吸引呢?
江西省鹰潭市第一中学
桂耀荣
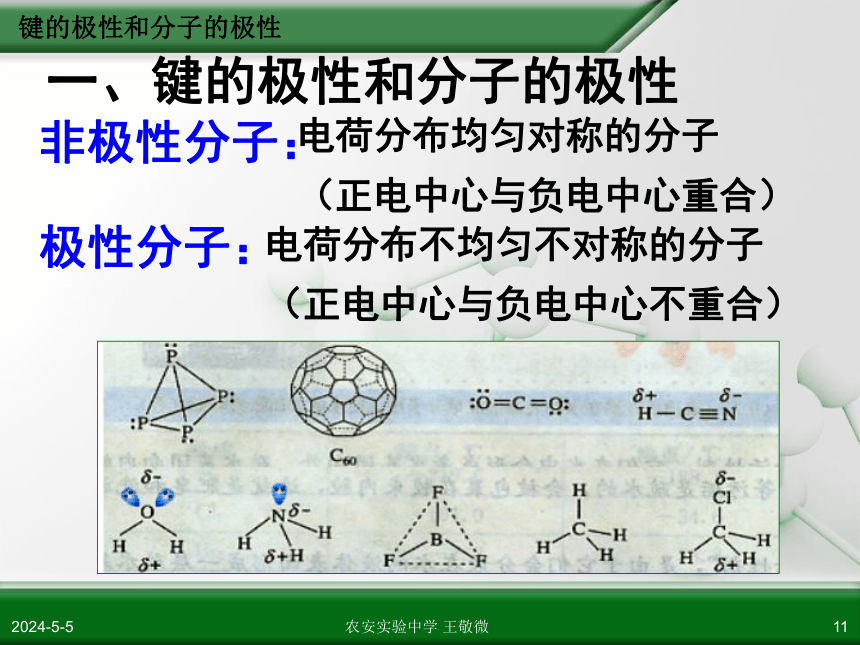
一、键的极性和分子的极性
非极性分子:
电荷分布均匀对称的分子
(正电中心与负电中心重合)
极性分子:
电荷分布不均匀不对称的分子
(正电中心与负电中心不重合)
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
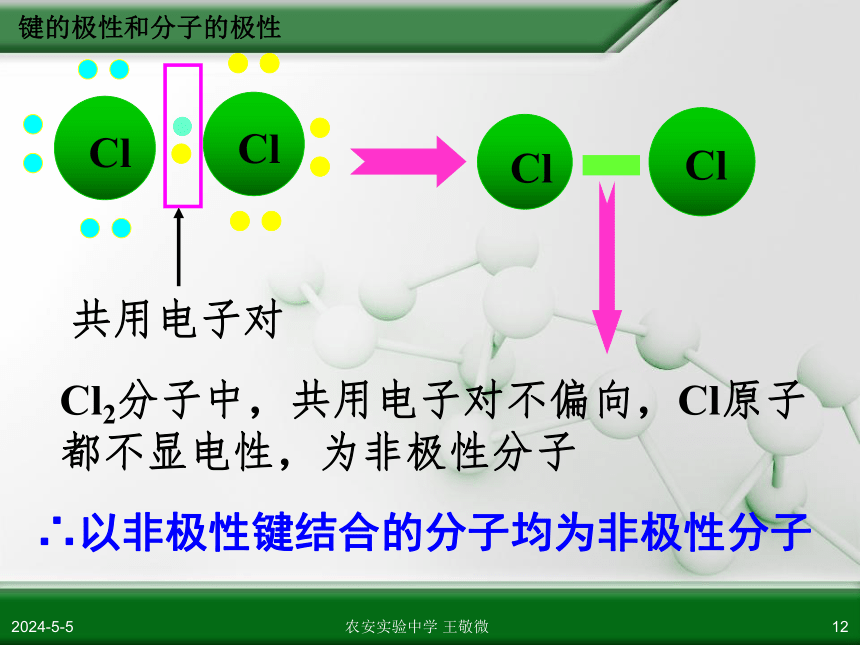
Cl2分子中,共用电子对不偏向,Cl原子都不显电性,为非极性分子
∴以非极性键结合的分子均为非极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子
δ+
δ-
∴以极性键结合的双原子分子为极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
含有极性键的分子一定
是极性分子吗?
分析方法:物理模型法
(从力的角度分析)
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),
F合≠0,为极性分子(极性不抵消)
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消(
F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子
180?
F1
F2
F合=0
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
104?30'
F1
F2
F合≠0
O-H键是极性键,共用电子对偏O原子,由于分子是V型,两个O-H键的极性不能抵消(
F合≠0),∴整个分子电荷分布不均匀,是极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
NH3:
107?18'
三角锥型,
不对称,键的极性不能抵消,是极性分子
F合
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
BF3:
120?
F1
F2
F3
F’
平面三角形,对称,键的极性互相抵消,是非极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
109?28'
正四面体型
,对称结构,C-H键的极性互相抵消(
F合=0)
,是非极性分子
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
2、ABn型分子极性的判断方法
①物理模型法:从受力的角度分析
②根据含键的类型和分子的空间构型判断:当ABn型分子的空间构型是空间对称结构时,由于分子的正负电荷中心重合,故为非极性分子,如:CO2、BF3、CH4,当分子的空间构型不是空间对称结构时,一般为极性分子,如:H2O、NH3。
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
③化合价法:中心原子的化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,其分子为极性分子。
键的极性和分子的极性
化学式
BF3
CO2
PCl5
SO3
H2O
NH3
SO2
中心原子化合价绝对值
3
4
5
6
2
3
4
中心原子价电子数
3
4
5
6
6
5
6
分子极性
非极性
非极性
非极性
非极性
极性
极性
极性
江西省鹰潭市第一中学
桂耀荣
3、常见分子的构型及分子的极性
双原子分子
H2、Cl2
非极性
无
直线型
非极性
HCl
极性
无
直线型
极性
H2O
极性
104?30’
V型
极性
CO2
极性
180?
直线型
非极性
三原子分子
四原子分子
NH3
极性
107?18'
三角锥型
极性
BF3
极性
120?
平面三角形
非极性
CH4
极性
109?28
'
正四面体型
非极性
五原子分子
键的极性和分子的极性
常见分子
键的极性
键角
分子构型
分子类型
江西省鹰潭市第一中学
桂耀荣
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、IBr
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正四面体:CH4、CCl4、CF4
空间对称
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
二.溶解性——相似相溶规律:
相似相溶规律:
非极性溶质一般能溶于非极性溶剂
极性溶质一般能溶于极性溶剂
极性越相似的物质,互溶性越好
江西省鹰潭市第一中学
桂耀荣
新闻真假辨析:
2014年8月的一天,杭州一公园内,一位60多岁的阿婆带着他的小孙子在公园休息。小孙子手中拿着一个气球坐在阿婆腿上,而阿婆正在给孩子剥橙子吃。突然,孩子手中的气球发生爆炸。
橙子会使气球爆炸吗?
江西省鹰潭市第一中学
桂耀荣
橙子使气球爆炸的原因:
【启示】玩气球时要远离柑橘类水果。
资料卡片:
柠檬皮、橙子皮分泌出一种易挥发的物质,是弱极性的有机物质,气球中的橡胶质是弱极性的有机高分子。
请同学们根据资料卡片的提示,解释橙子使气球爆炸的原因。
江西省鹰潭市第一中学
桂耀荣
自我提高
2.下列各组分子中,都属于含极性键的非极性分子是(
)
A、CO2
H2S
B、C2H4
CH4
C、Cl2
C2H4
D
、NH3
HCl
C
B
基础练习
1.下列叙述正确的是
A.含有极性键的分子是极性分子
B.分子中一定含有共价键
C.只含有非极性键的分子一定是非极性分子
D.非极性分子中一定含有非极性键
江西省鹰潭市第一中学
桂耀荣
自我提高
4.常温条件下三氯化氮(NCl3)是一种淡黄色液体,以下关于NCl3的说法中正确的是
A.分子中N-Cl键是非极性键
B.分子中不存在孤对电子
C.三氯化氮分子结构呈三角锥形
D.
三氯化氮分子是非极性分子
学·科网
D
C
巩固练习
3.
下列物质中,既含有极性共价键,又含有非极性共价键的是
A、CCl4
B、CO2
C、NH4Cl
D、C2H4
江西省鹰潭市第一中学
桂耀荣
自学:
科学视野—表面活性剂和细胞膜
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
1、什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?
2、什么是单分子膜?双分子膜?举例说明。
3、为什么双分子膜以头向外而尾向内的方式排列?
思考:
键的极性和分子的极性
江西省鹰潭市第一中学
桂耀荣
Thanks
谢谢大家!
江西省鹰潭市第一中学
桂耀荣
