5.1 生活中的酸和碱--沪教版(上海)九年级第二学期化学课件(共26张PPT)
文档属性
| 名称 | 5.1 生活中的酸和碱--沪教版(上海)九年级第二学期化学课件(共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 687.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-02 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
5.1
生活中的酸和碱
生活中的酸和碱
中和反应
应用
实质
酸碱度—pH(定量)
碱
化学性质
与指示剂作用
氢氧化钠
常见的碱
氢氧化钙
与酸反应
与某些非金属氧化物反应
与某些盐反应
常见的酸
酸
盐酸
硫酸
与指示剂作用
与活泼金属反应
与某些金属氧化物反应
化学性质
与某些盐反应
与碱反应
硝酸、醋酸
定义:溶液的酸碱度常用pH来表示,pH的范围通常为________
溶液pH测定方法:用________
蘸取少量待测液,滴在__________
上,将试纸
显示的颜色与标准比色
卡对照,读出对应的pH
pH与溶液
酸碱性的
关系
pH<7时,溶液显______
性
pH=7时,溶液显⑤______
性
pH>7时,溶液显⑥______
性
应用
测定土壤的酸碱性,提供土壤改良依据
测定雨水的
pH(pH<5.6的降雨称为酸雨),了解空气污染情况
医院通过测定人体的血液、尿液等的pH,了解人体的健康状况
化工生产中,许多反应都必须在pH
0~14
玻璃棒
pH试纸
酸
中
碱
增强
增强
考点梳理:酸碱度——pH定量
常见的酸
盐酸:无色、有刺激性气味的液体;浓盐酸易挥发,形成白雾,因此要密封保存
浓硫酸
色态:无色、无味、黏稠、油状液体
吸水性:常用来作________
腐蚀性:如果不慎将浓硫酸沾到皮肤上,应立即
______________________________________________
稀释时注意事项:浓硫酸密度比水大且溶于水时放出大量的热,故稀释时应将__________
沿
烧杯壁缓慢倒入_____中,并用玻璃棒不断搅拌
用途
盐酸(HCl):重要化工产品?用于金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化
硫酸(H2SO4):重要化工原料?用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和
金属除锈等浓硫酸有吸水性,
在实验室中常用它作干燥剂
其他酸:硝酸(HNO3)、醋酸(CH3COOH)等
干燥剂
用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液
浓硫酸
水
考点梳理:酸
化学性质
(酸5条)
与指示剂作用:能使紫色石蕊溶液变_______
色,不能使无色酚酞溶液变色
与活泼金属反应
规律:酸
+活泼金属→___________?
举例
盐酸和镁:__________________________________
(写化学方程式,下同)
硫酸和锌:__________________________________
盐酸和铝:__________________________________
?
盐酸和铁:__________________________________?
现象____________
____________
红
盐+氢气
Mg+2HCl
===
MgCl2+H2↑
Zn+H2SO4===
ZnSO4+H2↑
2Al+6HCl
===
2AlCl3+3H2↑
剧烈反应,有大量气泡产生
Fe+2HCl
===
FeCl2+H2↑
化学性质
(酸5条)
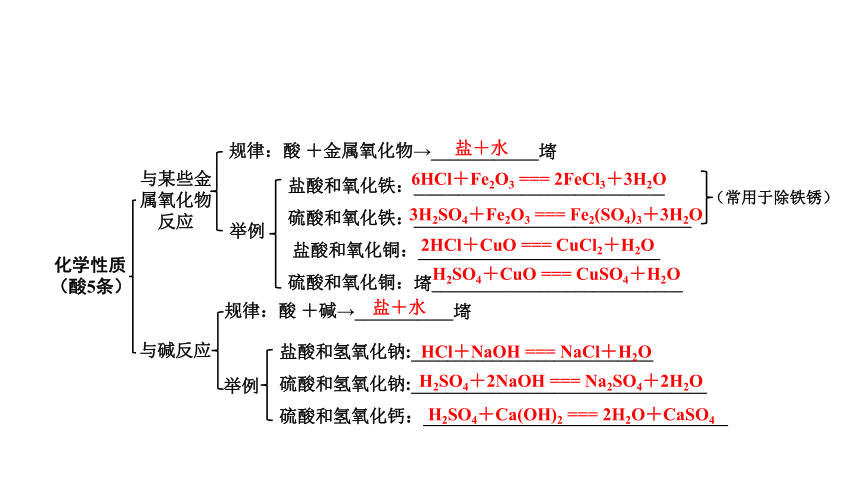
与碱反应
规律:酸
+碱→___________?
举例
盐酸和氢氧化钠:___________________________
硫酸和氢氧化钠:_________________________________
硫酸和氢氧化钙:__________________________________
盐+水
HCl+NaOH
===
NaCl+H2O
H2SO4+2NaOH
===
Na2SO4+2H2O
H2SO4+Ca(OH)2
===
2H2O+CaSO4
与某些金属氧化物反应
规律:酸
+金属氧化物→____________?
举例
盐酸和氧化铁:____________________________
硫酸和氧化铁:_______________________________
盐酸和氧化铜:___________________________
硫酸和氧化铜:?____________________________
(常用于除铁锈)
盐+水
6HCl+Fe2O3
===
2FeCl3+3H2O
3H2SO4+Fe2O3
===
Fe2(SO4)3+3H2O
2HCl+CuO
===
CuCl2+H2O
H2SO4+CuO
===
CuSO4+H2O
化学性质
(酸5条)
与某些盐反应
通式:酸
+盐→_____________?
举例
盐酸和碳酸钙
硫酸和碳酸钠
稀盐酸和碳酸氢钠
化学方程式___________________________________
现象______________
化学方程式______________________________________
现象______________
化学方程式____________________________________
现象_____________
【总结】铁与酸、盐反应生成的是
+2
新酸+新盐
CaCO3+2HCl
===
CaCl2+H2O+CO2↑
有气泡产生
Na2CO3+H2SO4
===
Na2SO4+H2O+CO2↑
有气泡产生
有气泡产生
NaHCO3+HCl
===
NaCl+H2O+CO2↑
酸具有共
性的原因
是_______
___________________
具有个性的
原因_____
____________________
在水溶液中都能解离出H+
构成酸的阴离子不同
与指示剂作用
与活泼金属反应
与某些金属氧化物反应
与碱反应
常见的碱
氢氧化钠
氢氧化钙
其他碱:氢氧化钾(KOH)?氨水(NH3·H2O)
化学式_______,俗称________
、_______、_______
物理性质:白色固体,_____
溶于水,并放出大量的热
用途:用于肥皂、造纸、纺织等工业,
作气体干燥剂
化学式_________
,俗称_________
、__________
物理性质:白色粉末状固体,微溶于水
用途:改良酸性土壤,配制农药波尔多液,作建筑材料等
制取:石灰石高温煅烧可得到生石灰,化学方程式_________________________;
生石灰与水反应得到熟石灰,化学方程式_______________________
NaOH
苛性钠
火碱
烧碱
易
Ca(OH)2
消石灰
熟石灰
CaO+H2O
===
Ca(OH)2
考点梳理:碱
与指示剂作用:能使紫色石蕊溶液变_______色,无色酚酞溶液变____色
与某些非
金属氧化物反应
规律:碱
+非金属氧化物→_________?
举例
氢氧化钠和二氧化碳:化学方程式______________________________
(吸收二氧化碳)
氢氧化钙和二氧化碳
(检验二氧化碳)
化学方程式_______________________________
现象_________________
化学性质
(碱4条)
蓝
红
盐+水
2NaOH+CO2===
Na2CO3+H2O
Ca(OH)2+CO2
===
CaCO3↓+H2O
有白色沉淀生成
化学性质
(碱4条)
与酸反应
规律:碱
+酸→__________?
举例
氢氧化铁和稀盐酸
氢氧化铜和稀硫酸
氢氧化铝和稀盐酸
化学方程式_______________________________
现象_____________________________________
化学方程式_________________________________
现象____________________________________
化学方程式________________________________
现象_________________
盐+水
Fe(OH)3+3HCl
===
FeCl3+3H2O
红褐色固体消失,溶液由无色变为黄色
Cu(OH)2+H2SO4
===
CuSO4+2H2O
蓝色固体消失,溶液由无色变为蓝色
Al(OH)3+3HCl
===
AlCl3+3H2O
白色固体消失
化学性质
(碱4条)
与某些盐反应
通式:碱
+盐→新碱
+新盐
举例
氢氧化钠溶液和硫酸铜溶液
氢氧化钙溶液与碳酸钠溶液
化学方程式______________________________________
现象_________________
化学方程式_____________________________________
现象_________________
【特别提醒】盐与碱反应生成的难溶于水的碱有:Mg(OH)2(白色)、Cu(OH)2
(蓝色)
等
2NaOH+CuSO4
===
Na2SO4+Cu(OH)2↓
有蓝色沉淀生成
Ca(OH)2+Na2CO3
===
CaCO3↓+2NaOH
有白色沉淀生成
碱具有通性的原因是________________________
具有个性的原因是__________________
构成碱的阳离子不同
与指示剂作用
与某些非金属氧化物反应
与酸反应
氢氧化钠、氢氧化钙变质的探究(详见微专题6)
在水溶液中都能解离出OH-
【总结】物质敞口放置后的质量变化:
物质
特点
质量变化
浓氨水、酒精
具有挥发性
溶质挥发,溶质质量分数__________
氢氧化钠、氢氧化钙固体
与空气中的二氧化碳反应
固体质量_______
干燥剂(氧化钙、浓硫酸、氢氧化钠固体)
易吸水
吸收水分,质量_______
减小
增大
增大
表达式:______
+_______→盐
+______
实质:酸中的_____________
与碱中的___________________
结合生成_______________
,即H+
+OH-
=
H2O
中和反应(详见实验突破栏目)
应用
农业:改良土壤的酸碱性,如:用熟石灰改良酸性土壤
工业:处理工厂废水,如:用熟石灰处理酸性废水;印染厂的废水呈碱性,加入稀硫酸进行中和
医药:如用含氢氧化铝的药物治疗胃酸过多
生活实际:如在蚊虫叮咬处,可以涂一些含碱性物质的溶液(如肥皂水)以减轻痛痒
酸
碱
水
H+(或氢离子)
OH-(或氢氧根离子)
H2O(或水分子)
考点梳理:中和反应
下列关于酸和碱的说法正确的是________。①打开浓盐酸、浓硫酸的试剂瓶,瓶口都有白雾产生②浓硫酸露置于空气中质量增大,溶质质量分数减小③与酸反应产生气体的固体一定是活泼金属④碱能使酚酞溶液变红,所以能使酚酞溶液变红的一定是碱⑤中和反应生成盐和水,所以生成盐和水的反应一定是中和反应⑥氢氧化钠固体吸水易潮解,可用来干燥CO2气体
②
典型例题
1.
盐酸、硫酸的化学性质(“酸五条”)
(1)写出下列化学式甲______ 乙_________ 丙______(2)写出图中涉及的化学方程式
Fe2O3
Ca(OH)2
BaCl2
①_________________________________________
_________________________________________
②_________________________________________
_________________________________________
③_________________________________________
_________________________________________
④_________________________________________
_________________________________________
_________________________________________
_________________________________________
⑤_________________________________________
⑥_________________________________________
Zn+2HCl
===
ZnCl2+H2↑
Zn+H2SO4
===
ZnSO4+H2↑
2HCl+Ca(OH)2
===
CaCl2+2H2O
H2SO4+Ca(OH)2
===
CaSO4+2H2O
H2SO4+Na2CO3
===
Na2SO4+H2O+CO2↑
2HCl+Na2CO3
===
2NaCl+H2O+CO2↑
CuO+2HCl
===
CuCl2+H2O
CuO+H2SO4
===
CuSO4+H2O
H2SO4+BaCl2
===
BaSO4↓+2HCl
HCl+AgNO3
===
AgCl↓+HNO3
Fe2O3+3H2SO4
===
Fe2(SO4)3+3H2O
Fe2O3+6HCl
===2
FeCl3+3H2O
2.
氢氧化钠、氢氧化钙的化学性质(“碱四条”)
(1)写出下列化学式甲______ 乙______ 丙__________(2)写出图中涉及的化学方程式
CuSO4
CO2
Na2CO3
①_________________________________________
_________________________________________
②_________________________________________
_________________________________________
_________________________________________
_________________________________________
③_________________________________________
_________________________________________
④_________________________________________
H2SO4+2NaOH
===
Na2SO4+2H2O
H2SO4+Ca(OH)2
===
CaSO4+2H2O
2NaOH+MgCl2
===
Mg(OH)2↓+2NaCl
Ca(OH)2+MgCl2
===
Mg(OH)2↓+CaCl2
2NaOH+CuSO4
===
Cu(OH)2↓+Na2SO4
CuSO4+Ca(OH)2
===
CaSO4+Cu(OH)2↓
CO2+2NaOH
===
Na2CO3+H2O
CO2+Ca(OH)2
===
CaCO3↓+H2O
Ca(OH)2+Na2CO3
===
CaCO3↓+2NaOH
1.实验原理:中和反应过程中往往没有明显现象,无法确定是否发生反应,因此需借助酸碱指示剂来判断反应的发生。2.实验装置
实验:中和反应
3.实验操作及现象
在烧杯中加入约5
mL氢氧化钠溶液,再滴入几滴酚酞溶液,溶液变为______色,然后用胶头滴管逐滴加入稀盐酸,并不断搅拌至____________________为止。
4.实验结论
(1)氢氧化钠溶液能与稀盐酸发生中和反应,反应的化学方程式为____________________________。(2)微观实质______________________。
红
溶液由红色变为无色
NaOH+HCl
===
NaCl+H2O
H++OH-
===
H2O
5.指示剂选择:一般不用紫色石蕊溶液代替无色酚酞溶液,其原因是______________________________________________________________________________________。6.药品滴加顺序:能否向稀盐酸中滴加无色酚酞溶液后再滴加氢氧化钠溶液的方法验证恰好完全反应,并说明理由:_____________________________________________________________________________________________________________________________________。7.异常现象:实验时将稀盐酸滴入氢氧化钠溶液中观察到有气泡冒出,可能原因是_____________________。
紫色石蕊溶液在碱性溶液中呈蓝色,在中性溶液中呈紫色,而蓝色和紫色之间没有明显的界限
不能,酚酞溶液遇酸性和中性溶液均不变色,当滴加氢氧化钠溶液至溶液由无色变为红色时,说明此时溶液显碱性,故无法验证二者恰好完全反应
氢氧化钠溶液已变质
8.证明酸碱是否发生反应除了借助指示剂,是否还有其他方法?(以氢氧化钠溶液和稀盐酸反应为例)(1)借助pH变化图
①图1表示将________滴加到_______________中。
分析:图1中,A点pH____(填“>”、“<”或“=”,下同)7,可判断出反应前溶液显____(填“酸”、“碱”或“中”)性;B点pH____7,表示_________________________________,此时溶液中的溶质是______;C点pH___7,此时溶液中的溶质是__________。②同理,图2表示将_______________滴加到________中。
稀盐酸
氢氧化钠溶液
>
碱
=
稀盐酸和氢氧化钠溶液恰好完全反应
NaCl
<
NaCl、HCl
氢氧化钠溶液
稀盐酸
(2)借助温度变化图
①当实验进行到_____s时,酸与碱恰好完全反应;②从能量变化的角度看,该反应属于______反应(填“放热”或“吸热”)。
44
放热
例 为证明酸与碱发生了反应,实验小组同学进行了如下实验,请据图回答:
图1
(1)甲中滴加无色酚酞溶液的作用是___________________________________。(2)用滴管滴入稀硫酸,能证明乙中发生反应的现象是_____________,发生反应的化学方程式为___________________________________。
借助指示剂颜色变化判断反应是否发生
红色逐渐褪去
2NaOH+H2SO4
===
Na2SO4+2H2O
(3)为确定乙中反应后溶液的溶质成分,同学们进行如图丙实验,其操作中存在的问题是_____________________________;若用正确操作测得该溶液的pH=5,则反应后溶液中溶质的化学式为________________。
(4)若取适量稀硫酸于烧杯中,测其温度后,加入适量的氢氧化钠固体,充分反应后再测温度,发现温度明显升高。于是得出结论,该反应放热。你认为结论是否正确?________;理由是__________________________。
pH试纸不能直接伸入待测液中
H2SO4、Na2SO4
不正确
氢氧化钠溶于水也会放热
(5)实验小组用传感器探究NaOH溶液与稀硫酸反应过程中温度和pH的变化。测定结果如图所示,下列说法不正确的是___。
图2
A.
反应过程中有热量放出B.
30
s时,溶液中溶质为H2SO4和Na2SO4C.
该实验是将稀硫酸滴入稀NaOH溶液D.
从20
s到40
s,溶液的温度升高、pH增大
C
5.1
生活中的酸和碱
生活中的酸和碱
中和反应
应用
实质
酸碱度—pH(定量)
碱
化学性质
与指示剂作用
氢氧化钠
常见的碱
氢氧化钙
与酸反应
与某些非金属氧化物反应
与某些盐反应
常见的酸
酸
盐酸
硫酸
与指示剂作用
与活泼金属反应
与某些金属氧化物反应
化学性质
与某些盐反应
与碱反应
硝酸、醋酸
定义:溶液的酸碱度常用pH来表示,pH的范围通常为________
溶液pH测定方法:用________
蘸取少量待测液,滴在__________
上,将试纸
显示的颜色与标准比色
卡对照,读出对应的pH
pH与溶液
酸碱性的
关系
pH<7时,溶液显______
性
pH=7时,溶液显⑤______
性
pH>7时,溶液显⑥______
性
应用
测定土壤的酸碱性,提供土壤改良依据
测定雨水的
pH(pH<5.6的降雨称为酸雨),了解空气污染情况
医院通过测定人体的血液、尿液等的pH,了解人体的健康状况
化工生产中,许多反应都必须在pH
0~14
玻璃棒
pH试纸
酸
中
碱
增强
增强
考点梳理:酸碱度——pH定量
常见的酸
盐酸:无色、有刺激性气味的液体;浓盐酸易挥发,形成白雾,因此要密封保存
浓硫酸
色态:无色、无味、黏稠、油状液体
吸水性:常用来作________
腐蚀性:如果不慎将浓硫酸沾到皮肤上,应立即
______________________________________________
稀释时注意事项:浓硫酸密度比水大且溶于水时放出大量的热,故稀释时应将__________
沿
烧杯壁缓慢倒入_____中,并用玻璃棒不断搅拌
用途
盐酸(HCl):重要化工产品?用于金属表面除锈、制造药物等;人体胃液中含有盐酸,可帮助消化
硫酸(H2SO4):重要化工原料?用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和
金属除锈等浓硫酸有吸水性,
在实验室中常用它作干燥剂
其他酸:硝酸(HNO3)、醋酸(CH3COOH)等
干燥剂
用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液
浓硫酸
水
考点梳理:酸
化学性质
(酸5条)
与指示剂作用:能使紫色石蕊溶液变_______
色,不能使无色酚酞溶液变色
与活泼金属反应
规律:酸
+活泼金属→___________?
举例
盐酸和镁:__________________________________
(写化学方程式,下同)
硫酸和锌:__________________________________
盐酸和铝:__________________________________
?
盐酸和铁:__________________________________?
现象____________
____________
红
盐+氢气
Mg+2HCl
===
MgCl2+H2↑
Zn+H2SO4===
ZnSO4+H2↑
2Al+6HCl
===
2AlCl3+3H2↑
剧烈反应,有大量气泡产生
Fe+2HCl
===
FeCl2+H2↑
化学性质
(酸5条)
与碱反应
规律:酸
+碱→___________?
举例
盐酸和氢氧化钠:___________________________
硫酸和氢氧化钠:_________________________________
硫酸和氢氧化钙:__________________________________
盐+水
HCl+NaOH
===
NaCl+H2O
H2SO4+2NaOH
===
Na2SO4+2H2O
H2SO4+Ca(OH)2
===
2H2O+CaSO4
与某些金属氧化物反应
规律:酸
+金属氧化物→____________?
举例
盐酸和氧化铁:____________________________
硫酸和氧化铁:_______________________________
盐酸和氧化铜:___________________________
硫酸和氧化铜:?____________________________
(常用于除铁锈)
盐+水
6HCl+Fe2O3
===
2FeCl3+3H2O
3H2SO4+Fe2O3
===
Fe2(SO4)3+3H2O
2HCl+CuO
===
CuCl2+H2O
H2SO4+CuO
===
CuSO4+H2O
化学性质
(酸5条)
与某些盐反应
通式:酸
+盐→_____________?
举例
盐酸和碳酸钙
硫酸和碳酸钠
稀盐酸和碳酸氢钠
化学方程式___________________________________
现象______________
化学方程式______________________________________
现象______________
化学方程式____________________________________
现象_____________
【总结】铁与酸、盐反应生成的是
+2
新酸+新盐
CaCO3+2HCl
===
CaCl2+H2O+CO2↑
有气泡产生
Na2CO3+H2SO4
===
Na2SO4+H2O+CO2↑
有气泡产生
有气泡产生
NaHCO3+HCl
===
NaCl+H2O+CO2↑
酸具有共
性的原因
是_______
___________________
具有个性的
原因_____
____________________
在水溶液中都能解离出H+
构成酸的阴离子不同
与指示剂作用
与活泼金属反应
与某些金属氧化物反应
与碱反应
常见的碱
氢氧化钠
氢氧化钙
其他碱:氢氧化钾(KOH)?氨水(NH3·H2O)
化学式_______,俗称________
、_______、_______
物理性质:白色固体,_____
溶于水,并放出大量的热
用途:用于肥皂、造纸、纺织等工业,
作气体干燥剂
化学式_________
,俗称_________
、__________
物理性质:白色粉末状固体,微溶于水
用途:改良酸性土壤,配制农药波尔多液,作建筑材料等
制取:石灰石高温煅烧可得到生石灰,化学方程式_________________________;
生石灰与水反应得到熟石灰,化学方程式_______________________
NaOH
苛性钠
火碱
烧碱
易
Ca(OH)2
消石灰
熟石灰
CaO+H2O
===
Ca(OH)2
考点梳理:碱
与指示剂作用:能使紫色石蕊溶液变_______色,无色酚酞溶液变____色
与某些非
金属氧化物反应
规律:碱
+非金属氧化物→_________?
举例
氢氧化钠和二氧化碳:化学方程式______________________________
(吸收二氧化碳)
氢氧化钙和二氧化碳
(检验二氧化碳)
化学方程式_______________________________
现象_________________
化学性质
(碱4条)
蓝
红
盐+水
2NaOH+CO2===
Na2CO3+H2O
Ca(OH)2+CO2
===
CaCO3↓+H2O
有白色沉淀生成
化学性质
(碱4条)
与酸反应
规律:碱
+酸→__________?
举例
氢氧化铁和稀盐酸
氢氧化铜和稀硫酸
氢氧化铝和稀盐酸
化学方程式_______________________________
现象_____________________________________
化学方程式_________________________________
现象____________________________________
化学方程式________________________________
现象_________________
盐+水
Fe(OH)3+3HCl
===
FeCl3+3H2O
红褐色固体消失,溶液由无色变为黄色
Cu(OH)2+H2SO4
===
CuSO4+2H2O
蓝色固体消失,溶液由无色变为蓝色
Al(OH)3+3HCl
===
AlCl3+3H2O
白色固体消失
化学性质
(碱4条)
与某些盐反应
通式:碱
+盐→新碱
+新盐
举例
氢氧化钠溶液和硫酸铜溶液
氢氧化钙溶液与碳酸钠溶液
化学方程式______________________________________
现象_________________
化学方程式_____________________________________
现象_________________
【特别提醒】盐与碱反应生成的难溶于水的碱有:Mg(OH)2(白色)、Cu(OH)2
(蓝色)
等
2NaOH+CuSO4
===
Na2SO4+Cu(OH)2↓
有蓝色沉淀生成
Ca(OH)2+Na2CO3
===
CaCO3↓+2NaOH
有白色沉淀生成
碱具有通性的原因是________________________
具有个性的原因是__________________
构成碱的阳离子不同
与指示剂作用
与某些非金属氧化物反应
与酸反应
氢氧化钠、氢氧化钙变质的探究(详见微专题6)
在水溶液中都能解离出OH-
【总结】物质敞口放置后的质量变化:
物质
特点
质量变化
浓氨水、酒精
具有挥发性
溶质挥发,溶质质量分数__________
氢氧化钠、氢氧化钙固体
与空气中的二氧化碳反应
固体质量_______
干燥剂(氧化钙、浓硫酸、氢氧化钠固体)
易吸水
吸收水分,质量_______
减小
增大
增大
表达式:______
+_______→盐
+______
实质:酸中的_____________
与碱中的___________________
结合生成_______________
,即H+
+OH-
=
H2O
中和反应(详见实验突破栏目)
应用
农业:改良土壤的酸碱性,如:用熟石灰改良酸性土壤
工业:处理工厂废水,如:用熟石灰处理酸性废水;印染厂的废水呈碱性,加入稀硫酸进行中和
医药:如用含氢氧化铝的药物治疗胃酸过多
生活实际:如在蚊虫叮咬处,可以涂一些含碱性物质的溶液(如肥皂水)以减轻痛痒
酸
碱
水
H+(或氢离子)
OH-(或氢氧根离子)
H2O(或水分子)
考点梳理:中和反应
下列关于酸和碱的说法正确的是________。①打开浓盐酸、浓硫酸的试剂瓶,瓶口都有白雾产生②浓硫酸露置于空气中质量增大,溶质质量分数减小③与酸反应产生气体的固体一定是活泼金属④碱能使酚酞溶液变红,所以能使酚酞溶液变红的一定是碱⑤中和反应生成盐和水,所以生成盐和水的反应一定是中和反应⑥氢氧化钠固体吸水易潮解,可用来干燥CO2气体
②
典型例题
1.
盐酸、硫酸的化学性质(“酸五条”)
(1)写出下列化学式甲______ 乙_________ 丙______(2)写出图中涉及的化学方程式
Fe2O3
Ca(OH)2
BaCl2
①_________________________________________
_________________________________________
②_________________________________________
_________________________________________
③_________________________________________
_________________________________________
④_________________________________________
_________________________________________
_________________________________________
_________________________________________
⑤_________________________________________
⑥_________________________________________
Zn+2HCl
===
ZnCl2+H2↑
Zn+H2SO4
===
ZnSO4+H2↑
2HCl+Ca(OH)2
===
CaCl2+2H2O
H2SO4+Ca(OH)2
===
CaSO4+2H2O
H2SO4+Na2CO3
===
Na2SO4+H2O+CO2↑
2HCl+Na2CO3
===
2NaCl+H2O+CO2↑
CuO+2HCl
===
CuCl2+H2O
CuO+H2SO4
===
CuSO4+H2O
H2SO4+BaCl2
===
BaSO4↓+2HCl
HCl+AgNO3
===
AgCl↓+HNO3
Fe2O3+3H2SO4
===
Fe2(SO4)3+3H2O
Fe2O3+6HCl
===2
FeCl3+3H2O
2.
氢氧化钠、氢氧化钙的化学性质(“碱四条”)
(1)写出下列化学式甲______ 乙______ 丙__________(2)写出图中涉及的化学方程式
CuSO4
CO2
Na2CO3
①_________________________________________
_________________________________________
②_________________________________________
_________________________________________
_________________________________________
_________________________________________
③_________________________________________
_________________________________________
④_________________________________________
H2SO4+2NaOH
===
Na2SO4+2H2O
H2SO4+Ca(OH)2
===
CaSO4+2H2O
2NaOH+MgCl2
===
Mg(OH)2↓+2NaCl
Ca(OH)2+MgCl2
===
Mg(OH)2↓+CaCl2
2NaOH+CuSO4
===
Cu(OH)2↓+Na2SO4
CuSO4+Ca(OH)2
===
CaSO4+Cu(OH)2↓
CO2+2NaOH
===
Na2CO3+H2O
CO2+Ca(OH)2
===
CaCO3↓+H2O
Ca(OH)2+Na2CO3
===
CaCO3↓+2NaOH
1.实验原理:中和反应过程中往往没有明显现象,无法确定是否发生反应,因此需借助酸碱指示剂来判断反应的发生。2.实验装置
实验:中和反应
3.实验操作及现象
在烧杯中加入约5
mL氢氧化钠溶液,再滴入几滴酚酞溶液,溶液变为______色,然后用胶头滴管逐滴加入稀盐酸,并不断搅拌至____________________为止。
4.实验结论
(1)氢氧化钠溶液能与稀盐酸发生中和反应,反应的化学方程式为____________________________。(2)微观实质______________________。
红
溶液由红色变为无色
NaOH+HCl
===
NaCl+H2O
H++OH-
===
H2O
5.指示剂选择:一般不用紫色石蕊溶液代替无色酚酞溶液,其原因是______________________________________________________________________________________。6.药品滴加顺序:能否向稀盐酸中滴加无色酚酞溶液后再滴加氢氧化钠溶液的方法验证恰好完全反应,并说明理由:_____________________________________________________________________________________________________________________________________。7.异常现象:实验时将稀盐酸滴入氢氧化钠溶液中观察到有气泡冒出,可能原因是_____________________。
紫色石蕊溶液在碱性溶液中呈蓝色,在中性溶液中呈紫色,而蓝色和紫色之间没有明显的界限
不能,酚酞溶液遇酸性和中性溶液均不变色,当滴加氢氧化钠溶液至溶液由无色变为红色时,说明此时溶液显碱性,故无法验证二者恰好完全反应
氢氧化钠溶液已变质
8.证明酸碱是否发生反应除了借助指示剂,是否还有其他方法?(以氢氧化钠溶液和稀盐酸反应为例)(1)借助pH变化图
①图1表示将________滴加到_______________中。
分析:图1中,A点pH____(填“>”、“<”或“=”,下同)7,可判断出反应前溶液显____(填“酸”、“碱”或“中”)性;B点pH____7,表示_________________________________,此时溶液中的溶质是______;C点pH___7,此时溶液中的溶质是__________。②同理,图2表示将_______________滴加到________中。
稀盐酸
氢氧化钠溶液
>
碱
=
稀盐酸和氢氧化钠溶液恰好完全反应
NaCl
<
NaCl、HCl
氢氧化钠溶液
稀盐酸
(2)借助温度变化图
①当实验进行到_____s时,酸与碱恰好完全反应;②从能量变化的角度看,该反应属于______反应(填“放热”或“吸热”)。
44
放热
例 为证明酸与碱发生了反应,实验小组同学进行了如下实验,请据图回答:
图1
(1)甲中滴加无色酚酞溶液的作用是___________________________________。(2)用滴管滴入稀硫酸,能证明乙中发生反应的现象是_____________,发生反应的化学方程式为___________________________________。
借助指示剂颜色变化判断反应是否发生
红色逐渐褪去
2NaOH+H2SO4
===
Na2SO4+2H2O
(3)为确定乙中反应后溶液的溶质成分,同学们进行如图丙实验,其操作中存在的问题是_____________________________;若用正确操作测得该溶液的pH=5,则反应后溶液中溶质的化学式为________________。
(4)若取适量稀硫酸于烧杯中,测其温度后,加入适量的氢氧化钠固体,充分反应后再测温度,发现温度明显升高。于是得出结论,该反应放热。你认为结论是否正确?________;理由是__________________________。
pH试纸不能直接伸入待测液中
H2SO4、Na2SO4
不正确
氢氧化钠溶于水也会放热
(5)实验小组用传感器探究NaOH溶液与稀硫酸反应过程中温度和pH的变化。测定结果如图所示,下列说法不正确的是___。
图2
A.
反应过程中有热量放出B.
30
s时,溶液中溶质为H2SO4和Na2SO4C.
该实验是将稀硫酸滴入稀NaOH溶液D.
从20
s到40
s,溶液的温度升高、pH增大
C
