高中化学苏教版选修三 4.1.3 分子的空间构型——从氮素循环中含氮物质开始的讨论 课件 (共15张PPT)
文档属性
| 名称 | 高中化学苏教版选修三 4.1.3 分子的空间构型——从氮素循环中含氮物质开始的讨论 课件 (共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-02 21:54:01 | ||
图片预览





文档简介
(共15张PPT)
分子的空间构型
苏教版选修3《物质的结构与性质》
专题4
分子的空间结构与物质性质
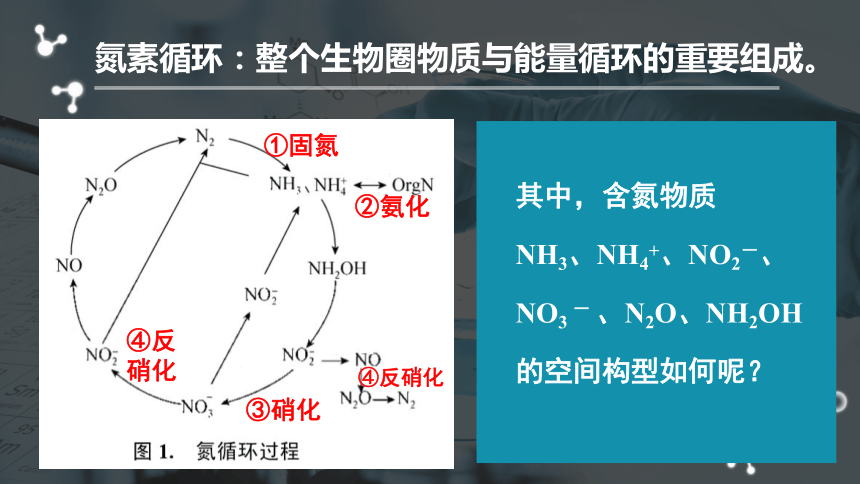
其中,含氮物质
NH3、NH4+、NO2-、
NO3
-
、N2O、NH2OH
的空间构型如何呢?
氮素循环:整个生物圈物质与能量循环的重要组成。
①固氮
②氨化
③硝化
④反硝化
④反硝化
N原子的价电子数为5
(2s22p3
),电子式为
;
H
的价电子数为1;
预测:氨分子的空间构型
N为中心,4对价电子对的电子云在空间是平面四边形取向?还是空间四面体取向?为什么呢?
气球模拟
2
3
4
中心原子的
价电子对数:
直线取向
平面三角形取向
四面体取向
预测:氨分子的空间构型
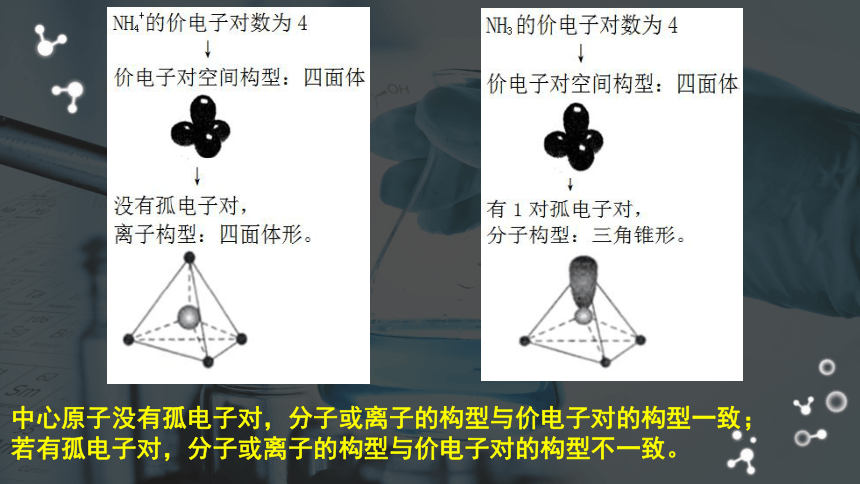
NH3的空间构型为
三角锥形
,不是正四面体
。
(键角为107.5°,不是109.5°
.)
预测:NH4+的空间构型
NH4+的空间构型为
正四面体
。
(键角为109.5°
。)
中心原子没有孤电子对,分子或离子的构型与价电子对的构型一致;
若有孤电子对,分子或离子的构型与价电子对的构型不一致。
01、找出中心原子
02、计算价电子对数
03、确定模型,预测构型
常见的ABn形分子或ABnm±离子中,一般单原子A为中心原子,B为配位原子;
价电子对数=(a+nb)/2;
a:中心原子的价电子数;
b的取值:若B为H、X,b=1;若B为O、S,b=0;
价层电子对互斥理论
价电子对数包括孤电子对数和成键电子对数,
成键电子对数即为配位原子数。
价电子
对数
价电子对空间取向
孤电子对数
分子或离子
空间构型
NO3-
NO2-
N2O
3
平面三角形
0
平面三角形
3
平面三角形
1
V形
2
(同CO2)
直线形
0
直线形
若要检验预测的分子结构是否真实,还需要实际测量,常采用的方法有X射线衍射等现代物理化学测量方法。
01
具有相同的价电子数和相同原子数的分子或离子具有相同的结构特征,称为“等电子原理”。
含氮物质
NH3、NH4+、NO3-、
NO2
-
、N2O、NH2OH
的性质如何呢?
氮素循环:整个生物圈物质与能量循环的重要组成。
DNA碱基配对,组装成双螺旋体
通过氢键自组装成超分子
谢
谢
分子的空间构型
苏教版选修3《物质的结构与性质》
专题4
分子的空间结构与物质性质
其中,含氮物质
NH3、NH4+、NO2-、
NO3
-
、N2O、NH2OH
的空间构型如何呢?
氮素循环:整个生物圈物质与能量循环的重要组成。
①固氮
②氨化
③硝化
④反硝化
④反硝化
N原子的价电子数为5
(2s22p3
),电子式为
;
H
的价电子数为1;
预测:氨分子的空间构型
N为中心,4对价电子对的电子云在空间是平面四边形取向?还是空间四面体取向?为什么呢?
气球模拟
2
3
4
中心原子的
价电子对数:
直线取向
平面三角形取向
四面体取向
预测:氨分子的空间构型
NH3的空间构型为
三角锥形
,不是正四面体
。
(键角为107.5°,不是109.5°
.)
预测:NH4+的空间构型
NH4+的空间构型为
正四面体
。
(键角为109.5°
。)
中心原子没有孤电子对,分子或离子的构型与价电子对的构型一致;
若有孤电子对,分子或离子的构型与价电子对的构型不一致。
01、找出中心原子
02、计算价电子对数
03、确定模型,预测构型
常见的ABn形分子或ABnm±离子中,一般单原子A为中心原子,B为配位原子;
价电子对数=(a+nb)/2;
a:中心原子的价电子数;
b的取值:若B为H、X,b=1;若B为O、S,b=0;
价层电子对互斥理论
价电子对数包括孤电子对数和成键电子对数,
成键电子对数即为配位原子数。
价电子
对数
价电子对空间取向
孤电子对数
分子或离子
空间构型
NO3-
NO2-
N2O
3
平面三角形
0
平面三角形
3
平面三角形
1
V形
2
(同CO2)
直线形
0
直线形
若要检验预测的分子结构是否真实,还需要实际测量,常采用的方法有X射线衍射等现代物理化学测量方法。
01
具有相同的价电子数和相同原子数的分子或离子具有相同的结构特征,称为“等电子原理”。
含氮物质
NH3、NH4+、NO3-、
NO2
-
、N2O、NH2OH
的性质如何呢?
氮素循环:整个生物圈物质与能量循环的重要组成。
DNA碱基配对,组装成双螺旋体
通过氢键自组装成超分子
谢
谢
