第三节 氧化剂与还原剂
图片预览






文档简介
(共25张PPT)
第3节
氧化剂和还原剂
交流 研讨
写出下列反应的化学方程式,分析各物质所含元素的化合价在反应前后是否发生变化.
1、铜与氧气反应
2、氧化铜与氢气反应
3、碳酸钙高温加热
4、铁与硫酸铜溶液反应
5、NaCl溶液与AgNO3溶液反应
氧化还原反应:
在反应过程中有元素化合价变化的
化学反应叫做氧化还原反应
反应物所含元素化合价升高的反应称为 氧化反应
反应物所含元素化合价降低的反应称为 还原反应
(或者说这种物质被氧化了)
(或者说这种物质被还原了)
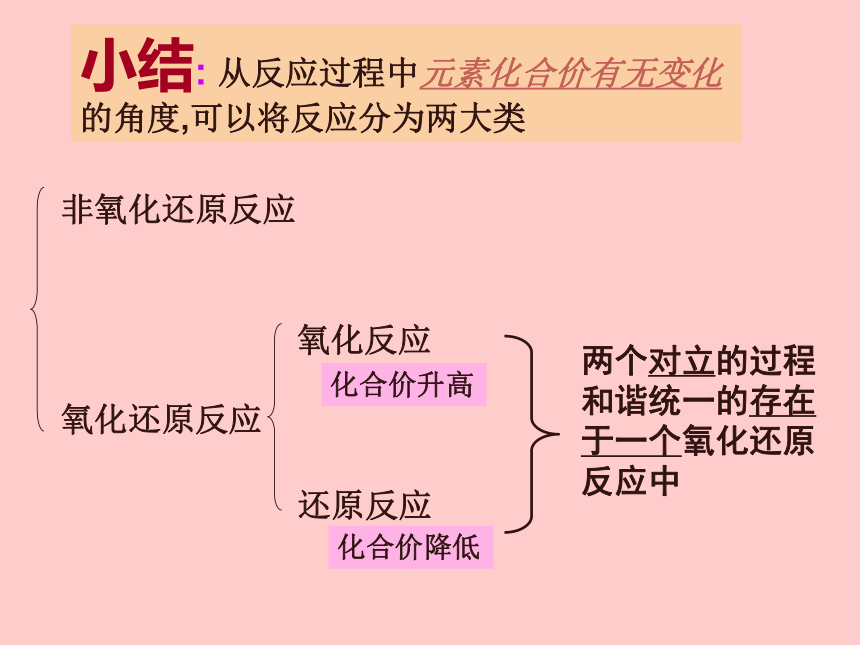
小结: 从反应过程中元素化合价有无变化的角度,可以将反应分为两大类
两个对立的过程和谐统一的存在于一个氧化还原反应中
氧化还原反应
非氧化还原反应
氧化反应
还原反应
化合价升高
化合价降低
探究氧化还原反应的本质:
例 : 钠在氯气中燃烧
例 : 铁和硫酸铜溶液
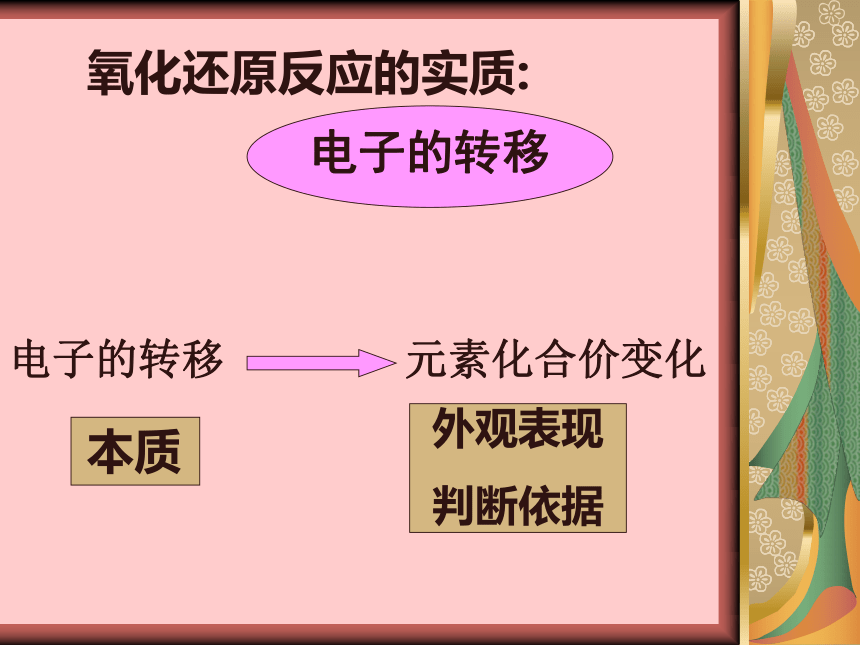
氧化还原反应的实质:
电子的转移
电子的转移
元素化合价变化
本质
外观表现
判断依据
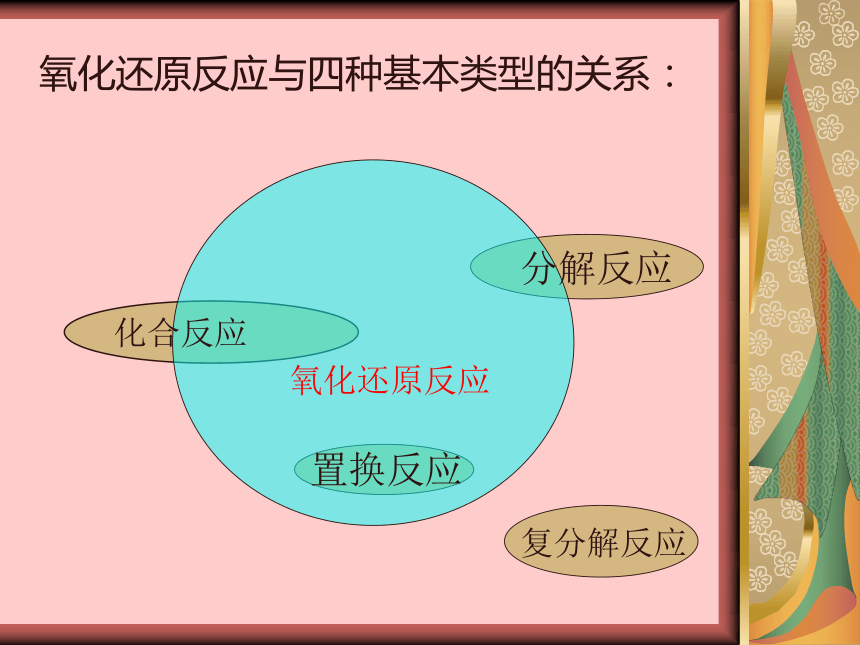
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应与四种基本类型的关系:
标出下列物质中各元素的化合价
P2O5 SO2 KClO3 KMnO4 H2SO4 Cl2
+5
MnO2 HNO3 ZnO NaOH CaCO3 WO3
+4
+4
+5
+1 +7
+6
0
+5
+2
+1 -2 +1
+4 -2
+6
二、氧化剂和还原剂
交流 研讨
1、Cu+Cl2 CuCl2
2、Zn+H2SO4 ZnSO4+H2
点 燃
3、CaCO3+2HCl CaCl2 +H20 + CO2
+2
0
0
-1
0
+2
+1
0
氧化剂
还原剂
氧化剂
还原剂
Cl2+H2O HCl+HClO
Fe+4HNO3(稀) Fe(NO3)3+2H2O+NO
BaCl2+H2SO4 BaSO4 + 2HCl
0
-1
+1
0
+5
+3
+2
还原剂
(氧化剂)
氧化剂
还原剂
2H2O2 2H2O + O2
Fe2O3 + 3CO 2Fe + 3CO2
催 化 剂
高 温
-1
-2
0
+3
0
+2
+4
还原剂
(氧化剂)
氧化剂
还原剂
氧化剂:
还原剂:
使对方化合价升高
使对方化合价降低
所含元素的化合价降低的反应物
所含元素的化合价升高的反应物
具有氧化性
具有还原性
物质中的元素为最高价时:
一般做氧化剂,显氧化性
物质中的元素为最低价时:
一般做还原剂,显还原性
物质中的 元素为中间价态的时候:
既可以做氧化剂又可以做还原剂;
元素的化合价与物质的氧化性、还原性有何关系?
活泼的非金属单质:氧气,氯气等
高价态的含氧酸:硝酸,浓硫酸等
含高价态元素的盐:高锰酸钾,氯化铁等
KMnO4 FeCl3
常见的氧化剂和还原剂:
氧化剂
活泼的金属单质:铁,钠,锌
非金属单质:氢气,炭
低价态的氧化物和盐:CO, 亚硫酸钠(Na2SO3),
SO2 硫酸亚铁(FeSO4)
还原剂
下列对属于氧化还原反应的进行分析,并
指出氧化剂和还原剂。
A、HCl + NH3 NH4Cl
B、2FeCl2+ Cl2 2FeCl3
C、NH4HCO3 NH3 ↑+ H20 +CO2↑
D、MnO2 + 4HCl MnCl2 + Cl2↑ + 2H2O
▲
自我
评价
▲
铁及其化合物的氧化性和还原性
案例:
铁:
地壳中的含量在所有元素中 第4位
在地壳中
的存在形式
游离态:
陨铁
化合态:
+2 +3
在金属元素中 第2位
铁及其化合物的氧化性和还原性
活动 探究
Fe FeCl2 FeCl3
预测与假设:
具有氧化性的物质:
具有还原性的物质:
既具有氧化性又具有还原性:
Fe
FeCl2
FeCl3
提供的药品:
稀硫酸、稀硝酸、氯水
锌、铜
KSCN(硫氰化钾)
0
+2
+3
实验内容 实验现象 实验结论
铁 + 稀硫酸
铁粉溶解,有无色气体生成溶液由无色变成淡绿色
铁单质有还原性
铜 +
FeCl3溶液
溶液由黄色变成蓝绿色
FeCl3
有氧化性
锌+
FeCl2溶液
溶液有淡绿色变成无色
FeCl2
有氧化性
FeCl2溶液+硝酸+KSCN
溶液变红
FeCl2
有还原性
铁及其化合物的相互转换关系:
铁三角
Fe
Fe2+
Fe3+
弱氧化剂
强氧化剂
强氧化剂
Zn
Zn
CuFe
第3节
氧化剂和还原剂
交流 研讨
写出下列反应的化学方程式,分析各物质所含元素的化合价在反应前后是否发生变化.
1、铜与氧气反应
2、氧化铜与氢气反应
3、碳酸钙高温加热
4、铁与硫酸铜溶液反应
5、NaCl溶液与AgNO3溶液反应
氧化还原反应:
在反应过程中有元素化合价变化的
化学反应叫做氧化还原反应
反应物所含元素化合价升高的反应称为 氧化反应
反应物所含元素化合价降低的反应称为 还原反应
(或者说这种物质被氧化了)
(或者说这种物质被还原了)
小结: 从反应过程中元素化合价有无变化的角度,可以将反应分为两大类
两个对立的过程和谐统一的存在于一个氧化还原反应中
氧化还原反应
非氧化还原反应
氧化反应
还原反应
化合价升高
化合价降低
探究氧化还原反应的本质:
例 : 钠在氯气中燃烧
例 : 铁和硫酸铜溶液
氧化还原反应的实质:
电子的转移
电子的转移
元素化合价变化
本质
外观表现
判断依据
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应与四种基本类型的关系:
标出下列物质中各元素的化合价
P2O5 SO2 KClO3 KMnO4 H2SO4 Cl2
+5
MnO2 HNO3 ZnO NaOH CaCO3 WO3
+4
+4
+5
+1 +7
+6
0
+5
+2
+1 -2 +1
+4 -2
+6
二、氧化剂和还原剂
交流 研讨
1、Cu+Cl2 CuCl2
2、Zn+H2SO4 ZnSO4+H2
点 燃
3、CaCO3+2HCl CaCl2 +H20 + CO2
+2
0
0
-1
0
+2
+1
0
氧化剂
还原剂
氧化剂
还原剂
Cl2+H2O HCl+HClO
Fe+4HNO3(稀) Fe(NO3)3+2H2O+NO
BaCl2+H2SO4 BaSO4 + 2HCl
0
-1
+1
0
+5
+3
+2
还原剂
(氧化剂)
氧化剂
还原剂
2H2O2 2H2O + O2
Fe2O3 + 3CO 2Fe + 3CO2
催 化 剂
高 温
-1
-2
0
+3
0
+2
+4
还原剂
(氧化剂)
氧化剂
还原剂
氧化剂:
还原剂:
使对方化合价升高
使对方化合价降低
所含元素的化合价降低的反应物
所含元素的化合价升高的反应物
具有氧化性
具有还原性
物质中的元素为最高价时:
一般做氧化剂,显氧化性
物质中的元素为最低价时:
一般做还原剂,显还原性
物质中的 元素为中间价态的时候:
既可以做氧化剂又可以做还原剂;
元素的化合价与物质的氧化性、还原性有何关系?
活泼的非金属单质:氧气,氯气等
高价态的含氧酸:硝酸,浓硫酸等
含高价态元素的盐:高锰酸钾,氯化铁等
KMnO4 FeCl3
常见的氧化剂和还原剂:
氧化剂
活泼的金属单质:铁,钠,锌
非金属单质:氢气,炭
低价态的氧化物和盐:CO, 亚硫酸钠(Na2SO3),
SO2 硫酸亚铁(FeSO4)
还原剂
下列对属于氧化还原反应的进行分析,并
指出氧化剂和还原剂。
A、HCl + NH3 NH4Cl
B、2FeCl2+ Cl2 2FeCl3
C、NH4HCO3 NH3 ↑+ H20 +CO2↑
D、MnO2 + 4HCl MnCl2 + Cl2↑ + 2H2O
▲
自我
评价
▲
铁及其化合物的氧化性和还原性
案例:
铁:
地壳中的含量在所有元素中 第4位
在地壳中
的存在形式
游离态:
陨铁
化合态:
+2 +3
在金属元素中 第2位
铁及其化合物的氧化性和还原性
活动 探究
Fe FeCl2 FeCl3
预测与假设:
具有氧化性的物质:
具有还原性的物质:
既具有氧化性又具有还原性:
Fe
FeCl2
FeCl3
提供的药品:
稀硫酸、稀硝酸、氯水
锌、铜
KSCN(硫氰化钾)
0
+2
+3
实验内容 实验现象 实验结论
铁 + 稀硫酸
铁粉溶解,有无色气体生成溶液由无色变成淡绿色
铁单质有还原性
铜 +
FeCl3溶液
溶液由黄色变成蓝绿色
FeCl3
有氧化性
锌+
FeCl2溶液
溶液有淡绿色变成无色
FeCl2
有氧化性
FeCl2溶液+硝酸+KSCN
溶液变红
FeCl2
有还原性
铁及其化合物的相互转换关系:
铁三角
Fe
Fe2+
Fe3+
弱氧化剂
强氧化剂
强氧化剂
Zn
Zn
CuFe
