高中化学苏教版选修四 1.2 化学能与电能的转化 电化学中的定量计算(共16张PPT)
文档属性
| 名称 | 高中化学苏教版选修四 1.2 化学能与电能的转化 电化学中的定量计算(共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-04 10:46:33 | ||
图片预览





文档简介
(共16张PPT)
电化学中的定量计算
学习目标
通过原电池、电解池原理掌握计算的基本方法
法一:根据电子得失守恒计算
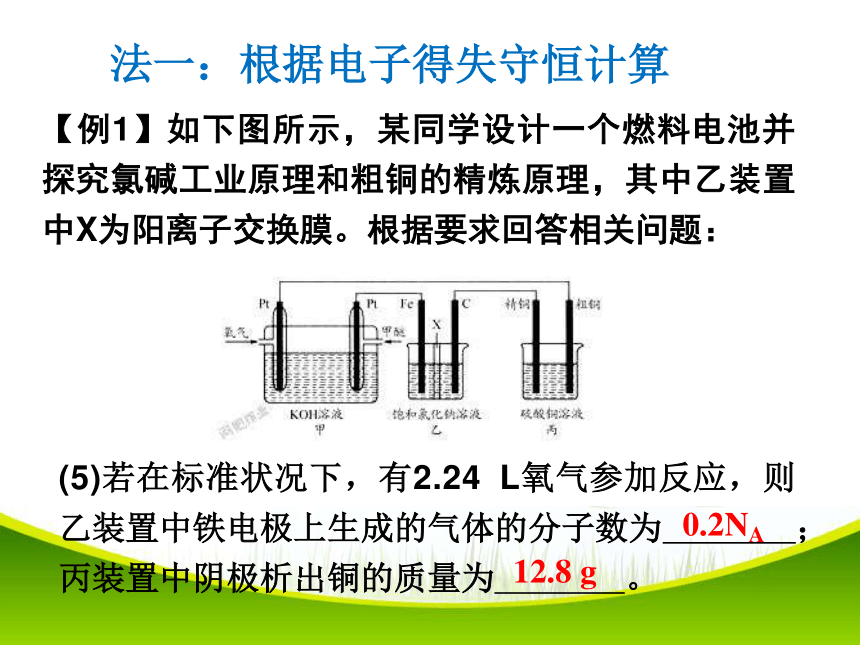
【例1】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
(5)若在标准状况下,有2.24
L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
;丙装置中阴极析出铜的质量为
。
0.2NA
12.8
g
想一想
在电解池中生成哪些物质能转移
4
mol
e-?
4e-
~
2Cl2(Br2、I2)~
O2
~
2H2
~
2Cu
~
4Ag
~
(4/n)M
阳极产物
阴极产物
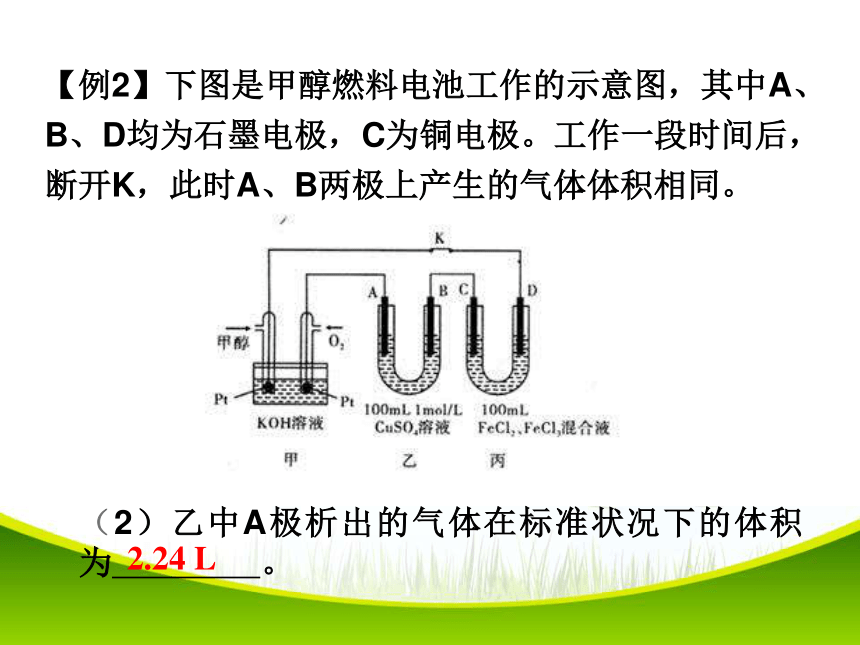
【例2】下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
(2)乙中A极析出的气体在标准状况下的体积为
。
2.24
L
总结1
哪些问题可以通过得失电子守恒进行计算?
多用于电池串联中某电极质量的变化、电解池中某极产生或原电池中某极消耗标况下气体的体积(物质的量、分子数)、电解池中原电解质溶液(离子)的浓度。
变式训练1
将0.2
mol
AgNO3、0.4
mol
Cu(NO3)2、0.6
mol
KCl溶于水,配成100
mL溶液,用石墨电极电解一段时间后,若在一极析出0.3
mol
Cu,此时另一极上产生的气体体积(标准状况)为(
)
A.4.48
L
B.5.6
L
C.6.72
L
D.7.84
L
B
法二:根据某离子守恒计算
例2中断开K时,乙中溶质的物质的量浓度为
mol·L-1。(不考虑溶液体积的变化)。
1
总结2
哪些问题可以通过离子守恒进行计算?
电解后溶液中某离子的物质的量不变,求出与之相联系的某物质或某离子的物质的量(或物质的量浓度)
变式训练2
用惰性电极电解100
mL
4.0
mol
·L-1的CuSO4溶液,一定时间后在阳极收集到1.12
L(标况下)气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)(?
)
A.2.7mol·L-1
B.3.0
mol·L-1
C.4
.0
mol·L-1
D.1.0
mol·L-1
C
法三:根据总反应式计算
【例3】将两个铂电极插入500
mL
CuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。此时溶液中氢离子浓度约(
)
A.4×10-3mol·L-1
B.2×10-3mol·L-1
C.1×
10-3
mol·L-1
D.1×10-7
mol·L-1
A
总结3
哪些问题可以通过总反应式进行计算?
多用于电解某盐溶液后,求生成的H+或OH-的浓度、或求溶液的PH值
变式训练3
碱性铁电池工作原理为3Fe
+
2K2FeO4
+
8H2O
==3Fe(OH)2
+
2Fe(OH)3
+
4KOH,以该电池为电源,用石墨为电极,电解200
mL
饱和食盐水,恰好完全反应时电源负极减轻5.6
g。则电解后溶液中OH-的浓度为
。
1mol/L
本节小结
电化学中
定量计算的基本方法
得失电子守恒
某离子守恒
总反应式
随堂练习
A
0.1
NaOH
3.
D
电化学中的定量计算
学习目标
通过原电池、电解池原理掌握计算的基本方法
法一:根据电子得失守恒计算
【例1】如下图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
(5)若在标准状况下,有2.24
L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
;丙装置中阴极析出铜的质量为
。
0.2NA
12.8
g
想一想
在电解池中生成哪些物质能转移
4
mol
e-?
4e-
~
2Cl2(Br2、I2)~
O2
~
2H2
~
2Cu
~
4Ag
~
(4/n)M
阳极产物
阴极产物
【例2】下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
(2)乙中A极析出的气体在标准状况下的体积为
。
2.24
L
总结1
哪些问题可以通过得失电子守恒进行计算?
多用于电池串联中某电极质量的变化、电解池中某极产生或原电池中某极消耗标况下气体的体积(物质的量、分子数)、电解池中原电解质溶液(离子)的浓度。
变式训练1
将0.2
mol
AgNO3、0.4
mol
Cu(NO3)2、0.6
mol
KCl溶于水,配成100
mL溶液,用石墨电极电解一段时间后,若在一极析出0.3
mol
Cu,此时另一极上产生的气体体积(标准状况)为(
)
A.4.48
L
B.5.6
L
C.6.72
L
D.7.84
L
B
法二:根据某离子守恒计算
例2中断开K时,乙中溶质的物质的量浓度为
mol·L-1。(不考虑溶液体积的变化)。
1
总结2
哪些问题可以通过离子守恒进行计算?
电解后溶液中某离子的物质的量不变,求出与之相联系的某物质或某离子的物质的量(或物质的量浓度)
变式训练2
用惰性电极电解100
mL
4.0
mol
·L-1的CuSO4溶液,一定时间后在阳极收集到1.12
L(标况下)气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)(?
)
A.2.7mol·L-1
B.3.0
mol·L-1
C.4
.0
mol·L-1
D.1.0
mol·L-1
C
法三:根据总反应式计算
【例3】将两个铂电极插入500
mL
CuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。此时溶液中氢离子浓度约(
)
A.4×10-3mol·L-1
B.2×10-3mol·L-1
C.1×
10-3
mol·L-1
D.1×10-7
mol·L-1
A
总结3
哪些问题可以通过总反应式进行计算?
多用于电解某盐溶液后,求生成的H+或OH-的浓度、或求溶液的PH值
变式训练3
碱性铁电池工作原理为3Fe
+
2K2FeO4
+
8H2O
==3Fe(OH)2
+
2Fe(OH)3
+
4KOH,以该电池为电源,用石墨为电极,电解200
mL
饱和食盐水,恰好完全反应时电源负极减轻5.6
g。则电解后溶液中OH-的浓度为
。
1mol/L
本节小结
电化学中
定量计算的基本方法
得失电子守恒
某离子守恒
总反应式
随堂练习
A
0.1
NaOH
3.
D
