苏教化学选修 化学反应原理专题1第二单元 化学能与电能的转化(共17张PPT)
文档属性
| 名称 | 苏教化学选修 化学反应原理专题1第二单元 化学能与电能的转化(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 618.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-03 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
第二单元
化学能与电能的转化
原电池的工作原理
各类电池
1、原电池的定义:
2、原电池反应的本质:
3、构成原电池的条件:
将化学能转化为电能的装置叫做原电池。
氧化还原反应
①两个活动性不同的金属(或其中一种为
非金属,即作导体用)作电极。
②电解质溶液
③形成闭合回路
④在这种电解质溶液中能自发地进行氧化还原反应
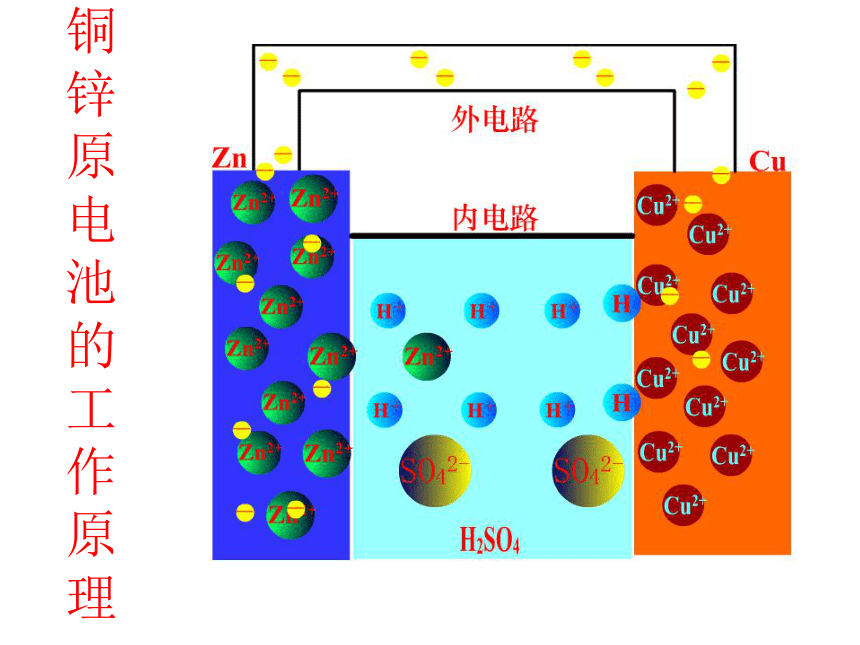
铜锌原电池的工作原理
4、原电池反应原理
①粒子流向
电子:负极→正极
电流:正极→负极
溶液中阴离子→负极
溶液中阳离子→正极
②电极
反应
负极:氧化反应
活泼金属失电子变阳离子
正极:还原反应
溶液中离子得电子
总反应:负极金属与电解质溶液的离子反应
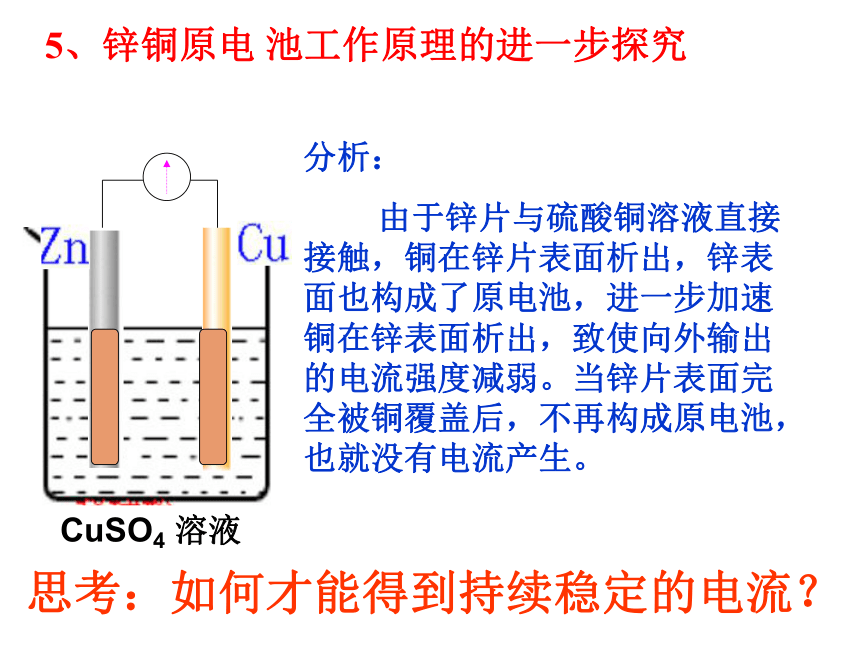
思考:如何才能得到持续稳定的电流?
分析:
由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。
5、锌铜原电
池工作原理的进一步探究
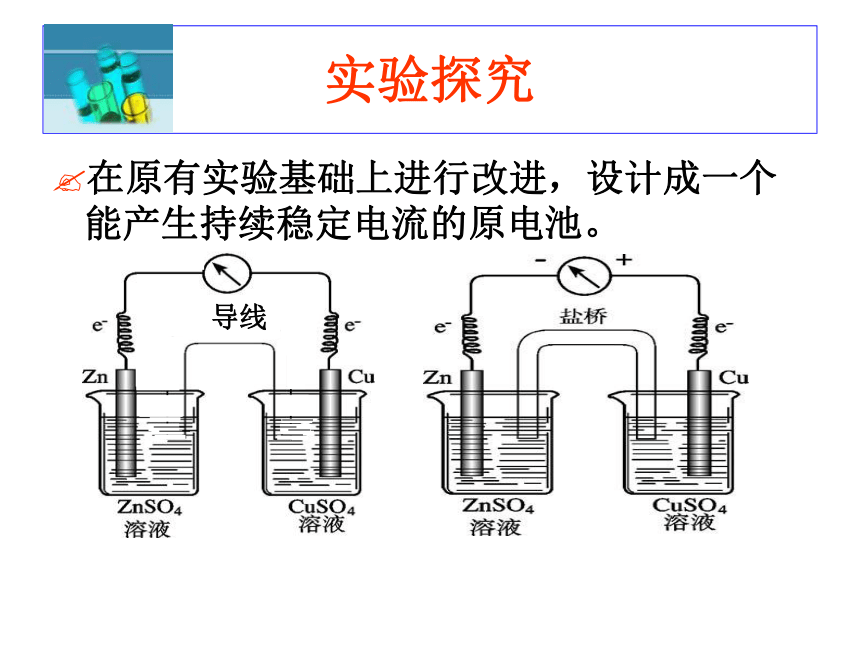
在原有实验基础上进行改进,设计成一个能产生持续稳定电流的原电池。
实验探究
锌铜原电池装置示意图
盐桥制法:将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。
由两个半电池组成,锌
和锌盐组成锌半电池,铜和
铜盐组成铜半电池;每个半
电池中的电极与电解质溶液
互不反应,中间通过盐桥连接
形成闭合回路。
装置特点:
盐桥的作用:
(1)是离子通道,与外电路的电子通道相衔接;(2)是离子库,为保持溶液电中性,氧化作用产生的Zn2+需要阴离子来补充,Cu2+发生还原反应,需要阳离子来补充;而作为KCl饱和溶液盐桥有足够的离子供给,所以是离子库。
负极反应:
Zn-2e-=
Zn2+
正极反应:
Cu2++2e-
=
Cu
电池总反应:
Zn+Cu2+=
Zn2++Cu
锌半电池
铜半电池
氧化反应
Zn-2e-=Zn2+
铜锌原电池
电解质溶液
盐桥
失e-,沿导线传递,有电流产生
还原反应
Cu2++2e-
=Cu
阴离子
阳离子
负极
正极
阳离子
铜锌双液原
电
池
原
理
外电路
内电路
电极反应总式:
氧化还原反应
原电池反应本质:
①活泼性不同
的两种金属。如锌铜原电池,锌作负极,铜作正极
②金属和非金属。如锌锰干电池,锌作负极,石墨棒作正极
③金属和化合物。如铅蓄电池,铅块作负极,PbO2作正极
④惰性电极。如氢氧燃料电池中,两根电极均可用Pt
(2)电池的电极材料必须能导电
(1)电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应
与电极材料具有相同的阳离子。
6、原电池的设计
1.根据上述原理,为获得较长时间的稳定电流,如何将必修2中由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
课堂练习(上述原理的应用)
练习:
利用Fe
+
Cu2+=Fe2+
+Cu设计一个原电池,画出示意图,写出电极反应。
负极:Fe
–
2e-
=Fe2+
正极:Cu2+
+2e-
=Cu
Cu
Fe
CuSO4
FeSO4
请根据氧化还原反应
:
Cu
+2
Fe3+
=
Cu2+
+
2Fe2+
设计成原电池。你有哪些可行方案?
Cu
Cu
–
2e-
=
Cu2+
比Cu不活泼的金属或石墨
2Fe3+
+
2e-
=
2Fe2+
Fe2(SO4
)3、FeCl3等
负极:
正极:
电解质溶液:
练一练
若是采用烧杯和盐桥装置图,采用的电解质溶液又是什么?
7、原电池的表示方法:
(-)
Zn|Zn2+
(C1)
‖
Cu2+
(C2)|Cu
(+)
“|”表示液-固相有一界面;“‖”表示盐桥。
在有气体参加的电池中还要表明气体的压力,溶液要表明浓度。
化学电池的组成
能导电的物质
还原性较强的物质(多是金属电极本身)
氧化性较强的物质
酸溶液
碱溶液
盐溶液
或
熔融液
流出电子
流入电子
氧化反应
还原反应
组成
负极
正极
电解质
电极材料
电极上发
生反应的
物质
电子流向
反应类型
第二单元
化学能与电能的转化
原电池的工作原理
各类电池
1、原电池的定义:
2、原电池反应的本质:
3、构成原电池的条件:
将化学能转化为电能的装置叫做原电池。
氧化还原反应
①两个活动性不同的金属(或其中一种为
非金属,即作导体用)作电极。
②电解质溶液
③形成闭合回路
④在这种电解质溶液中能自发地进行氧化还原反应
铜锌原电池的工作原理
4、原电池反应原理
①粒子流向
电子:负极→正极
电流:正极→负极
溶液中阴离子→负极
溶液中阳离子→正极
②电极
反应
负极:氧化反应
活泼金属失电子变阳离子
正极:还原反应
溶液中离子得电子
总反应:负极金属与电解质溶液的离子反应
思考:如何才能得到持续稳定的电流?
分析:
由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。
5、锌铜原电
池工作原理的进一步探究
在原有实验基础上进行改进,设计成一个能产生持续稳定电流的原电池。
实验探究
锌铜原电池装置示意图
盐桥制法:将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。
由两个半电池组成,锌
和锌盐组成锌半电池,铜和
铜盐组成铜半电池;每个半
电池中的电极与电解质溶液
互不反应,中间通过盐桥连接
形成闭合回路。
装置特点:
盐桥的作用:
(1)是离子通道,与外电路的电子通道相衔接;(2)是离子库,为保持溶液电中性,氧化作用产生的Zn2+需要阴离子来补充,Cu2+发生还原反应,需要阳离子来补充;而作为KCl饱和溶液盐桥有足够的离子供给,所以是离子库。
负极反应:
Zn-2e-=
Zn2+
正极反应:
Cu2++2e-
=
Cu
电池总反应:
Zn+Cu2+=
Zn2++Cu
锌半电池
铜半电池
氧化反应
Zn-2e-=Zn2+
铜锌原电池
电解质溶液
盐桥
失e-,沿导线传递,有电流产生
还原反应
Cu2++2e-
=Cu
阴离子
阳离子
负极
正极
阳离子
铜锌双液原
电
池
原
理
外电路
内电路
电极反应总式:
氧化还原反应
原电池反应本质:
①活泼性不同
的两种金属。如锌铜原电池,锌作负极,铜作正极
②金属和非金属。如锌锰干电池,锌作负极,石墨棒作正极
③金属和化合物。如铅蓄电池,铅块作负极,PbO2作正极
④惰性电极。如氢氧燃料电池中,两根电极均可用Pt
(2)电池的电极材料必须能导电
(1)电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应
与电极材料具有相同的阳离子。
6、原电池的设计
1.根据上述原理,为获得较长时间的稳定电流,如何将必修2中由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
课堂练习(上述原理的应用)
练习:
利用Fe
+
Cu2+=Fe2+
+Cu设计一个原电池,画出示意图,写出电极反应。
负极:Fe
–
2e-
=Fe2+
正极:Cu2+
+2e-
=Cu
Cu
Fe
CuSO4
FeSO4
请根据氧化还原反应
:
Cu
+2
Fe3+
=
Cu2+
+
2Fe2+
设计成原电池。你有哪些可行方案?
Cu
Cu
–
2e-
=
Cu2+
比Cu不活泼的金属或石墨
2Fe3+
+
2e-
=
2Fe2+
Fe2(SO4
)3、FeCl3等
负极:
正极:
电解质溶液:
练一练
若是采用烧杯和盐桥装置图,采用的电解质溶液又是什么?
7、原电池的表示方法:
(-)
Zn|Zn2+
(C1)
‖
Cu2+
(C2)|Cu
(+)
“|”表示液-固相有一界面;“‖”表示盐桥。
在有气体参加的电池中还要表明气体的压力,溶液要表明浓度。
化学电池的组成
能导电的物质
还原性较强的物质(多是金属电极本身)
氧化性较强的物质
酸溶液
碱溶液
盐溶液
或
熔融液
流出电子
流入电子
氧化反应
还原反应
组成
负极
正极
电解质
电极材料
电极上发
生反应的
物质
电子流向
反应类型
