人教版高中化学必修二1.3化学键 课件(44张ppt)
文档属性
| 名称 | 人教版高中化学必修二1.3化学键 课件(44张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-04 16:07:48 | ||
图片预览










文档简介
(共44张PPT)
你曾否想过?
1.为什么一百多种元素可形成一千多万种物质?
2.
为什么两个氢原子可以形成氢分子,而两个
氦原子却不能形成氦分子?
3.化合物中原子为什么总是按一定数目相结合?
第三节
化学键
化学键定义和分类
通常把分子或晶体中,相邻原子(或离子)间强烈的相互作用称为化学键。
按原子之间相互作用的方式和强度不同,将化学键又分为离子键、共价键和金属键。
Cl
Na
Na+
电子转移
不稳定
稳定
Cl-
动脑筋想想
在氯化钠晶体中,Na+和Cl-
之间存在哪些作用力?
Na+离子和Cl-离子之间的静电吸引。
阴阳离子的电子与电子、原子核与原子核之间的静电排斥。
离
子
键
定义:
像氯化钠这样阴、阳离子间通过静电作用所形成的化学键叫离子键。
含有离子键的化合物就是离子化合物。
成键粒子:
成键性质:
阴、阳离子
静电作用(静电引力和斥力)
1、活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
2、
活泼的金属元素和酸根离子形成的盐
3、铵根离子和酸根离子(或活泼非金属元素)形成的盐。
酸根离子:SO42-、NO3-、Cl-等
把NH4+看作是活泼的金属阳离子
离子化合物:含有离子键的化合物。
形成离子键的条件:
离子化合物
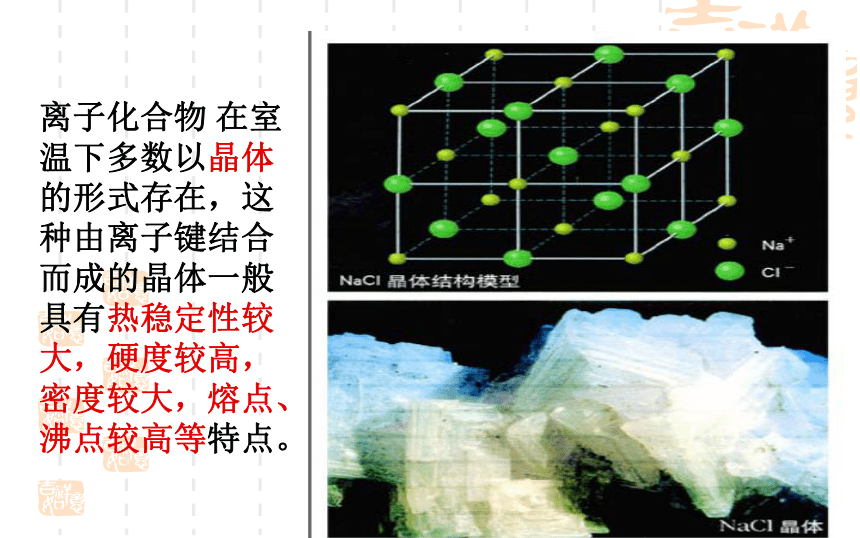
在室温下多数以晶体的形式存在,这种由离子键结合而成的晶体一般具有热稳定性较大,硬度较高,密度较大,熔点、沸点较高等特点。
在元素符号周围用“
·
”或“×”来表示原子最外层电子的式子,叫电子式。
H
·
Na·
·Mg
·
原子的电子式:
离子的电子式:
H+
Na+
Mg2+
金属阳离子的电子式就是其离子符号。
非金属阴离子的电子式要标
[
]
、最外层的电子及“
电荷数
”。
(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。
(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。
(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[
]”括起来,并在右上角标出“n·-”电荷字样。
电子式
写出下列粒子的电子式:
硫原子,
溴离子,
钾离子
K+
氯化钠
Na+
溴化钙
Ca2+
用
电子式
表示
离子化合物
的
形成过程:
用电子式表示氯化钠、溴化钙的形成过程
Na
·
+
→
Na+
·Ca·
+
+
→
Ca2+
1.离子必须标明电荷数,阴离子必须加[
]。
2.不能把“→”写成“=”。
3.原子可以合并写,离子不能合并写。
+
·Ca·
→
Ca2+
2
⑴
用电子式表示氧化镁的形成过程
·
Mg
·
+
→
Mg2+
⑵
用电子式表示硫化钾的形成过程
2K·
+
→
K+
K+
K·
+
K·
+
K+
→
K+
1、用电子式表示下列物质的
氯化钾、氧化镁、氯化钙、镁原子、氟离子、钠离子、氧化钠、氮化镁
2、用电子式表示下列物质的形成过程
氯化镁、硫化钾
阴阳离子间通过静电作用所形成的化学
键叫做离子键。(成键粒子、成键性质、
成键条件)
含有离子键的化合物一定是离子化合物
区分:
用电子式表示物质
用电子式表示物质形成过程
两个氢原子的电子云
形成氢分子
氢分子的形成:
H
·
氯化氢分子的形成:
·
H
+
→
H
·
+
→
原子间通过共用电子对所形成化学键,叫做共价键。
共用电子对不偏移,成键原子不显电性
共用电子对偏向氯原子,
共价键特点:
共价键特点:
H﹣H(结构式)
H﹣Cl(结构式)
氯原子带部分负电荷,氢原子带部分正电荷。
1、定义:原子间通过共用电子对所形成的化学键叫做共价键。
2、成键微粒:原子
3、相互作用:共用电子对
共价键
[归纳与整理]
1、共价键定义:
2、成键微粒:
3、相互作用:
[复习回忆]
原子间通过共用电子对所形成的化学键,叫做共价键。
原子
共用电子对
4、形成共价键条件:
非金属元素之间化合;Cl2、HCl、H2O
部分金属元素原子与非金属元素原子,如AlCl3
,FeCl3;
5、存在:不仅存在于非金属单质和共价化合物中,也存在于有些离子化合物中
H2
HCl
NaOH
NH4Cl
Na2O2
6、共价化合物:象HCl这样以共用电子对
形成分子的化合物。
思考
哪些粒子能形成共价键?
思考
离子键和共价键的比较
[
]
+
-
离子键
共价键
成键微粒
阴、阳离子
原子
成键本质
静电作用
共用电子对
表示法
以NaCl为例
以为HCl例
成键元素
典型的金属元素、典型的非金属元素之间
同种元素或同类非金属元素之间
HCl的电子式
Cl2的电子式
二、共价键
1.定义:原子间通过共用电子对形成的相互作用
2.表示式
①电子式
②结构式:
如:H-Cl
Cl-Cl
用一根短线表示一对共用电子。其他电子一律省去
1、写出下列物质的电子式和结构式
CH4、NH3、CO2、H2O、O2、N2、HClO
H2O
2
2、用电子式表示下列物质的形成过程
CO2
H2O
O2
共价键的分类
共价键分为非极性共价键和极性共价键。
非极性共价键:相同元素原子之间形成的共价键,由于两个相同原子吸引电子的能力(电负性)相同,共用电子对不偏向任何一方,成键原子不显电性。这样的共价键称之为非极性共价键,简称非极性键。如H2、O2分子中的共价键就是非极性键。
极性共价键:不同元素原子之间形成的共价键,成键原子的电负性不相等,共用电子对会偏向电负性较大的原子一端,使之带部分负电荷,而电负性较小的一端则带部分正电荷,共价键上出现带正电和和带负电荷的两极,这样的共价键称为极性共价键,简称极性键。如HCl、H2O
判断下列物质是离子化合物还是共价化合物,并写出电子式,是共价化合物的并写出结构式
氯化铵、氯化钙、氧化钠、过氧化钠、氢氧化钠、氮气、二氧化碳、三氯化磷、氨气、甲烷、四氯化碳、水、过氧化氢、氟化氢、硫化钠、次氯酸、氯化碘、氧气、氢氧化钙
[思考与交流]
所有的由非金属元素组成的化合物都是共价化合物吗?所有的由金属元素和金属元素组成的化合物都是离子化合物吗?
含有共价键的化合物一定是共价化合物吗?含有共价键的物质一定是共价化合物?
含有离子键的化合物一定是离子化合物?
所有的物质都含有化学键?
1.
下列分子的电子式书写正确的是(
)
C
2.下列物质中属于共价化合物的是(
)
A.Na2O2
B.NaHSO4
C.
HNO3
D.I2
3.下列物质中,具有非极性键的离子化合物是(
)
A.H2O2
B.MgF
C.NaOH
D.Na2O2
4.下列叙述正确的是(
)
A.含有共价键的化合物一定是共价化合物
B.在气态单质分子中一定存在共价键
C.在共价化合物中一定存在共价键
D.离子化合物中只含有离子键
C
D
C
5、已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,(1)X、Z两种元素的元素符号:X___、Z___。(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为_____,它的共价键属于____(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为___(3)由X、Y、Z所形成的常见离子化合物是___,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为___;X与W形成的化合物与水反应时,水做_(填“氧化剂”或“还原剂”)。
6、下列各式用电子式表示的物质的形成过程,其中正确的是( )
7、在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是( )
A.N2
B.PCl3
C.BF3
D.CO2
8、AB2离子化合物的阴、阳离子的电子层结构相同,每摩尔AB2中含有54mol电子,根据下列反应:
①H2+B2
―→
C
②B2+X―→Y+AB2+H2O
③Y+C―→AB2+Z,Z有漂白作用
(1)写出下列物质的化学式:
AB2______,X______,Y_____,Z______。
(2)写出反应②的离子方程式______
思考:化学键的定义
化学键:相邻原子(或离子)间强烈的相互作用
化学键分为离子键、共价键和金属键
三、化学反应的实质:
练习:解说H2和N2生成NH3的过程。
第一步:反应物分子中化学键断裂成原子;
第二步:原子间通过新的化学键重新组合成新的分子.
例:H2和Cl2生成HCl
注意:
离子化合物受热熔化时会破坏离子键,
从水溶液中结晶形成离子化合物时会形成离子键;
但这两个过程均属于物理变化.所以破坏化学键不一定发
生化学变化,但化学变化过程中一定有化学键的断裂和新化学键
的形成.
第一步:
第二步:
旧键断裂:H-H、Cl-Cl断裂
新键形成:H-Cl形成
一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
化学反应过程分析
例:H2和Cl2生成HCl
练习1:下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是
A.
NH4Cl==NH3↑+
HCl↑
B.
NH3+CO2+H2O===NH4HCO3
C.
2NaOH+Cl2===NaCl+NaClO+H2O
D.
2Na2O2+2CO2===2Na2CO3+O2
练习2、已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号为:X____、Z____。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为__,它的共价键属于__(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________。
(3)由X、Y、Z所形成的常见离子化合物是(写化学式)__,该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为:____X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:_______。
练习3、A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C
元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。
(1)
A、B、C三元素的名称分别是:A___,B_,C_。
(2)化合物C2A的电子式是___,C2A
与稀硫酸反应的化学方程式是:___C2A
与硫酸铜溶液反应的离子反应方程式是:__
(3)
A元素的气态氢化物通入硫酸铜溶液中反应的离子反应方程式是___。
(4)
化合物BA2的电子式是:______,结构式是:__
练习4、W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为___,X为___,Y为__,Z为___。
(2)是由____键组成的分子,其电子式为__。
(3)由Y、X、W组成的物质中有____键和___键组成的___化合物。
练习5、由A、B元素组成的含4个原子核和42个电子的负二价阳离子中,每1个A的核内质子数比B的核内质子数多8个,试通过计算确定:
(1)A、B元素名称分别为_____和________。
(2)写出该阴离子的离子符号___________。
(3)该阴离子与钠离子形成的化合物中含有____键。
6、0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子;0.4gX的单质与足量盐酸充分反应放出0.02g氢气;X中质子数和中子数相等;Y元素的阴离子结构与氩原子结构相同,它的气氢化物水溶液是强酸。
(1)推断X、Y两种元素的名称及在周期表中的位置。
(2)用电子式表示X、Y形成化合物的过程。
你曾否想过?
1.为什么一百多种元素可形成一千多万种物质?
2.
为什么两个氢原子可以形成氢分子,而两个
氦原子却不能形成氦分子?
3.化合物中原子为什么总是按一定数目相结合?
第三节
化学键
化学键定义和分类
通常把分子或晶体中,相邻原子(或离子)间强烈的相互作用称为化学键。
按原子之间相互作用的方式和强度不同,将化学键又分为离子键、共价键和金属键。
Cl
Na
Na+
电子转移
不稳定
稳定
Cl-
动脑筋想想
在氯化钠晶体中,Na+和Cl-
之间存在哪些作用力?
Na+离子和Cl-离子之间的静电吸引。
阴阳离子的电子与电子、原子核与原子核之间的静电排斥。
离
子
键
定义:
像氯化钠这样阴、阳离子间通过静电作用所形成的化学键叫离子键。
含有离子键的化合物就是离子化合物。
成键粒子:
成键性质:
阴、阳离子
静电作用(静电引力和斥力)
1、活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。
2、
活泼的金属元素和酸根离子形成的盐
3、铵根离子和酸根离子(或活泼非金属元素)形成的盐。
酸根离子:SO42-、NO3-、Cl-等
把NH4+看作是活泼的金属阳离子
离子化合物:含有离子键的化合物。
形成离子键的条件:
离子化合物
在室温下多数以晶体的形式存在,这种由离子键结合而成的晶体一般具有热稳定性较大,硬度较高,密度较大,熔点、沸点较高等特点。
在元素符号周围用“
·
”或“×”来表示原子最外层电子的式子,叫电子式。
H
·
Na·
·Mg
·
原子的电子式:
离子的电子式:
H+
Na+
Mg2+
金属阳离子的电子式就是其离子符号。
非金属阴离子的电子式要标
[
]
、最外层的电子及“
电荷数
”。
(1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。
(2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。
(3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[
]”括起来,并在右上角标出“n·-”电荷字样。
电子式
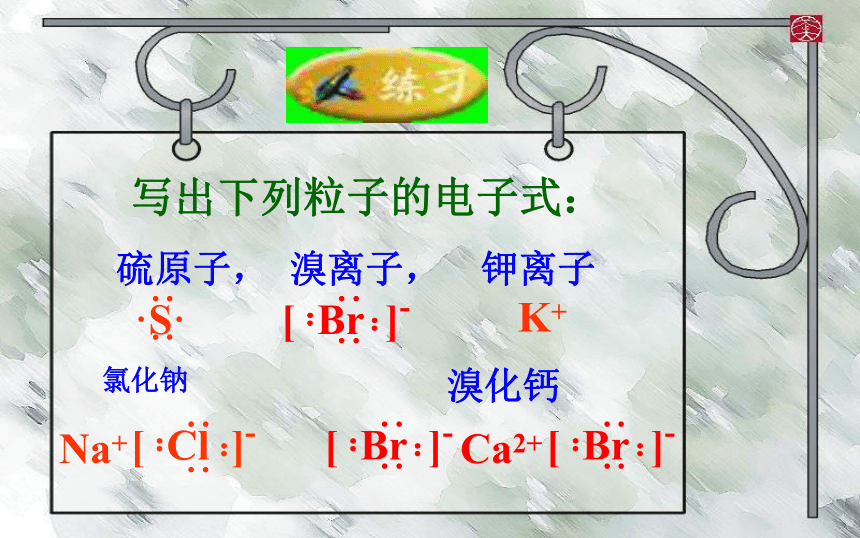
写出下列粒子的电子式:
硫原子,
溴离子,
钾离子
K+
氯化钠
Na+
溴化钙
Ca2+
用
电子式
表示
离子化合物
的
形成过程:
用电子式表示氯化钠、溴化钙的形成过程
Na
·
+
→
Na+
·Ca·
+
+
→
Ca2+
1.离子必须标明电荷数,阴离子必须加[
]。
2.不能把“→”写成“=”。
3.原子可以合并写,离子不能合并写。
+
·Ca·
→
Ca2+
2
⑴
用电子式表示氧化镁的形成过程
·
Mg
·
+
→
Mg2+
⑵
用电子式表示硫化钾的形成过程
2K·
+
→
K+
K+
K·
+
K·
+
K+
→
K+
1、用电子式表示下列物质的
氯化钾、氧化镁、氯化钙、镁原子、氟离子、钠离子、氧化钠、氮化镁
2、用电子式表示下列物质的形成过程
氯化镁、硫化钾
阴阳离子间通过静电作用所形成的化学
键叫做离子键。(成键粒子、成键性质、
成键条件)
含有离子键的化合物一定是离子化合物
区分:
用电子式表示物质
用电子式表示物质形成过程
两个氢原子的电子云
形成氢分子
氢分子的形成:
H
·
氯化氢分子的形成:
·
H
+
→
H
·
+
→
原子间通过共用电子对所形成化学键,叫做共价键。
共用电子对不偏移,成键原子不显电性
共用电子对偏向氯原子,
共价键特点:
共价键特点:
H﹣H(结构式)
H﹣Cl(结构式)
氯原子带部分负电荷,氢原子带部分正电荷。
1、定义:原子间通过共用电子对所形成的化学键叫做共价键。
2、成键微粒:原子
3、相互作用:共用电子对
共价键
[归纳与整理]
1、共价键定义:
2、成键微粒:
3、相互作用:
[复习回忆]
原子间通过共用电子对所形成的化学键,叫做共价键。
原子
共用电子对
4、形成共价键条件:
非金属元素之间化合;Cl2、HCl、H2O
部分金属元素原子与非金属元素原子,如AlCl3
,FeCl3;
5、存在:不仅存在于非金属单质和共价化合物中,也存在于有些离子化合物中
H2
HCl
NaOH
NH4Cl
Na2O2
6、共价化合物:象HCl这样以共用电子对
形成分子的化合物。
思考
哪些粒子能形成共价键?
思考
离子键和共价键的比较
[
]
+
-
离子键
共价键
成键微粒
阴、阳离子
原子
成键本质
静电作用
共用电子对
表示法
以NaCl为例
以为HCl例
成键元素
典型的金属元素、典型的非金属元素之间
同种元素或同类非金属元素之间
HCl的电子式
Cl2的电子式
二、共价键
1.定义:原子间通过共用电子对形成的相互作用
2.表示式
①电子式
②结构式:
如:H-Cl
Cl-Cl
用一根短线表示一对共用电子。其他电子一律省去
1、写出下列物质的电子式和结构式
CH4、NH3、CO2、H2O、O2、N2、HClO
H2O
2
2、用电子式表示下列物质的形成过程
CO2
H2O
O2
共价键的分类
共价键分为非极性共价键和极性共价键。
非极性共价键:相同元素原子之间形成的共价键,由于两个相同原子吸引电子的能力(电负性)相同,共用电子对不偏向任何一方,成键原子不显电性。这样的共价键称之为非极性共价键,简称非极性键。如H2、O2分子中的共价键就是非极性键。
极性共价键:不同元素原子之间形成的共价键,成键原子的电负性不相等,共用电子对会偏向电负性较大的原子一端,使之带部分负电荷,而电负性较小的一端则带部分正电荷,共价键上出现带正电和和带负电荷的两极,这样的共价键称为极性共价键,简称极性键。如HCl、H2O
判断下列物质是离子化合物还是共价化合物,并写出电子式,是共价化合物的并写出结构式
氯化铵、氯化钙、氧化钠、过氧化钠、氢氧化钠、氮气、二氧化碳、三氯化磷、氨气、甲烷、四氯化碳、水、过氧化氢、氟化氢、硫化钠、次氯酸、氯化碘、氧气、氢氧化钙
[思考与交流]
所有的由非金属元素组成的化合物都是共价化合物吗?所有的由金属元素和金属元素组成的化合物都是离子化合物吗?
含有共价键的化合物一定是共价化合物吗?含有共价键的物质一定是共价化合物?
含有离子键的化合物一定是离子化合物?
所有的物质都含有化学键?
1.
下列分子的电子式书写正确的是(
)
C
2.下列物质中属于共价化合物的是(
)
A.Na2O2
B.NaHSO4
C.
HNO3
D.I2
3.下列物质中,具有非极性键的离子化合物是(
)
A.H2O2
B.MgF
C.NaOH
D.Na2O2
4.下列叙述正确的是(
)
A.含有共价键的化合物一定是共价化合物
B.在气态单质分子中一定存在共价键
C.在共价化合物中一定存在共价键
D.离子化合物中只含有离子键
C
D
C
5、已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,(1)X、Z两种元素的元素符号:X___、Z___。(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为_____,它的共价键属于____(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为___(3)由X、Y、Z所形成的常见离子化合物是___,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为___;X与W形成的化合物与水反应时,水做_(填“氧化剂”或“还原剂”)。
6、下列各式用电子式表示的物质的形成过程,其中正确的是( )
7、在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是( )
A.N2
B.PCl3
C.BF3
D.CO2
8、AB2离子化合物的阴、阳离子的电子层结构相同,每摩尔AB2中含有54mol电子,根据下列反应:
①H2+B2
―→
C
②B2+X―→Y+AB2+H2O
③Y+C―→AB2+Z,Z有漂白作用
(1)写出下列物质的化学式:
AB2______,X______,Y_____,Z______。
(2)写出反应②的离子方程式______
思考:化学键的定义
化学键:相邻原子(或离子)间强烈的相互作用
化学键分为离子键、共价键和金属键
三、化学反应的实质:
练习:解说H2和N2生成NH3的过程。
第一步:反应物分子中化学键断裂成原子;
第二步:原子间通过新的化学键重新组合成新的分子.
例:H2和Cl2生成HCl
注意:
离子化合物受热熔化时会破坏离子键,
从水溶液中结晶形成离子化合物时会形成离子键;
但这两个过程均属于物理变化.所以破坏化学键不一定发
生化学变化,但化学变化过程中一定有化学键的断裂和新化学键
的形成.
第一步:
第二步:
旧键断裂:H-H、Cl-Cl断裂
新键形成:H-Cl形成
一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程
化学反应过程分析
例:H2和Cl2生成HCl
练习1:下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是
A.
NH4Cl==NH3↑+
HCl↑
B.
NH3+CO2+H2O===NH4HCO3
C.
2NaOH+Cl2===NaCl+NaClO+H2O
D.
2Na2O2+2CO2===2Na2CO3+O2
练习2、已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号为:X____、Z____。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为__,它的共价键属于__(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________。
(3)由X、Y、Z所形成的常见离子化合物是(写化学式)__,该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为:____X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:_______。
练习3、A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C
元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。
(1)
A、B、C三元素的名称分别是:A___,B_,C_。
(2)化合物C2A的电子式是___,C2A
与稀硫酸反应的化学方程式是:___C2A
与硫酸铜溶液反应的离子反应方程式是:__
(3)
A元素的气态氢化物通入硫酸铜溶液中反应的离子反应方程式是___。
(4)
化合物BA2的电子式是:______,结构式是:__
练习4、W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为___,X为___,Y为__,Z为___。
(2)是由____键组成的分子,其电子式为__。
(3)由Y、X、W组成的物质中有____键和___键组成的___化合物。
练习5、由A、B元素组成的含4个原子核和42个电子的负二价阳离子中,每1个A的核内质子数比B的核内质子数多8个,试通过计算确定:
(1)A、B元素名称分别为_____和________。
(2)写出该阴离子的离子符号___________。
(3)该阴离子与钠离子形成的化合物中含有____键。
6、0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子;0.4gX的单质与足量盐酸充分反应放出0.02g氢气;X中质子数和中子数相等;Y元素的阴离子结构与氩原子结构相同,它的气氢化物水溶液是强酸。
(1)推断X、Y两种元素的名称及在周期表中的位置。
(2)用电子式表示X、Y形成化合物的过程。
