如何正确书写化学方程式
图片预览




文档简介
(共20张PPT)
复习:
2、化学反应前后为什么物质的总质量
会守恒?
1、什么是质量守恒定律?
3、什么叫 化学方程式?
一、书写化学方程式应遵守的原则:
1、必需以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应。
2、要遵守质量守恒定律
课题2
如何正确书写化学方程式
点燃
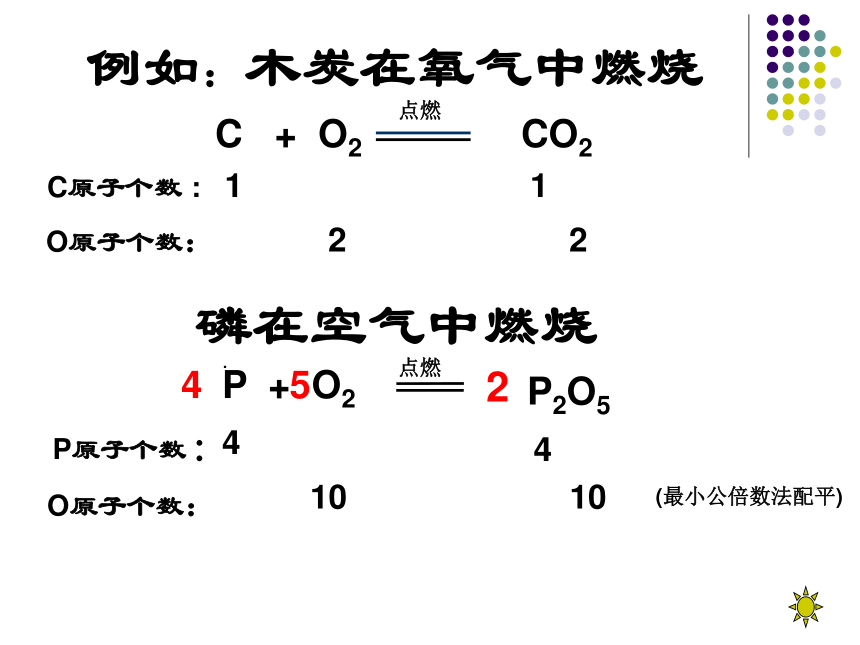
C + O2 CO2
点燃
4
2
例如:木炭在氧气中燃烧
磷在空气中燃烧
.
P + O2 P2O5
C原子个数 : 1 1
O原子个数: 2 2
O原子个数: 2 5
10 10
5
PO2
P2O5
(最小公倍数法配平)
P原子个数:1 2
4
4
二、化学方程式的书写步骤:
一写
左写反应物、右写生成物的化学式,并在反应物、生成物之间画一条短线
二 配
配平化学方程式
三注
注明反应条件,
把短横改等号
生成物的状态,
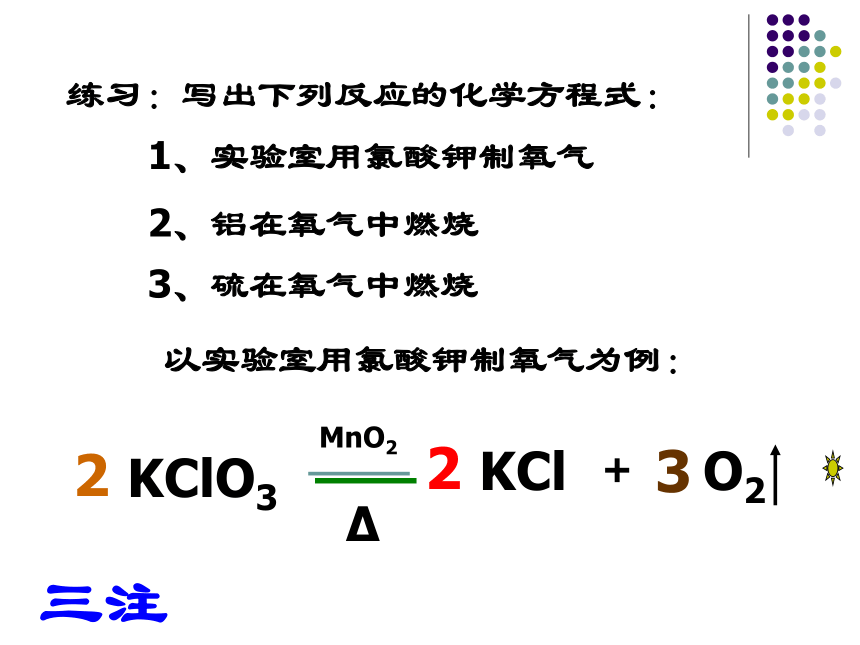
练习:写出下列反应的化学方程式:
1、实验室用氯酸钾制氧气
2、铝在氧气中燃烧
3、硫在氧气中燃烧
KCl
KClO3
+
O2
一写
2
3
2
二配
MnO2
三注
以实验室用氯酸钾制氧气为例:
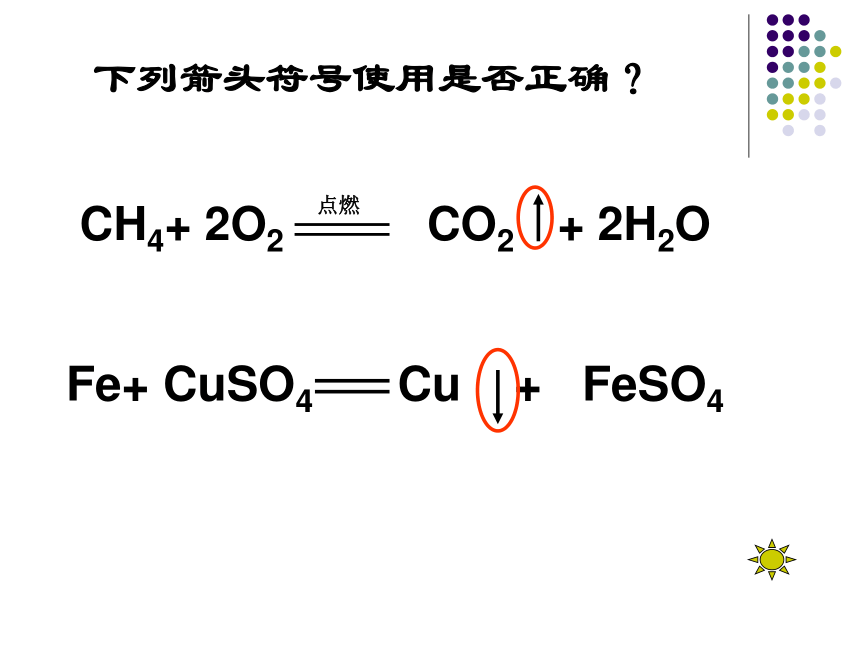
CH4+ 2O2 CO2 + 2H2O
Fe+ CuSO4 Cu + FeSO4
点燃
下列箭头符号使用是否正确?
3. “ ” “ ” 都只能在生成物中出现。
4. 如果生成物只有一种,不写箭头。
5.如果反应物和生成物中都有气体,则生成物中气体不用 “ ”。
6如果反应物和生成物中都有固体,则生成物中固体不用“ ”。
注意:
1.化学式右下角数字不能改动。
2.化学式前化学计量数简化成最简单的 整
数比“1”省略不写。
比一比:看谁发现错误多
下列化学方程式是否正确?若有错误请指正。
1. S + O2 SO2
2. 2Al + 3O2 2Al2O3
3. Mg +O2 MgO2
4. CO2+ Ca(OH)2 CaCO3 + H2O
5. 6Fe + 4O2 2 Fe3O4
6. HgO 2Hg + O2↑
△
点燃
燃烧
点燃
.
△
S + O2 SO2
点燃
4Al + 3O2 2Al2O3
点燃
点燃
2Mg + O2 2 MgO
点燃
3Fe + 2O2 Fe3O4
2HgO 2Hg + O2↑
△
√
KCl
KClO3
O3
+
×
×
下列配平方法是否正确?
KCl
KClO3
O2
+
4
4
6
二、从物质参加反应或生成角度归纳:
1、生成物中有氧气的化学方程式。
2、反应物中氧气参加的化学方程式
一、从化学反应类型的角度归纳:
1、 化合反应
2、 分解反应
,你会归纳吗
比一比:
从生成物中都有氧气的角度归纳
2KClO3——2KCl+3O2
——
MnO2
2KMnO4——K2MnO4+MnO2+O2
——
2H2O ——2H2 + O2
——
通 电
2H2O2——2H2O + O2
——
MnO2
2HgO——2Hg + O2
——
从反应物看:都有氧气参加的角度归纳
2Mg + O2 —— 2MgO
点 燃
——
4P + 5O2 —— 2P2O5
——
点 燃
S + O2 —— SO2
——
点 燃
3 Fe +3O2 —— Fe3O4
点 燃
C + O2 —— CO2
——
点 燃
2H2 + O2 —— 2H2O
点燃
2Cu + O2 —— 2CuO
——
加热
根据信息写出相关化学反应方程式
练习:二氧化碳是常用的灭火剂,但金属镁着火却不能用二氧化碳扑灭,因为镁能在二氧化碳中继续燃烧,生成黑色和白色两种固体粉末。写出该反应的化学方程式。
,
+ C
2Mg + CO2 ——
2 MgO
点燃
练习:
配平下列化学方程式:
Fe + O2 Fe3O4
H2 + N2 NH3
H2O —— H2 + O2
点燃
催化剂
高温、高压
通电
定一法:配平步骤
1、找出方程式里最复杂的化学式,将其化学计量数定为“1”。
2、由该化学式里各元素的原子数确定有关化学式前的化学计量数。
3、如出现分数,则去分母。
练习:配平下列化学方程式
C2H5OH+ O2 —— CO2 + H2O
FeS2 + O2 Fe2O3 + SO2
例 C4H10 + O2 —— 5 H2O + 4 CO2
2C4H10 + 13 O2 —— 10 H2O + 8 CO2
点 燃
13
2
航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)的混合物作固体燃料,加热铝粉使其被氧化,放出大量的热,促使混合物中高氯酸铵受热分解,同时生成四种气体;两种是空气中的主要气体成分,一种气体是氯气(Cl2),还有一种气体是水蒸气,因而产生巨大的推动力,试写出其中涉及的化学方程式:
(1)铝粉被氧气氧化成氧化铝
(2)高氯酸铵受热分解
Al2O3
4
Al + O2 ——
3
2
加热
4
N2 +
O2
NH4ClO4——
H2O + Cl2 +
2
2
根据文中提供的信息写出相关的化学反应方程式
化合反应有:
2Mg + O2 —— 2MgO
点 燃
——
4P + 5O2 —— 2P2O5
——
点 燃
S + O2 —— SO2
——
点 燃
3 Fe +2O2 —— Fe3O4
点 燃
C + O2 —— CO2
——
点 燃
2H2 + O2 —— 2H2O
点燃
2Cu + O2 —— 2CuO
——
加热
分解反应有:
2KClO3——2KCl+3O2
——
MnO2
2KMnO4——K2MnO4+MnO2+O2
——
2H2O —— 2H2 + O2
——
通 电
2H2O2——2H2O + O2
——
MnO2
2HgO——2Hg + O2
——
C u2(OH)2CO3 2CuO+CO2 +H2O
△
最小公倍数法
配平步骤:
1、找出化学方程式两边各出现一次、原子个数不相等、且原子个数相差较大的元素作为配平的起点。
2、求出最小公倍数法。
3、根据最小公倍数推出各化学式的化学计量数。
.
P + O2 P2O5
2
2
5
4
复习:
2、化学反应前后为什么物质的总质量
会守恒?
1、什么是质量守恒定律?
3、什么叫 化学方程式?
一、书写化学方程式应遵守的原则:
1、必需以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应。
2、要遵守质量守恒定律
课题2
如何正确书写化学方程式
点燃
C + O2 CO2
点燃
4
2
例如:木炭在氧气中燃烧
磷在空气中燃烧
.
P + O2 P2O5
C原子个数 : 1 1
O原子个数: 2 2
O原子个数: 2 5
10 10
5
PO2
P2O5
(最小公倍数法配平)
P原子个数:1 2
4
4
二、化学方程式的书写步骤:
一写
左写反应物、右写生成物的化学式,并在反应物、生成物之间画一条短线
二 配
配平化学方程式
三注
注明反应条件,
把短横改等号
生成物的状态,
练习:写出下列反应的化学方程式:
1、实验室用氯酸钾制氧气
2、铝在氧气中燃烧
3、硫在氧气中燃烧
KCl
KClO3
+
O2
一写
2
3
2
二配
MnO2
三注
以实验室用氯酸钾制氧气为例:
CH4+ 2O2 CO2 + 2H2O
Fe+ CuSO4 Cu + FeSO4
点燃
下列箭头符号使用是否正确?
3. “ ” “ ” 都只能在生成物中出现。
4. 如果生成物只有一种,不写箭头。
5.如果反应物和生成物中都有气体,则生成物中气体不用 “ ”。
6如果反应物和生成物中都有固体,则生成物中固体不用“ ”。
注意:
1.化学式右下角数字不能改动。
2.化学式前化学计量数简化成最简单的 整
数比“1”省略不写。
比一比:看谁发现错误多
下列化学方程式是否正确?若有错误请指正。
1. S + O2 SO2
2. 2Al + 3O2 2Al2O3
3. Mg +O2 MgO2
4. CO2+ Ca(OH)2 CaCO3 + H2O
5. 6Fe + 4O2 2 Fe3O4
6. HgO 2Hg + O2↑
△
点燃
燃烧
点燃
.
△
S + O2 SO2
点燃
4Al + 3O2 2Al2O3
点燃
点燃
2Mg + O2 2 MgO
点燃
3Fe + 2O2 Fe3O4
2HgO 2Hg + O2↑
△
√
KCl
KClO3
O3
+
×
×
下列配平方法是否正确?
KCl
KClO3
O2
+
4
4
6
二、从物质参加反应或生成角度归纳:
1、生成物中有氧气的化学方程式。
2、反应物中氧气参加的化学方程式
一、从化学反应类型的角度归纳:
1、 化合反应
2、 分解反应
,你会归纳吗
比一比:
从生成物中都有氧气的角度归纳
2KClO3——2KCl+3O2
——
MnO2
2KMnO4——K2MnO4+MnO2+O2
——
2H2O ——2H2 + O2
——
通 电
2H2O2——2H2O + O2
——
MnO2
2HgO——2Hg + O2
——
从反应物看:都有氧气参加的角度归纳
2Mg + O2 —— 2MgO
点 燃
——
4P + 5O2 —— 2P2O5
——
点 燃
S + O2 —— SO2
——
点 燃
3 Fe +3O2 —— Fe3O4
点 燃
C + O2 —— CO2
——
点 燃
2H2 + O2 —— 2H2O
点燃
2Cu + O2 —— 2CuO
——
加热
根据信息写出相关化学反应方程式
练习:二氧化碳是常用的灭火剂,但金属镁着火却不能用二氧化碳扑灭,因为镁能在二氧化碳中继续燃烧,生成黑色和白色两种固体粉末。写出该反应的化学方程式。
,
+ C
2Mg + CO2 ——
2 MgO
点燃
练习:
配平下列化学方程式:
Fe + O2 Fe3O4
H2 + N2 NH3
H2O —— H2 + O2
点燃
催化剂
高温、高压
通电
定一法:配平步骤
1、找出方程式里最复杂的化学式,将其化学计量数定为“1”。
2、由该化学式里各元素的原子数确定有关化学式前的化学计量数。
3、如出现分数,则去分母。
练习:配平下列化学方程式
C2H5OH+ O2 —— CO2 + H2O
FeS2 + O2 Fe2O3 + SO2
例 C4H10 + O2 —— 5 H2O + 4 CO2
2C4H10 + 13 O2 —— 10 H2O + 8 CO2
点 燃
13
2
航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)的混合物作固体燃料,加热铝粉使其被氧化,放出大量的热,促使混合物中高氯酸铵受热分解,同时生成四种气体;两种是空气中的主要气体成分,一种气体是氯气(Cl2),还有一种气体是水蒸气,因而产生巨大的推动力,试写出其中涉及的化学方程式:
(1)铝粉被氧气氧化成氧化铝
(2)高氯酸铵受热分解
Al2O3
4
Al + O2 ——
3
2
加热
4
N2 +
O2
NH4ClO4——
H2O + Cl2 +
2
2
根据文中提供的信息写出相关的化学反应方程式
化合反应有:
2Mg + O2 —— 2MgO
点 燃
——
4P + 5O2 —— 2P2O5
——
点 燃
S + O2 —— SO2
——
点 燃
3 Fe +2O2 —— Fe3O4
点 燃
C + O2 —— CO2
——
点 燃
2H2 + O2 —— 2H2O
点燃
2Cu + O2 —— 2CuO
——
加热
分解反应有:
2KClO3——2KCl+3O2
——
MnO2
2KMnO4——K2MnO4+MnO2+O2
——
2H2O —— 2H2 + O2
——
通 电
2H2O2——2H2O + O2
——
MnO2
2HgO——2Hg + O2
——
C u2(OH)2CO3 2CuO+CO2 +H2O
△
最小公倍数法
配平步骤:
1、找出化学方程式两边各出现一次、原子个数不相等、且原子个数相差较大的元素作为配平的起点。
2、求出最小公倍数法。
3、根据最小公倍数推出各化学式的化学计量数。
.
P + O2 P2O5
2
2
5
4
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
