鲁科版九年级化学下册第一节 常见的金属材料(共35张PPT)
文档属性
| 名称 | 鲁科版九年级化学下册第一节 常见的金属材料(共35张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-06 08:28:39 | ||
图片预览









文档简介
(共35张PPT)
第一节
常见的金属材料
2.金属有哪些共同的物理性质?
1.金属材料包括纯金属和它们的合金
一、金属的物理性质
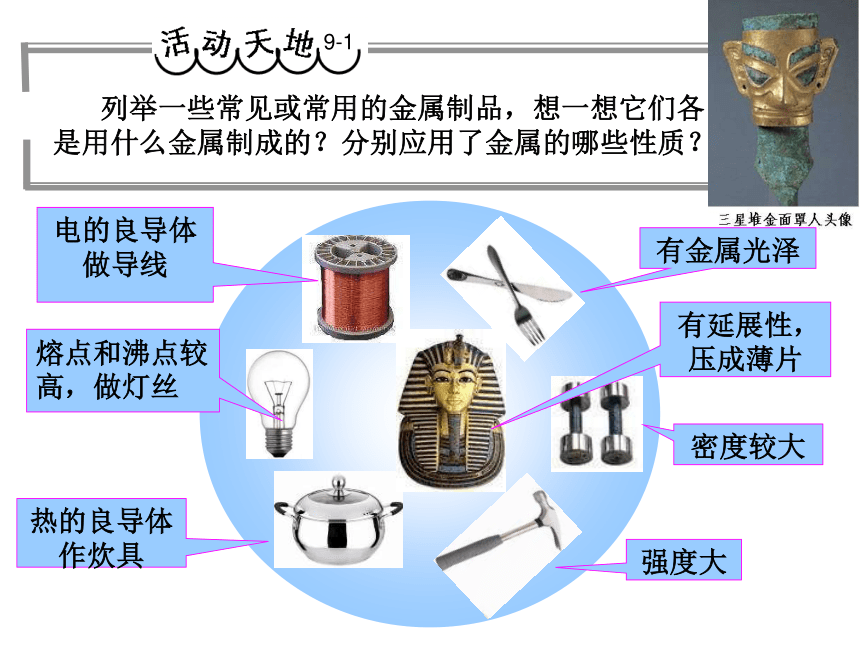
9-1
列举一些常见或常用的金属制品,想一想它们各是用什么金属制成的?分别应用了金属的哪些性质?
电的良导体
做导线
熔点和沸点较高,做灯丝
热的良导体
作炊具
强度大
密度较大
有金属光泽
有延展性,压成薄片
金属的物理性质---共性
具有金属光泽
具有导电性
具有导热性
具有延展性
密度较大
硬度较大
熔点、沸点较高
常温一般为固体
纯金属
金属光泽
状态
密度
硬度
熔点、沸点
导热性
导电性
延展性
金属之最(金属特性)
纯金属
铝
铜
钙
铁
钨
汞
银
金
铬
铂
请同学们回忆学过的知识,结合阅读课本55页,完成以上表格内容。
地壳含量最多的
人类最早利用的
人体中含量最高的
年产量最高的
熔点最高的
硬度最大的
熔点最低的
延性最好的
导电导热性最好
展性最好的
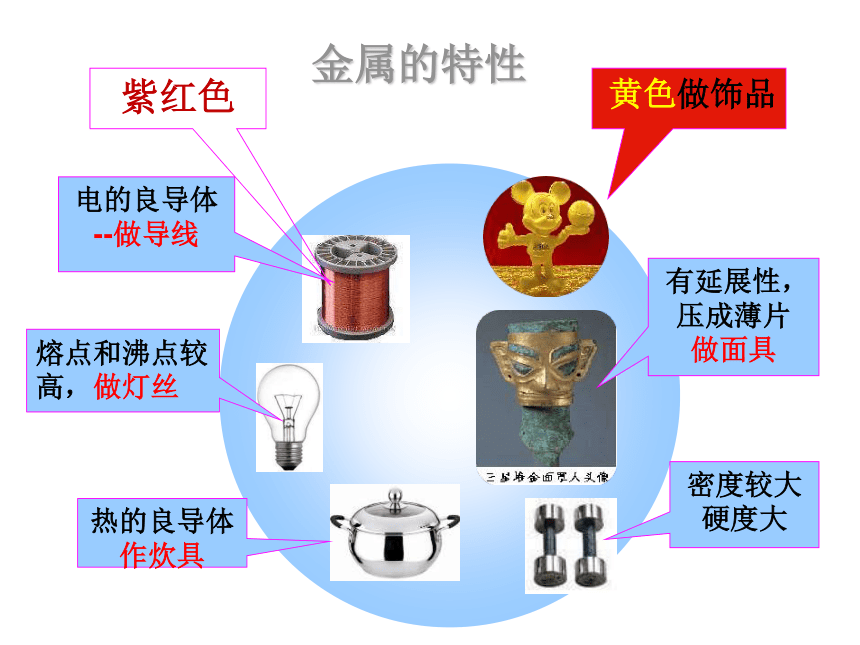
电的良导体
--做导线
熔点和沸点较高,做灯丝
热的良导体
作炊具
密度较大
硬度大
金属的特性
有延展性,压成薄片
做面具
紫红色
黄色做饰品
生活中的化学
以下生活细节,主要是利用了金属的哪些性质?
1.为何铁制锅铲常需要加上木柄或塑料柄?
2.金属铝既可以制作锅碗瓢盆,又可以制成电线。
3.油罐车行驶时,罐内石油振荡产生静电,易发生火灾,因此车尾有一条拖地的铁链。
思考:物质的性质是决定用途的唯一因素吗?
1.我们可以用铅制作食物容器吗?
2.银的导电性比铜好,为什么电线一般用铜制而不用银制?
物质的性质是决定物质用途的主要因素,但不是唯一因素。
生活中的化学
二、合金
合金:
在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的混合物叫合金。
后母戊鼎是中国目前已发现的最重的青铜器。后母戊鼎含铜84.77%、锡11.64%、铅27.9%。充分显示出商代青铜铸造业的生产规模和技术水平。
青铜器时代
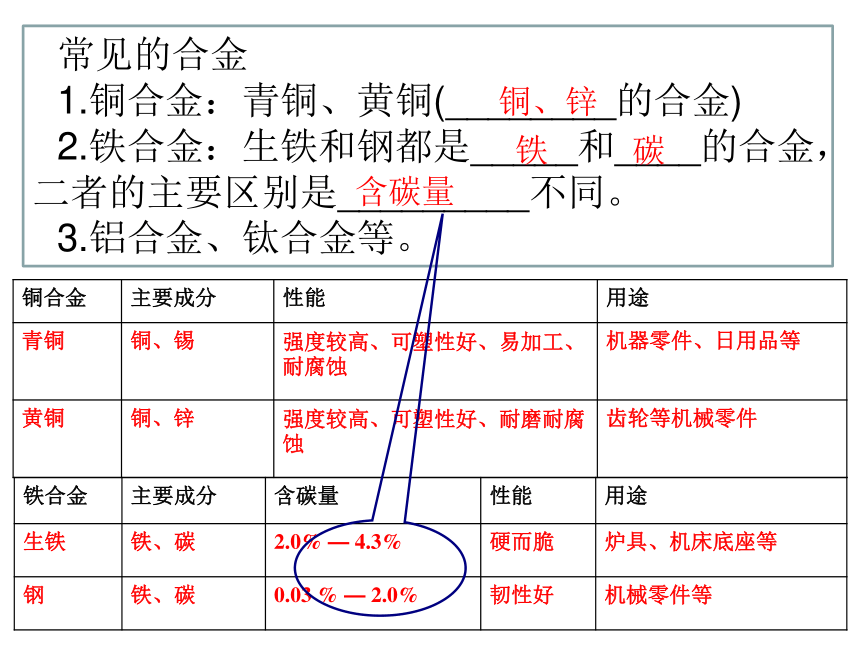
常见的合金
1.铜合金:青铜、黄铜(________的合金)
2.铁合金:生铁和钢都是_____和____的合金,二者的主要区别是_________不同。
3.铝合金、钛合金等。
铜、锌
铁
碳
含碳量
铁合金
主要成分
含碳量
性能
用途
生铁
铁、碳
2.0%
—
4.3%
硬而脆
炉具、机床底座等
钢
铁、碳
0.03
%
—
2.0%
韧性好
机械零件等
铜合金
主要成分
性能
用途
青铜
铜、锡
强度较高、可塑性好、易加工、耐腐蚀
机器零件、日用品等
黄铜
铜、锌
强度较高、可塑性好、耐磨耐腐蚀
齿轮等机械零件
比较生铁和钢的不同:
合金
主要成分
性能
用途
生
铁
铁、碳
(含碳量:
2%~4.3%
)
硬而脆,可铸造但不能锻轧
炉具、炊具、机床底座等
钢
铁、碳
(含碳量:﹤2%)
具有较好的韧性和弹性,可铸造,可锻轧
机器零件、刀具、量具、模具等
探究:合金与纯金属性质比较
合金
探究问题
方案设计
实验现象
实验结论
熔
点
颜色光泽
硬
度
【实验探究】比较黄铜片和铜片、焊锡和锡的光泽和颜色;将它们互相刻划,比较它们的硬度
黄色
紫红色
银白色
青白色
黄铜比铜硬
合金与纯金属有不同的性质:
合金颜色更鲜艳,硬度大
性质
比较
现象
黄铜
铜
焊锡
铅
光泽和颜色
硬度
结论
【实验探究】将绿豆大的焊锡、锡和铅放置在铁片上,加热铁片的中心部分,观察,比较焊锡和组成它的纯金属锡、铅的熔化温度
锡
焊锡
铅
焊锡最先熔化,锡次之,铅最后熔化
合金和组成它的纯金属熔点不同:合金熔点低
资料:锡片熔点232℃,焊锡熔点193℃
现象
结论
结论:合金与纯金属性质比较
合金
合金的熔点比较低
合金的抗腐蚀性强
合金的光泽更好
合金的硬度更大
探究问题
方案设计
实验现象
实验结论
抗腐蚀性
熔
点
颜色光泽
硬
度
学以致用
1.我来造航母
钢
铝合金
钛合金
制造飞机的材料中为什么大量使用铝合金而不用纯铝?
----合金硬度大
2.我来造飞机
3.
人造骨—钛和钛合金
4.用来铸造硬币的合金需要具有什么性质?
资源丰富
无毒轻便
耐磨耐腐蚀
美观、易加工
铝土矿
主要成分Al2O3
钾长石
主要成分KAlSi3O8
明矾石
主要成分KAl3(SO4)2(OH)6
常见的几种铝矿石的成分
铝土矿
钾长石
三、金属矿物及其冶炼合金
矿石的选择:含铁量高,产物对环境无污染
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
活动探究9-1
炼铁高炉示意图
工业炼铁
1.原料:
3.设备:
高炉
2.原理:
实验
探究
实验要求:仔细观察实验顺序,记录实验现象。
实验思考:
1.如何判断反应中生成了什么物质?
2.实验开始时为什么要先通入CO再加热?
3.实验结束后为什么要等玻璃管中的物质冷却后,再停止通入CO?
4.装置中导管末端为什么要加一点燃的酒精灯?你还有什么处理方法?
实验探究
Fe2O3
+
3CO
===
2Fe
+
3CO2
高温
铁Fe
思考1:验证生成物Fe
①用磁铁吸引②加入稀盐酸在,冒出气泡
CO2
思考:
2.实验中要先通入一段时间的CO,再加热Fe2O3。
3.实验结束后要等玻璃管中的物质冷却后,再停止通入CO。
4.在实验过程中要及时点燃一氧化碳,使之燃烧。
防止加热时试管内有空气可能会爆炸。
防止生成的铁再被空气中的氧气氧化。
由于一氧化碳有毒性,散失到空气中会造成空气污染,因此放一点燃的酒精灯,燃烧掉CO,防止污染环境。
还原反应:含氧化合物中的氧被夺去的反应。
CO得氧被氧化,发生氧化反应,作还原剂
Fe2O3失氧被还原,发生还原反应,作氧化剂
3
3
实验中的方程式
A处:Fe2O3
+
3CO
===
2Fe
+
3CO2
高温
A
B
C
B处:Ca(OH)2
+
CO2
===
CaCO3
+
H2O
C处:2CO+
O2
===
2CO2
点燃
尾气CO处理方法:
1.放一点燃的酒精灯点燃处理
2.气球收集
3.用一导管连接到酒精灯处点燃,即处理了尾气,又节约了能源
工业上采用电解铝法冶炼铝,
其反应的化学方程式:
常见的金属材料
一、金属材料:1.纯金属和它的合金
2.金属的共性和特性
二、合金
1.合金的定义
2.合金和纯金属的性质差异
三、金属的冶炼
1、炼铁
①炼铁的反应原理
②炼铁的实验现象
③炼铁的注意事项
④尾气处理的方法
⑤实验中相关的3个方程式
2.电解法炼铝
你说我说
1.大多数金属具有共同的物理性质,如具有____、____
、
_____、______等。
2.大多数金属性质活泼,在自然界中主要以_____的形式存在于各种矿物中。
3.金属材料包括____和____,生活中广泛使用的合金是
,与组成它的纯金属相比它有很多特殊的性质,如
_____、_____、_____等。
4.工业上冶炼铁和铝的主要化学反应原理分别是:
_____________________、______________________。
5.据图回答
(1)反应开始应先
,目的是:
。
(2)A、B两个酒精灯的作用分别是
、
。
(3)玻璃管内的现象是
;澄清石灰水处
的现象为
,证明生成了
。
(4)反应结束,应先
后
,
目的是为了防止
。
1.反应结束时,为什么要先停止加热再停止通入一氧化碳?
2.实验过程中玻璃管内和试管内可能出现什么现象?
3.实验过程中发生了几个化学反应,写出反应的化学方程式?
CO2+Ca(OH)2=CaCO3↓+H2O
第一节
常见的金属材料
2.金属有哪些共同的物理性质?
1.金属材料包括纯金属和它们的合金
一、金属的物理性质
9-1
列举一些常见或常用的金属制品,想一想它们各是用什么金属制成的?分别应用了金属的哪些性质?
电的良导体
做导线
熔点和沸点较高,做灯丝
热的良导体
作炊具
强度大
密度较大
有金属光泽
有延展性,压成薄片
金属的物理性质---共性
具有金属光泽
具有导电性
具有导热性
具有延展性
密度较大
硬度较大
熔点、沸点较高
常温一般为固体
纯金属
金属光泽
状态
密度
硬度
熔点、沸点
导热性
导电性
延展性
金属之最(金属特性)
纯金属
铝
铜
钙
铁
钨
汞
银
金
铬
铂
请同学们回忆学过的知识,结合阅读课本55页,完成以上表格内容。
地壳含量最多的
人类最早利用的
人体中含量最高的
年产量最高的
熔点最高的
硬度最大的
熔点最低的
延性最好的
导电导热性最好
展性最好的
电的良导体
--做导线
熔点和沸点较高,做灯丝
热的良导体
作炊具
密度较大
硬度大
金属的特性
有延展性,压成薄片
做面具
紫红色
黄色做饰品
生活中的化学
以下生活细节,主要是利用了金属的哪些性质?
1.为何铁制锅铲常需要加上木柄或塑料柄?
2.金属铝既可以制作锅碗瓢盆,又可以制成电线。
3.油罐车行驶时,罐内石油振荡产生静电,易发生火灾,因此车尾有一条拖地的铁链。
思考:物质的性质是决定用途的唯一因素吗?
1.我们可以用铅制作食物容器吗?
2.银的导电性比铜好,为什么电线一般用铜制而不用银制?
物质的性质是决定物质用途的主要因素,但不是唯一因素。
生活中的化学
二、合金
合金:
在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的混合物叫合金。
后母戊鼎是中国目前已发现的最重的青铜器。后母戊鼎含铜84.77%、锡11.64%、铅27.9%。充分显示出商代青铜铸造业的生产规模和技术水平。
青铜器时代
常见的合金
1.铜合金:青铜、黄铜(________的合金)
2.铁合金:生铁和钢都是_____和____的合金,二者的主要区别是_________不同。
3.铝合金、钛合金等。
铜、锌
铁
碳
含碳量
铁合金
主要成分
含碳量
性能
用途
生铁
铁、碳
2.0%
—
4.3%
硬而脆
炉具、机床底座等
钢
铁、碳
0.03
%
—
2.0%
韧性好
机械零件等
铜合金
主要成分
性能
用途
青铜
铜、锡
强度较高、可塑性好、易加工、耐腐蚀
机器零件、日用品等
黄铜
铜、锌
强度较高、可塑性好、耐磨耐腐蚀
齿轮等机械零件
比较生铁和钢的不同:
合金
主要成分
性能
用途
生
铁
铁、碳
(含碳量:
2%~4.3%
)
硬而脆,可铸造但不能锻轧
炉具、炊具、机床底座等
钢
铁、碳
(含碳量:﹤2%)
具有较好的韧性和弹性,可铸造,可锻轧
机器零件、刀具、量具、模具等
探究:合金与纯金属性质比较
合金
探究问题
方案设计
实验现象
实验结论
熔
点
颜色光泽
硬
度
【实验探究】比较黄铜片和铜片、焊锡和锡的光泽和颜色;将它们互相刻划,比较它们的硬度
黄色
紫红色
银白色
青白色
黄铜比铜硬
合金与纯金属有不同的性质:
合金颜色更鲜艳,硬度大
性质
比较
现象
黄铜
铜
焊锡
铅
光泽和颜色
硬度
结论
【实验探究】将绿豆大的焊锡、锡和铅放置在铁片上,加热铁片的中心部分,观察,比较焊锡和组成它的纯金属锡、铅的熔化温度
锡
焊锡
铅
焊锡最先熔化,锡次之,铅最后熔化
合金和组成它的纯金属熔点不同:合金熔点低
资料:锡片熔点232℃,焊锡熔点193℃
现象
结论
结论:合金与纯金属性质比较
合金
合金的熔点比较低
合金的抗腐蚀性强
合金的光泽更好
合金的硬度更大
探究问题
方案设计
实验现象
实验结论
抗腐蚀性
熔
点
颜色光泽
硬
度
学以致用
1.我来造航母
钢
铝合金
钛合金
制造飞机的材料中为什么大量使用铝合金而不用纯铝?
----合金硬度大
2.我来造飞机
3.
人造骨—钛和钛合金
4.用来铸造硬币的合金需要具有什么性质?
资源丰富
无毒轻便
耐磨耐腐蚀
美观、易加工
铝土矿
主要成分Al2O3
钾长石
主要成分KAlSi3O8
明矾石
主要成分KAl3(SO4)2(OH)6
常见的几种铝矿石的成分
铝土矿
钾长石
三、金属矿物及其冶炼合金
矿石的选择:含铁量高,产物对环境无污染
铁矿石是怎样炼成铁的呢?让我们通过实验来研究铁冶炼的化学原理。
活动探究9-1
炼铁高炉示意图
工业炼铁
1.原料:
3.设备:
高炉
2.原理:
实验
探究
实验要求:仔细观察实验顺序,记录实验现象。
实验思考:
1.如何判断反应中生成了什么物质?
2.实验开始时为什么要先通入CO再加热?
3.实验结束后为什么要等玻璃管中的物质冷却后,再停止通入CO?
4.装置中导管末端为什么要加一点燃的酒精灯?你还有什么处理方法?
实验探究
Fe2O3
+
3CO
===
2Fe
+
3CO2
高温
铁Fe
思考1:验证生成物Fe
①用磁铁吸引②加入稀盐酸在,冒出气泡
CO2
思考:
2.实验中要先通入一段时间的CO,再加热Fe2O3。
3.实验结束后要等玻璃管中的物质冷却后,再停止通入CO。
4.在实验过程中要及时点燃一氧化碳,使之燃烧。
防止加热时试管内有空气可能会爆炸。
防止生成的铁再被空气中的氧气氧化。
由于一氧化碳有毒性,散失到空气中会造成空气污染,因此放一点燃的酒精灯,燃烧掉CO,防止污染环境。
还原反应:含氧化合物中的氧被夺去的反应。
CO得氧被氧化,发生氧化反应,作还原剂
Fe2O3失氧被还原,发生还原反应,作氧化剂
3
3
实验中的方程式
A处:Fe2O3
+
3CO
===
2Fe
+
3CO2
高温
A
B
C
B处:Ca(OH)2
+
CO2
===
CaCO3
+
H2O
C处:2CO+
O2
===
2CO2
点燃
尾气CO处理方法:
1.放一点燃的酒精灯点燃处理
2.气球收集
3.用一导管连接到酒精灯处点燃,即处理了尾气,又节约了能源
工业上采用电解铝法冶炼铝,
其反应的化学方程式:
常见的金属材料
一、金属材料:1.纯金属和它的合金
2.金属的共性和特性
二、合金
1.合金的定义
2.合金和纯金属的性质差异
三、金属的冶炼
1、炼铁
①炼铁的反应原理
②炼铁的实验现象
③炼铁的注意事项
④尾气处理的方法
⑤实验中相关的3个方程式
2.电解法炼铝
你说我说
1.大多数金属具有共同的物理性质,如具有____、____
、
_____、______等。
2.大多数金属性质活泼,在自然界中主要以_____的形式存在于各种矿物中。
3.金属材料包括____和____,生活中广泛使用的合金是
,与组成它的纯金属相比它有很多特殊的性质,如
_____、_____、_____等。
4.工业上冶炼铁和铝的主要化学反应原理分别是:
_____________________、______________________。
5.据图回答
(1)反应开始应先
,目的是:
。
(2)A、B两个酒精灯的作用分别是
、
。
(3)玻璃管内的现象是
;澄清石灰水处
的现象为
,证明生成了
。
(4)反应结束,应先
后
,
目的是为了防止
。
1.反应结束时,为什么要先停止加热再停止通入一氧化碳?
2.实验过程中玻璃管内和试管内可能出现什么现象?
3.实验过程中发生了几个化学反应,写出反应的化学方程式?
CO2+Ca(OH)2=CaCO3↓+H2O
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
