化学反应的方向(zjp定稿)
文档属性
| 名称 | 化学反应的方向(zjp定稿) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-05-30 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
第二单元 化学反应的方向和限度
自发过程:在一定条件下,不需要外力
作用就能自动进行的过程。
非自发过程:在一定条件下,需持续借助
外力作用才能进行的过程。
特点:具有一定的方向性
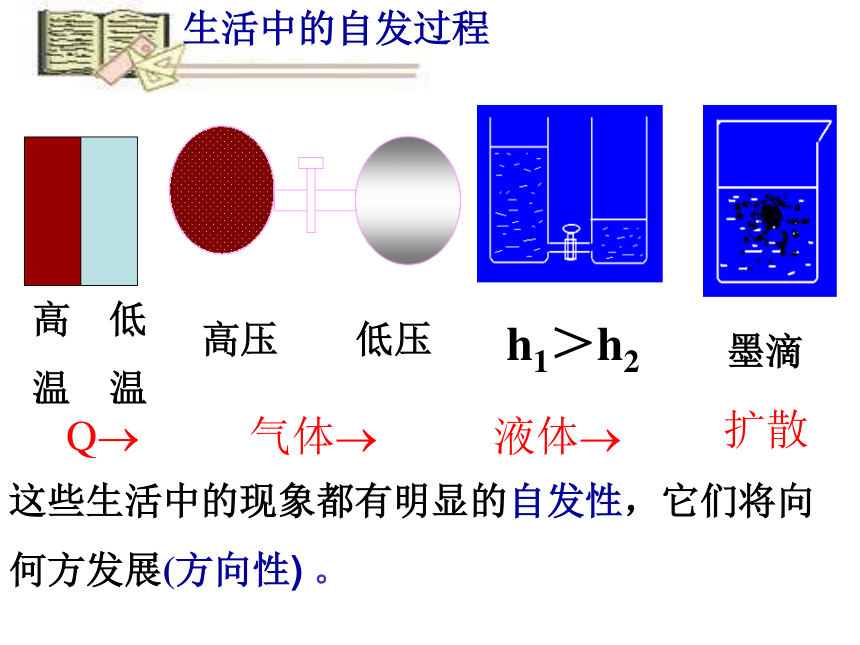
你能举出一些生活中常见的自发过程吗?
这些生活中的现象都有明显的自发性,它们将向何方发展(方向性) 。
Q
气体
液体
扩散
生活中的自发过程
高 低
温 温
高压 低压
h1>h2
墨滴
一、自发反应
在一定温度和压强下,无需外界帮助就能自动进行的反应。
注意:(1)外界帮助如通电等。
(2)自发反应在恰当条件下才能实现
1.水分解生成氢气和氧气的反应
2.氯气与溴化钾溶液的反应
3.乙烯与溴单质的反应
4.氮气和氧气生成一氧化氮的反应
不能
能
不能
能
Cl2+2KBr=Br2+2KCl
下列反应在室温下能否自发进行?如能,写出相应的化学方程式
试试看
CH2=CH2 + Br2 → CH2BrCH2Br
1. C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)
△H = - 2217.5 kJ/mol
2. 2Na(s)+Cl2=2NaCl(s) △H = - 822 kJ/mol
3. 4Fe(s)+3O2(g)=2Fe2O3(s) △H = - 1648.4kJ/mol
4. H2(g)+F2(g)=2HF(g) △H = -546.6kJ/mol
下列反应在一定条件下能够自发进行,它们有哪些共同特点?
共同特点:△H<0,即体系趋向于从高能量状态转变为低能量状态
你知道吗?
化学反应方向的判断依据:
1、根据焓变(能量)判断→焓(能量)判据
活动与探究
操作要点:
1、将盛NH4Cl晶体和Ba(OH)2·8H2O晶体的纸包打开,分别倒入塑料袋底部的两个角中
2、系上袋口,再将两固体充分混合
问题 ⑴ 该反应是吸热反应还是放热反应?
⑵ 该反应能自发进行的可能原因是什么?
下列变化过程都是吸热的,能否自发进行?
NH4NO3(s) = NH4+ (aq) + NO3- (aq)
CaCO3(s) == CaO(s) + CO2(g)
高温
交流与讨论
思考:那是什么因素促使吸热反应也能自发进行呢?
有序
无序(混乱)
一盒火柴散落在地上,火柴头总是趋向于混乱排列。
化学反应方向的判断依据:
1、根据焓变(能量)判断→焓(能量)判据
化学反应趋向于由有序状态转变为无序状态,即混乱度增加( △S>0)。且△S越大,越有利于反应自发进行。
2、熵判据——
1. 判断下列过程的熵变大于零还是小于零
1) H2O(s)→H2O(l)→H2O(g)
2) 2NaHCO3(s) = Na2CO3(s) + CO2(g)+H2O(l)
3) NaOH(s)=Na+(aq)+OH-(aq)
4) N2(g)+3H2(g) 2NH3(g)
△S>0
△S>0
△S>0
△S<0
问题解决
下列变化过程都是吸热的,能自发进行的原因?
NH4NO3(s) = NH4+ (aq) + NO3- (aq)
CaCO3(s) == CaO(s) + CO2(g)
高温
问题反思
影响因素:
化学反应的方向
反应焓变
反应熵变
共同影响
吸热
放热
熵增
熵减
焓减小、熵增大有利于反应自发
总 结
能量判据
熵判据
1 . Mg(s) + 2HCl(aq) = MgCl2(aq) + H2(g)
2. 2CO(g) = 2C(s) + O2(g)
3. NH3(g) + HCl(g) = NH4Cl(s)
4. NH4Cl(s) = NH3(g) + HCl(g)
思考与讨论
△H <0 △S >0
判断下列反应在什么条件下能够自发进行
一定能自发
△H >0 △S <0
一定不能自发
△H <0 △S <0
△H >0 △S >0
低温能自发
较高温能自发
2 .按要求填空
(1)A(g) + B(aq) = C(g) + D(g)
已知: △H <0 ,试判断该反应______自发
P45 第2题
问题解决
(2)2A + B (g) = 2C (g) 已知该反应在一定条件下能自发进行,则△H____0 ,△S____0
(S)
(g)
(3) B = C + D已知该反应一定不能自发进行,试确定物质B、C、D的聚集状态
b c d
谢谢大家
第二单元 化学反应的方向和限度
自发过程:在一定条件下,不需要外力
作用就能自动进行的过程。
非自发过程:在一定条件下,需持续借助
外力作用才能进行的过程。
特点:具有一定的方向性
你能举出一些生活中常见的自发过程吗?
这些生活中的现象都有明显的自发性,它们将向何方发展(方向性) 。
Q
气体
液体
扩散
生活中的自发过程
高 低
温 温
高压 低压
h1>h2
墨滴
一、自发反应
在一定温度和压强下,无需外界帮助就能自动进行的反应。
注意:(1)外界帮助如通电等。
(2)自发反应在恰当条件下才能实现
1.水分解生成氢气和氧气的反应
2.氯气与溴化钾溶液的反应
3.乙烯与溴单质的反应
4.氮气和氧气生成一氧化氮的反应
不能
能
不能
能
Cl2+2KBr=Br2+2KCl
下列反应在室温下能否自发进行?如能,写出相应的化学方程式
试试看
CH2=CH2 + Br2 → CH2BrCH2Br
1. C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)
△H = - 2217.5 kJ/mol
2. 2Na(s)+Cl2=2NaCl(s) △H = - 822 kJ/mol
3. 4Fe(s)+3O2(g)=2Fe2O3(s) △H = - 1648.4kJ/mol
4. H2(g)+F2(g)=2HF(g) △H = -546.6kJ/mol
下列反应在一定条件下能够自发进行,它们有哪些共同特点?
共同特点:△H<0,即体系趋向于从高能量状态转变为低能量状态
你知道吗?
化学反应方向的判断依据:
1、根据焓变(能量)判断→焓(能量)判据
活动与探究
操作要点:
1、将盛NH4Cl晶体和Ba(OH)2·8H2O晶体的纸包打开,分别倒入塑料袋底部的两个角中
2、系上袋口,再将两固体充分混合
问题 ⑴ 该反应是吸热反应还是放热反应?
⑵ 该反应能自发进行的可能原因是什么?
下列变化过程都是吸热的,能否自发进行?
NH4NO3(s) = NH4+ (aq) + NO3- (aq)
CaCO3(s) == CaO(s) + CO2(g)
高温
交流与讨论
思考:那是什么因素促使吸热反应也能自发进行呢?
有序
无序(混乱)
一盒火柴散落在地上,火柴头总是趋向于混乱排列。
化学反应方向的判断依据:
1、根据焓变(能量)判断→焓(能量)判据
化学反应趋向于由有序状态转变为无序状态,即混乱度增加( △S>0)。且△S越大,越有利于反应自发进行。
2、熵判据——
1. 判断下列过程的熵变大于零还是小于零
1) H2O(s)→H2O(l)→H2O(g)
2) 2NaHCO3(s) = Na2CO3(s) + CO2(g)+H2O(l)
3) NaOH(s)=Na+(aq)+OH-(aq)
4) N2(g)+3H2(g) 2NH3(g)
△S>0
△S>0
△S>0
△S<0
问题解决
下列变化过程都是吸热的,能自发进行的原因?
NH4NO3(s) = NH4+ (aq) + NO3- (aq)
CaCO3(s) == CaO(s) + CO2(g)
高温
问题反思
影响因素:
化学反应的方向
反应焓变
反应熵变
共同影响
吸热
放热
熵增
熵减
焓减小、熵增大有利于反应自发
总 结
能量判据
熵判据
1 . Mg(s) + 2HCl(aq) = MgCl2(aq) + H2(g)
2. 2CO(g) = 2C(s) + O2(g)
3. NH3(g) + HCl(g) = NH4Cl(s)
4. NH4Cl(s) = NH3(g) + HCl(g)
思考与讨论
△H <0 △S >0
判断下列反应在什么条件下能够自发进行
一定能自发
△H >0 △S <0
一定不能自发
△H <0 △S <0
△H >0 △S >0
低温能自发
较高温能自发
2 .按要求填空
(1)A(g) + B(aq) = C(g) + D(g)
已知: △H <0 ,试判断该反应______自发
P45 第2题
问题解决
(2)2A + B (g) = 2C (g) 已知该反应在一定条件下能自发进行,则△H____0 ,△S____0
(S)
(g)
(3) B = C + D已知该反应一定不能自发进行,试确定物质B、C、D的聚集状态
b c d
谢谢大家
