1-3水是常用的溶剂
图片预览











文档简介
(共55张PPT)
1、写出下列过程中所涉及到的物态变化名称和吸、放热情况。
①太阳出雾气散,___、___。②霜的形成,___、___。③烧红的铁条插入水中,冒出的一股“白气”的形成,___、__。
2、想出三个办法使湿衣服快一点干?并说出相关理由。
_________、_________、________。
3、举出二个“给物体加热但物体温度并没有升高”的例子。
①____________,②______________。
4、水的密度是__千克/米3,读作___,3毫升水质量__克。
5、把一盒水放入冰箱冷冻
室里,绘出盒内水或冰的
温度变化大致曲线.
时间
温度
复习
第三节
水是常用的溶剂
海水
河水
湖水
自来水
这些澄清透明的天然水,
是不是纯净水?
天然水,如海水、河水、溪水、井水等,都不是纯净的水,而是含有许多溶解性物质和非溶解性物质的极其复杂的混合物。
纯净物:只由一种物质组成的物质。
混合物:由两种或两种以上物质组成
的物质。
纯净物与混合物
定义:
在混合物中,各种物质都保持各自原来的性质。是可以通过各种方法分离出来的。
溪 水
各种饮料
水溶液
水是一种良好的溶剂,它能溶解各种固态的、液态的和气态的物质。
活动
2、将深紫色的高锰酸钾晶体加入水中,你发现_____。
1、把一药匙蔗糖放入一杯水中,你发现___________。
组成蔗糖的蔗糖分子或组成高锰酸钾的微粒(钾离子和高锰酸根离子)均匀地分散到水分子中间,形成均一 、稳定的液体。
由一种或一种以上的物质分
散到另一种液体物质里,形成的
均一、稳定的混合物,叫做溶液。
现象:
高锰酸钾不见了,得到紫红色液体。
蔗糖不见了,得到无色液体。
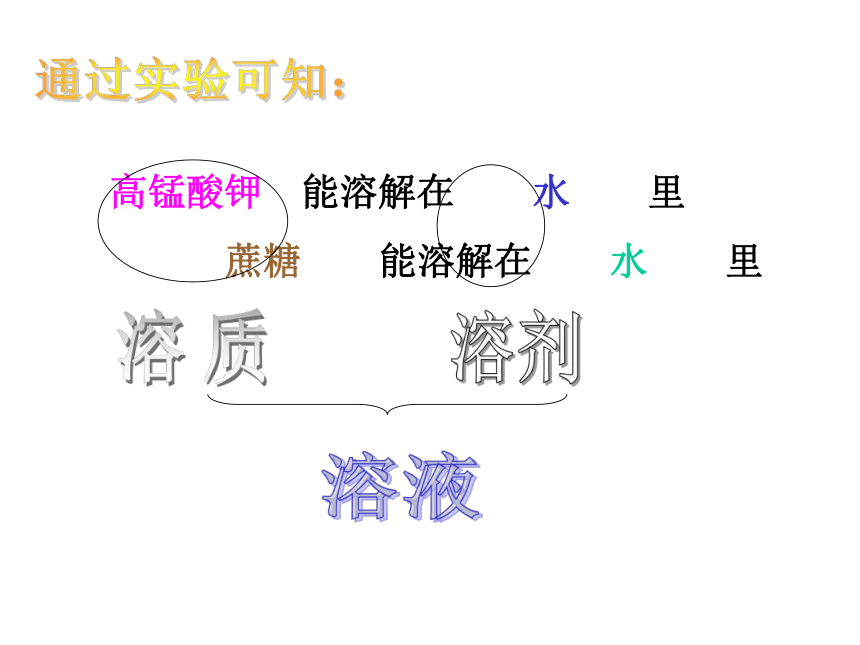
高锰酸钾 能溶解在 水 里
蔗糖 能溶解在 水 里
被溶解的物质
能溶解其他物质的物质
溶质在溶剂中溶解后得到的混合物
2、溶质质量 + 溶剂质量 = 溶液质量
1、溶质
溶剂
溶液
你认为在溶液中这三者的质量存在什么样的关系吗?
3、读作:“溶质”的“溶剂”溶液
泉水中溶入了矿物质、氧气、二氧化碳,那么,其中的溶质是什么 溶剂是什么
溶质(固体、液体、气体)
固体:蔗糖、高锰酸钾、盐、碘等。
液体:酒精、煤油等。
气体:二氧化碳、氧气等。
溶剂(液体)
水、酒精等。
1、理解溶液定义中所包含的三层意义:
第一,均一和稳定是溶液的特征。
第二,分散两字体现溶液的形成。
第三,溶液是混合物。
2、溶质和溶剂是相对而言的:
除了水以外酒精、汽油等也是常用的溶剂。
⑴一般把形成溶液的液态物质叫做溶剂,非液态物质叫做溶质。
如5﹪酒精与水的溶液中,水是溶剂,酒精是溶质。
⑶通常不指明溶剂的溶液,一般指的是水溶液。
氢氧化钠溶液中,溶质是氢氧化钠,溶剂是水。
⑵溶质和溶剂都是液态时,量多的是溶剂。(但如果其中一种是水,则不论多少,都是水做溶剂)
【例1】指出汽水、碘酒、36度的白酒这三种溶
液中的溶质、溶剂。
在汽水中,二氧化碳是溶质,水是溶剂。
在碘酒中,碘是溶质,酒精是溶剂。
在白酒中,酒精是溶质,水是溶剂。
鱼可以在水中呼吸,说明水中溶解了什么
物质?它是溶质吗?
思考
溶液
组成
溶质
溶剂
特征
均一
稳定
小结
活动
取用固体小颗粒状药品一般用药匙。
取用固体块状药品一般用镊子。
取用固体粉末状药品一般用纸槽。
操作:
把试管横放,
将药品送到试管底部,
再把试管缓缓竖起。
把容器横放,把药品或金属颗粒放入
容器口以后,再把容器慢慢地竖立起
来,使药品或金属颗粒缓缓地滑到容
器的底部,以免打破容器。
粉状固体
块状固体
1.溶液是一种_________ 、_________的混合物。
2.溶液是由溶质和溶剂组成,指出下列溶液的溶质和溶剂:
(1)“茅台”白酒:溶质是_______,溶剂是_________。
(2)生理盐水:溶质是_________,溶剂是_________。
(3)碘酒:溶质是__________,溶剂是_________。
(4)高锰酸钾溶液:溶质是_________,溶剂是________。
A.食盐 B.蒸馏水 C.酒精 D.天然水
3.下列物质属于混合物的是 ( )
课堂练习
4、下列叙述中正确的是……………… ( )
A 凡是无色透明的液体都是溶液
B 溶液的体积等于溶质和溶剂体积之和
C 溶液是均一、稳定、无色透明的混合物
D 只要条件不变,糖水中的糖不会分离出来
课堂练习
5、下列物质属于溶液的是………………( )
A纯牛奶 B白醋 C粒粒橙 D冰水
D
B
比较不同物质在水中的溶解能力
蔗 糖
在20ml水中大约能溶解7g食盐.
在20ml水中大约能溶解38g蔗糖.
一般地,不同溶质在同一种溶剂里的溶解能力不同;
同种溶质在不同溶剂里的溶解能力也是不同的。
可见:一种物质溶解在另一种物质里的能力大小主要是由溶质和溶剂的性质决定的
蔗糖的溶解能力比食盐的溶解能力强
【思考】在一定的条件下,溶质是否
可以无限地溶解在一定量的溶剂里呢?
【实验演示】蔗糖的溶解
现象:得到蔗糖的溶液,到一定时候蔗糖不再溶解。
饱和溶液和不饱和溶液
这说明了什么?
结论:说明在一定的条件下,溶质不能无限地溶解在溶剂里。
(一定量的溶剂中,一定的温度下)
1、 饱和溶液:
在一定温度下,在一定量的溶剂里,不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液。
2、 不饱和溶液:
在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液。
4、 加少量的溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。
2、温度稍有降低,如果就会有一些溶质析出,表明原溶液是饱和的。
3、如果溶剂稍有蒸发,溶质就会有析出,表明原溶液是饱和的。
【思考、讨论】
怎样判断一种溶液是不是饱和溶液?
1. 如果溶液中有少量未溶的溶质,则是饱和溶液;
饱和溶液和不饱和溶液的转化
1、饱和溶液和转化成不饱和溶液
(1)加入溶剂
(2)改变温度
2、不饱和溶液和饱和溶液的转化
(1)蒸发溶剂
(2)改变温度
(3)加入溶质
『回顾』不同溶质在同种溶剂中的溶解
能力是不一样。
『讨论』怎样定量比较物质的溶解能力呢?
定标准;
标准里应该含有哪些物理量呢?从哪些
方面考虑?
从影响物质溶解能力的因素考虑。
定溶剂的量、定温度、定状态
溶解度
1、用溶解度来表示物质的溶解能力,即:在一定的温度下,在100 克溶剂里达到饱和状态时所溶解某物质的质量(克)为该物质在这种溶剂里的溶解度。
注意点:
(1)理解这个概念,抓住四个词:一定的温度、100克溶剂(一般为水)、达到饱和、溶解的质量(单位为克)
(2)溶解度值越大,表明该温度下,物质的溶解能力越强.
练习:20℃时,硝酸钾的溶解度为31.6g,这句话的含义是什么?
温度 溶质质量 溶剂质量 饱和溶液质量
20℃
31.6g
100g
(100+31.6)g
★20℃时100g水里最多溶解硝酸钾31.6g或20 ℃时100g水里溶解31.6g硝酸钾达到饱和
如何比较
氯化钠、硝酸钾的溶解性大小?
(1)为什么要求水温相同?用一杯冷水和一杯热水分别溶解氯化钠和硝酸钾,行不行?
(2)为什么要求水的体积相同?用一杯水和一盆水分别溶解,行不行?
(3)为什么要达到饱和状态?100克水能溶解1克氯化钠也能溶解1克硝酸钾,能否说明氯化钠、硝酸钾的溶解性相同?
1.“20℃时,硝酸钾的溶解度是31.6克”.
这句话的含义是
此时,饱和溶液 克,
溶质 克, 溶剂 克,
2.20℃时,100克水中最多能溶解0.165克氢
氧化钙,则20℃时氢氧化钙的溶解度是
20℃时,在100克水中达到饱和状态时,溶解硝酸钾的质量是31.6克。
131.6
31.6
100
0.165克
判断是非:
(1)20℃时,10克食盐溶解在100克水中,所以20℃时食盐的溶解度是10克。
(2)100克水中溶解了36克食盐刚好达到饱和,所以食盐的溶解度是36克。
(3)在20℃时,100克水里最多溶解33.3克氯化铵,则20℃氯化铵的溶解度是33.3。
(4)在20℃时,100克硝酸钾饱和溶液里含硝酸钾24克,则20℃硝酸钾的溶解度是24克。
(5)在30℃时,100克水中加入40克氯化钾后达到饱和溶液,则30℃时氯化钾的溶解度是40克。
.
.
.
.
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
169
202
246
2、溶解度的表示方法:
(1)列表法:
(2)溶解度曲线
以温度为横坐标,溶解度为纵坐标,形象地表示出物质的溶解度随温度变化情况的曲线。
不同的物质溶解度受温度的影响是不同的。
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
(1)曲线上每个点表示某温度下某溶质的溶解度
(2)曲线表示物质的溶解度受温度变化影响大小的情况
(3)两条曲线的交点,表示在该温度下两种物质的溶解度相等
(4)曲线上每个点所配制的溶液是该温度下这种溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液。
溶解度曲线的意义
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
溶解度/
g
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
温度/℃
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
熟石灰的溶解度曲线:
讨论:
固体物质溶解度受温度变化影响情况:
大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。
少数固体物质溶解度受温度影响不大, 例如食盐。
极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
固体的溶解度曲线:
1、横坐标60,纵坐标110 的A点表示什么意义?
练习:
2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。
47g
44g
60g
A.
B.
3、B点表示什么意思?
表示在该点所示的温度(68 ℃ )时,硝酸钠和硝酸钾两种物质的溶解度相等(134克)。
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
固体的溶解度曲线:
68
134g
小于
B.
4、在40℃时,硝酸钾的溶解度____ (填大于、小于)硝酸钠的溶解度。
练习:
3、在___℃时硝酸钾和硝酸钠的溶解度相同,都约为______。
5、在80℃时氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序是_____________________________。
氯化铵、氯化钾、氯化钠、硼酸
甲
乙
丙
B
温度(℃)
溶解度
(g)
T1 T2
(1)T2时,溶解度最大的是________;
(2)B点代表的含义是
_______________________
_______________;
(3)T1时的甲溶液升温到T2,甲溶液变成
_______________.
甲
T1℃时,甲、丙两种物质
的溶解度相等
不饱和溶液
活动
比较不同物质在溶解过程中的能量变化
实验表明,在溶质溶解于水的过程中都伴随着能量的变化,有些有明显的放热或吸热现象,有些则温度变化不明显。
人们利用某些物质在溶于水的过程中会放出大量的热的性质,为野外工作者设计了方便、安全的自热罐头;反之,人们用硝酸铵制作冰袋。
应用——自热罐头和冰袋
浊液
黄河水中含有很多泥沙,水的颜色发黄,黄河由此得名。黄河水素有“一碗水,半碗泥”的说法。这是一种典型的悬浊液。
编号 1 2 3 4
实验
内容 泥土
水 熟石灰
水 食用油
水 煤油
水
振荡
静置
溶液、悬浊液、乳浊液
不溶解
不溶解
不溶解
不溶解
分层
分层
分层
分层
悬浊液
悬浊液
乳浊液
乳浊液
活动
观察在水中加入不易溶解物质后的现象
二、悬浊液和乳浊液
1、悬浊液:固体小颗粒分散于液体里所形
成的混合物
2、乳浊液:液体小液滴分散另一种液体里
所形成的混合物
名称特征 溶 液 悬 浊 液 乳 浊 液
形成过程
稳定性
长期放置
溶液、悬浊液、乳浊液的区别:
固、液、气体溶解在液体中
固体颗粒分散在液体中
小液滴颗粒分散在液体中
稳定
不稳定
不稳定
均一、稳定的
下沉
(分层)
上浮(分层)
牛奶
石油泄漏污染海水
泥水
豆浆
小结
洗涤剂
洗涤剂的分子,一端易溶于食物油和煤油,另一端易溶于水;亲油的一端钻进油滴,无数洗涤分子包围在油珠周围,使油状的小液滴破碎,变得细小;而亲水的一端向外,这样使油与水形成一个较稳定的分散体系。从而除去油污。
其他常用的溶剂
活动
1、在两个试管中各加入5ml水和5ml汽油,然后分别滴入2滴
食物油,振荡后,观察到的现象?
2、在两个试管中各加入5ml水和5ml酒精,然后分别加入1小块
碘晶体,振荡后,观察到的现象?
实验表明:水是一种良好的溶剂,能溶解很多种物质,但不是万能的溶剂。溶质对溶剂是有选择性的。酒精能溶解碘,配成消毒用的碘酒;汽油能溶解油脂,人们常用汽油擦除油污。
『思考与讨论』
当两种液体相互溶解时,可以怎样确定溶质和溶剂?
用水做溶剂的溶液,叫做水溶液。通常不指明溶剂的溶液,一般指的是水溶液。水溶液通常不论液体的含量多少,都把水看作溶剂,另一种物质看作溶质。
当其他两种液体相互溶解是通常把溶液里含量较多的一种叫做溶剂,把含量较少的一种叫做溶质。
衣服的干洗
请同学们回答下列问题:
1、什么叫溶解度?理解这个概念时要把握哪四个要素(关键)?
2、20℃时,氯化钠的溶解度是36g。则20℃时,氯化钠饱和溶液中溶质、溶剂、饱和溶液的质量比是_________________。
36:100:136
课堂巩固练习
1、下列关于溶解度说法正确的是( )
A、一定温度下,该物质在100克溶剂中所溶解的克数。
B、一定温度下,该物质在100克饱和溶液中所含溶质的克数。
C、该物质在100克溶剂中达到饱和状态所溶解的克数。
D、一定温度下,该物质在100克溶剂中最多能溶解的克数。
练习:判断下列说法是否正确:
(1) 20克 A 物质溶解在100克水里恰好制成饱和溶液, A的溶解度是20克.
(2) 20℃时,10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解
度是10克.
(3) 20℃时,10克氯化钠可溶解在100克水里,20℃时氯化钠的溶解度是10克.
(4) 20℃时, 100克水最多可溶解36克氯化钠, 则20℃时氯化钠的溶解度为36.
( X )
( X )
( X )
( X )
S
T
t 0
t 1
t 2
m
n
p
C
B
A
Q
0
t 2 时,C 物质溶解度为m克
B
(2)Q点表示的意义是
练习:右图是A、B、C三种固体物质的溶解度曲线,回答
(1)P点表示的意义是
(4) t 0 ℃ A、B、C三种物质溶解度由大到小的顺序
(3)溶解度受温度影响最小的是
t 1 时,Q 点A、B、C三者的溶解度相等
A、B、C
曲线的意义
1. 曲线上的点表示某温度下某溶质的溶解度
2. 曲线的交点,表示在该温度下物质的溶解度相等
3. 倾斜程度表示物质的溶解度受温度变化影响的大小
4. 比较某一温度下各种物质溶解度的大小
这杯硝酸钾溶液是饱和的吗?
方 法
1.往溶液中继续加入硝酸钾,看是否溶解
2.蒸发一些水,看是否有晶体析出
3.降低温度,看是否有晶体析出
结论:
溶解能力是有一定限度的
溶解能力的大小与温度有关
练习:
1、 20℃时,硝酸钾的溶解度是31.6克,现要溶解79克硝酸钾至少需要多少水?若要配制200克硝酸钾饱和溶液需要多少克硝酸钾和水?
2、现有80℃的硝酸钾饱和溶液200克降温到20℃时有多少克硝酸钾析出?若有20℃的硝酸钾饱和溶液200克若升温到80℃ ,可以通过什么方法使它达到饱和?( 20℃时,硝酸钾的溶解度是31.6克,80℃时,硝酸钾的溶解度是170克)
1、写出下列过程中所涉及到的物态变化名称和吸、放热情况。
①太阳出雾气散,___、___。②霜的形成,___、___。③烧红的铁条插入水中,冒出的一股“白气”的形成,___、__。
2、想出三个办法使湿衣服快一点干?并说出相关理由。
_________、_________、________。
3、举出二个“给物体加热但物体温度并没有升高”的例子。
①____________,②______________。
4、水的密度是__千克/米3,读作___,3毫升水质量__克。
5、把一盒水放入冰箱冷冻
室里,绘出盒内水或冰的
温度变化大致曲线.
时间
温度
复习
第三节
水是常用的溶剂
海水
河水
湖水
自来水
这些澄清透明的天然水,
是不是纯净水?
天然水,如海水、河水、溪水、井水等,都不是纯净的水,而是含有许多溶解性物质和非溶解性物质的极其复杂的混合物。
纯净物:只由一种物质组成的物质。
混合物:由两种或两种以上物质组成
的物质。
纯净物与混合物
定义:
在混合物中,各种物质都保持各自原来的性质。是可以通过各种方法分离出来的。
溪 水
各种饮料
水溶液
水是一种良好的溶剂,它能溶解各种固态的、液态的和气态的物质。
活动
2、将深紫色的高锰酸钾晶体加入水中,你发现_____。
1、把一药匙蔗糖放入一杯水中,你发现___________。
组成蔗糖的蔗糖分子或组成高锰酸钾的微粒(钾离子和高锰酸根离子)均匀地分散到水分子中间,形成均一 、稳定的液体。
由一种或一种以上的物质分
散到另一种液体物质里,形成的
均一、稳定的混合物,叫做溶液。
现象:
高锰酸钾不见了,得到紫红色液体。
蔗糖不见了,得到无色液体。
高锰酸钾 能溶解在 水 里
蔗糖 能溶解在 水 里
被溶解的物质
能溶解其他物质的物质
溶质在溶剂中溶解后得到的混合物
2、溶质质量 + 溶剂质量 = 溶液质量
1、溶质
溶剂
溶液
你认为在溶液中这三者的质量存在什么样的关系吗?
3、读作:“溶质”的“溶剂”溶液
泉水中溶入了矿物质、氧气、二氧化碳,那么,其中的溶质是什么 溶剂是什么
溶质(固体、液体、气体)
固体:蔗糖、高锰酸钾、盐、碘等。
液体:酒精、煤油等。
气体:二氧化碳、氧气等。
溶剂(液体)
水、酒精等。
1、理解溶液定义中所包含的三层意义:
第一,均一和稳定是溶液的特征。
第二,分散两字体现溶液的形成。
第三,溶液是混合物。
2、溶质和溶剂是相对而言的:
除了水以外酒精、汽油等也是常用的溶剂。
⑴一般把形成溶液的液态物质叫做溶剂,非液态物质叫做溶质。
如5﹪酒精与水的溶液中,水是溶剂,酒精是溶质。
⑶通常不指明溶剂的溶液,一般指的是水溶液。
氢氧化钠溶液中,溶质是氢氧化钠,溶剂是水。
⑵溶质和溶剂都是液态时,量多的是溶剂。(但如果其中一种是水,则不论多少,都是水做溶剂)
【例1】指出汽水、碘酒、36度的白酒这三种溶
液中的溶质、溶剂。
在汽水中,二氧化碳是溶质,水是溶剂。
在碘酒中,碘是溶质,酒精是溶剂。
在白酒中,酒精是溶质,水是溶剂。
鱼可以在水中呼吸,说明水中溶解了什么
物质?它是溶质吗?
思考
溶液
组成
溶质
溶剂
特征
均一
稳定
小结
活动
取用固体小颗粒状药品一般用药匙。
取用固体块状药品一般用镊子。
取用固体粉末状药品一般用纸槽。
操作:
把试管横放,
将药品送到试管底部,
再把试管缓缓竖起。
把容器横放,把药品或金属颗粒放入
容器口以后,再把容器慢慢地竖立起
来,使药品或金属颗粒缓缓地滑到容
器的底部,以免打破容器。
粉状固体
块状固体
1.溶液是一种_________ 、_________的混合物。
2.溶液是由溶质和溶剂组成,指出下列溶液的溶质和溶剂:
(1)“茅台”白酒:溶质是_______,溶剂是_________。
(2)生理盐水:溶质是_________,溶剂是_________。
(3)碘酒:溶质是__________,溶剂是_________。
(4)高锰酸钾溶液:溶质是_________,溶剂是________。
A.食盐 B.蒸馏水 C.酒精 D.天然水
3.下列物质属于混合物的是 ( )
课堂练习
4、下列叙述中正确的是……………… ( )
A 凡是无色透明的液体都是溶液
B 溶液的体积等于溶质和溶剂体积之和
C 溶液是均一、稳定、无色透明的混合物
D 只要条件不变,糖水中的糖不会分离出来
课堂练习
5、下列物质属于溶液的是………………( )
A纯牛奶 B白醋 C粒粒橙 D冰水
D
B
比较不同物质在水中的溶解能力
蔗 糖
在20ml水中大约能溶解7g食盐.
在20ml水中大约能溶解38g蔗糖.
一般地,不同溶质在同一种溶剂里的溶解能力不同;
同种溶质在不同溶剂里的溶解能力也是不同的。
可见:一种物质溶解在另一种物质里的能力大小主要是由溶质和溶剂的性质决定的
蔗糖的溶解能力比食盐的溶解能力强
【思考】在一定的条件下,溶质是否
可以无限地溶解在一定量的溶剂里呢?
【实验演示】蔗糖的溶解
现象:得到蔗糖的溶液,到一定时候蔗糖不再溶解。
饱和溶液和不饱和溶液
这说明了什么?
结论:说明在一定的条件下,溶质不能无限地溶解在溶剂里。
(一定量的溶剂中,一定的温度下)
1、 饱和溶液:
在一定温度下,在一定量的溶剂里,不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液。
2、 不饱和溶液:
在一定温度下,在一定量的溶剂里,还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液。
4、 加少量的溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。
2、温度稍有降低,如果就会有一些溶质析出,表明原溶液是饱和的。
3、如果溶剂稍有蒸发,溶质就会有析出,表明原溶液是饱和的。
【思考、讨论】
怎样判断一种溶液是不是饱和溶液?
1. 如果溶液中有少量未溶的溶质,则是饱和溶液;
饱和溶液和不饱和溶液的转化
1、饱和溶液和转化成不饱和溶液
(1)加入溶剂
(2)改变温度
2、不饱和溶液和饱和溶液的转化
(1)蒸发溶剂
(2)改变温度
(3)加入溶质
『回顾』不同溶质在同种溶剂中的溶解
能力是不一样。
『讨论』怎样定量比较物质的溶解能力呢?
定标准;
标准里应该含有哪些物理量呢?从哪些
方面考虑?
从影响物质溶解能力的因素考虑。
定溶剂的量、定温度、定状态
溶解度
1、用溶解度来表示物质的溶解能力,即:在一定的温度下,在100 克溶剂里达到饱和状态时所溶解某物质的质量(克)为该物质在这种溶剂里的溶解度。
注意点:
(1)理解这个概念,抓住四个词:一定的温度、100克溶剂(一般为水)、达到饱和、溶解的质量(单位为克)
(2)溶解度值越大,表明该温度下,物质的溶解能力越强.
练习:20℃时,硝酸钾的溶解度为31.6g,这句话的含义是什么?
温度 溶质质量 溶剂质量 饱和溶液质量
20℃
31.6g
100g
(100+31.6)g
★20℃时100g水里最多溶解硝酸钾31.6g或20 ℃时100g水里溶解31.6g硝酸钾达到饱和
如何比较
氯化钠、硝酸钾的溶解性大小?
(1)为什么要求水温相同?用一杯冷水和一杯热水分别溶解氯化钠和硝酸钾,行不行?
(2)为什么要求水的体积相同?用一杯水和一盆水分别溶解,行不行?
(3)为什么要达到饱和状态?100克水能溶解1克氯化钠也能溶解1克硝酸钾,能否说明氯化钠、硝酸钾的溶解性相同?
1.“20℃时,硝酸钾的溶解度是31.6克”.
这句话的含义是
此时,饱和溶液 克,
溶质 克, 溶剂 克,
2.20℃时,100克水中最多能溶解0.165克氢
氧化钙,则20℃时氢氧化钙的溶解度是
20℃时,在100克水中达到饱和状态时,溶解硝酸钾的质量是31.6克。
131.6
31.6
100
0.165克
判断是非:
(1)20℃时,10克食盐溶解在100克水中,所以20℃时食盐的溶解度是10克。
(2)100克水中溶解了36克食盐刚好达到饱和,所以食盐的溶解度是36克。
(3)在20℃时,100克水里最多溶解33.3克氯化铵,则20℃氯化铵的溶解度是33.3。
(4)在20℃时,100克硝酸钾饱和溶液里含硝酸钾24克,则20℃硝酸钾的溶解度是24克。
(5)在30℃时,100克水中加入40克氯化钾后达到饱和溶液,则30℃时氯化钾的溶解度是40克。
.
.
.
.
溶解度/
g
200
100
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
50
10
20
30
40
0
90
60
70
80
温度/℃
.
硝酸钾
.
.
.
.
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
169
202
246
2、溶解度的表示方法:
(1)列表法:
(2)溶解度曲线
以温度为横坐标,溶解度为纵坐标,形象地表示出物质的溶解度随温度变化情况的曲线。
不同的物质溶解度受温度的影响是不同的。
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
(1)曲线上每个点表示某温度下某溶质的溶解度
(2)曲线表示物质的溶解度受温度变化影响大小的情况
(3)两条曲线的交点,表示在该温度下两种物质的溶解度相等
(4)曲线上每个点所配制的溶液是该温度下这种溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液。
溶解度曲线的意义
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
溶解度/
g
0.05
0.10
0.15
0.20
90
70
40
0
10
20
50
60
80
100
30
温度/℃
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
熟石灰的溶解度曲线:
讨论:
固体物质溶解度受温度变化影响情况:
大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。
少数固体物质溶解度受温度影响不大, 例如食盐。
极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
固体的溶解度曲线:
1、横坐标60,纵坐标110 的A点表示什么意义?
练习:
2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。
47g
44g
60g
A.
B.
3、B点表示什么意思?
表示在该点所示的温度(68 ℃ )时,硝酸钠和硝酸钾两种物质的溶解度相等(134克)。
100
硼酸
硝酸铵
硝酸钠
硝酸钾
氯化铵
氯化钾
氯化钠
60
70
50
10
20
30
40
80
90
100
110
180
170
160
150
140
130
120
190
200
50
10
20
30
40
0
90
60
70
80
溶解度/
g
温度/℃
固体的溶解度曲线:
68
134g
小于
B.
4、在40℃时,硝酸钾的溶解度____ (填大于、小于)硝酸钠的溶解度。
练习:
3、在___℃时硝酸钾和硝酸钠的溶解度相同,都约为______。
5、在80℃时氯化钠、氯化钾、氯化铵、硼酸的溶解度由大到小的顺序是_____________________________。
氯化铵、氯化钾、氯化钠、硼酸
甲
乙
丙
B
温度(℃)
溶解度
(g)
T1 T2
(1)T2时,溶解度最大的是________;
(2)B点代表的含义是
_______________________
_______________;
(3)T1时的甲溶液升温到T2,甲溶液变成
_______________.
甲
T1℃时,甲、丙两种物质
的溶解度相等
不饱和溶液
活动
比较不同物质在溶解过程中的能量变化
实验表明,在溶质溶解于水的过程中都伴随着能量的变化,有些有明显的放热或吸热现象,有些则温度变化不明显。
人们利用某些物质在溶于水的过程中会放出大量的热的性质,为野外工作者设计了方便、安全的自热罐头;反之,人们用硝酸铵制作冰袋。
应用——自热罐头和冰袋
浊液
黄河水中含有很多泥沙,水的颜色发黄,黄河由此得名。黄河水素有“一碗水,半碗泥”的说法。这是一种典型的悬浊液。
编号 1 2 3 4
实验
内容 泥土
水 熟石灰
水 食用油
水 煤油
水
振荡
静置
溶液、悬浊液、乳浊液
不溶解
不溶解
不溶解
不溶解
分层
分层
分层
分层
悬浊液
悬浊液
乳浊液
乳浊液
活动
观察在水中加入不易溶解物质后的现象
二、悬浊液和乳浊液
1、悬浊液:固体小颗粒分散于液体里所形
成的混合物
2、乳浊液:液体小液滴分散另一种液体里
所形成的混合物
名称特征 溶 液 悬 浊 液 乳 浊 液
形成过程
稳定性
长期放置
溶液、悬浊液、乳浊液的区别:
固、液、气体溶解在液体中
固体颗粒分散在液体中
小液滴颗粒分散在液体中
稳定
不稳定
不稳定
均一、稳定的
下沉
(分层)
上浮(分层)
牛奶
石油泄漏污染海水
泥水
豆浆
小结
洗涤剂
洗涤剂的分子,一端易溶于食物油和煤油,另一端易溶于水;亲油的一端钻进油滴,无数洗涤分子包围在油珠周围,使油状的小液滴破碎,变得细小;而亲水的一端向外,这样使油与水形成一个较稳定的分散体系。从而除去油污。
其他常用的溶剂
活动
1、在两个试管中各加入5ml水和5ml汽油,然后分别滴入2滴
食物油,振荡后,观察到的现象?
2、在两个试管中各加入5ml水和5ml酒精,然后分别加入1小块
碘晶体,振荡后,观察到的现象?
实验表明:水是一种良好的溶剂,能溶解很多种物质,但不是万能的溶剂。溶质对溶剂是有选择性的。酒精能溶解碘,配成消毒用的碘酒;汽油能溶解油脂,人们常用汽油擦除油污。
『思考与讨论』
当两种液体相互溶解时,可以怎样确定溶质和溶剂?
用水做溶剂的溶液,叫做水溶液。通常不指明溶剂的溶液,一般指的是水溶液。水溶液通常不论液体的含量多少,都把水看作溶剂,另一种物质看作溶质。
当其他两种液体相互溶解是通常把溶液里含量较多的一种叫做溶剂,把含量较少的一种叫做溶质。
衣服的干洗
请同学们回答下列问题:
1、什么叫溶解度?理解这个概念时要把握哪四个要素(关键)?
2、20℃时,氯化钠的溶解度是36g。则20℃时,氯化钠饱和溶液中溶质、溶剂、饱和溶液的质量比是_________________。
36:100:136
课堂巩固练习
1、下列关于溶解度说法正确的是( )
A、一定温度下,该物质在100克溶剂中所溶解的克数。
B、一定温度下,该物质在100克饱和溶液中所含溶质的克数。
C、该物质在100克溶剂中达到饱和状态所溶解的克数。
D、一定温度下,该物质在100克溶剂中最多能溶解的克数。
练习:判断下列说法是否正确:
(1) 20克 A 物质溶解在100克水里恰好制成饱和溶液, A的溶解度是20克.
(2) 20℃时,10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解
度是10克.
(3) 20℃时,10克氯化钠可溶解在100克水里,20℃时氯化钠的溶解度是10克.
(4) 20℃时, 100克水最多可溶解36克氯化钠, 则20℃时氯化钠的溶解度为36.
( X )
( X )
( X )
( X )
S
T
t 0
t 1
t 2
m
n
p
C
B
A
Q
0
t 2 时,C 物质溶解度为m克
B
(2)Q点表示的意义是
练习:右图是A、B、C三种固体物质的溶解度曲线,回答
(1)P点表示的意义是
(4) t 0 ℃ A、B、C三种物质溶解度由大到小的顺序
(3)溶解度受温度影响最小的是
t 1 时,Q 点A、B、C三者的溶解度相等
A、B、C
曲线的意义
1. 曲线上的点表示某温度下某溶质的溶解度
2. 曲线的交点,表示在该温度下物质的溶解度相等
3. 倾斜程度表示物质的溶解度受温度变化影响的大小
4. 比较某一温度下各种物质溶解度的大小
这杯硝酸钾溶液是饱和的吗?
方 法
1.往溶液中继续加入硝酸钾,看是否溶解
2.蒸发一些水,看是否有晶体析出
3.降低温度,看是否有晶体析出
结论:
溶解能力是有一定限度的
溶解能力的大小与温度有关
练习:
1、 20℃时,硝酸钾的溶解度是31.6克,现要溶解79克硝酸钾至少需要多少水?若要配制200克硝酸钾饱和溶液需要多少克硝酸钾和水?
2、现有80℃的硝酸钾饱和溶液200克降温到20℃时有多少克硝酸钾析出?若有20℃的硝酸钾饱和溶液200克若升温到80℃ ,可以通过什么方法使它达到饱和?( 20℃时,硝酸钾的溶解度是31.6克,80℃时,硝酸钾的溶解度是170克)
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
