2011高考化学考前强化知识点专项能力突破:基本理论 第1讲 物质结构 元素周期律
文档属性
| 名称 | 2011高考化学考前强化知识点专项能力突破:基本理论 第1讲 物质结构 元素周期律 |

|
|
| 格式 | zip | ||
| 文件大小 | 208.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-05-31 00:00:00 | ||
图片预览




文档简介
专题二 化学基本理论
【复习指南】
内容指要:本专题包括对元素周期表(长式)的结构(周期、族)的了解和元素周期律的实质的应用性掌握;能对化学反应速率的概念、反应速率的定量表示方法进行判断,能理解性甑别外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,明了化学平衡常数的含义,并能利用化学平衡常数进行简单的计算;能熟练运用电离和平衡原理分析和处理电解质溶液中的电离平衡、水解平衡及难溶电解质的溶解平衡及沉淀转化;能了解原电池和电解池工作原理,并能结合常见化学电源或新型电源写出电极反应和电池反应方程式。
教材回眸:请认真阅读高中化学必修2“第一章 物质结构 元素周期律”、必修1“第三章 金属极其重要化合物、第四章 非金属及其重要化合物”、高中化学必修2“第二章 第三节”、选修4“第二章 化学反应速率和化学平衡”、高中化学选修4“第三章 水溶液中的离子平衡”、高中化学必修2“第二章 第二节 化学能与电能”、选修4“第四章 电化学基础”等相关内容。
专题重点:
①外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,尤其是对表格、数据等呈现方式的辨析;②结合实例书写和计算平衡常数;③常见化学电源或新型电源的电极反应和电池反应方程式的书写以及金属的电化学腐蚀原理及防腐措施的列举;④突破以元素推断为切入口,与具体物质、其它概念原理、实验、计算相融合的新题型。
所需时间:共7课时,其中授课和课堂互动性练习5课时,习题讲评2课时。
【专题建构】
1.原子结构和元素周期律知识的综合网络
2.化学反应速率和化学平衡知识网络
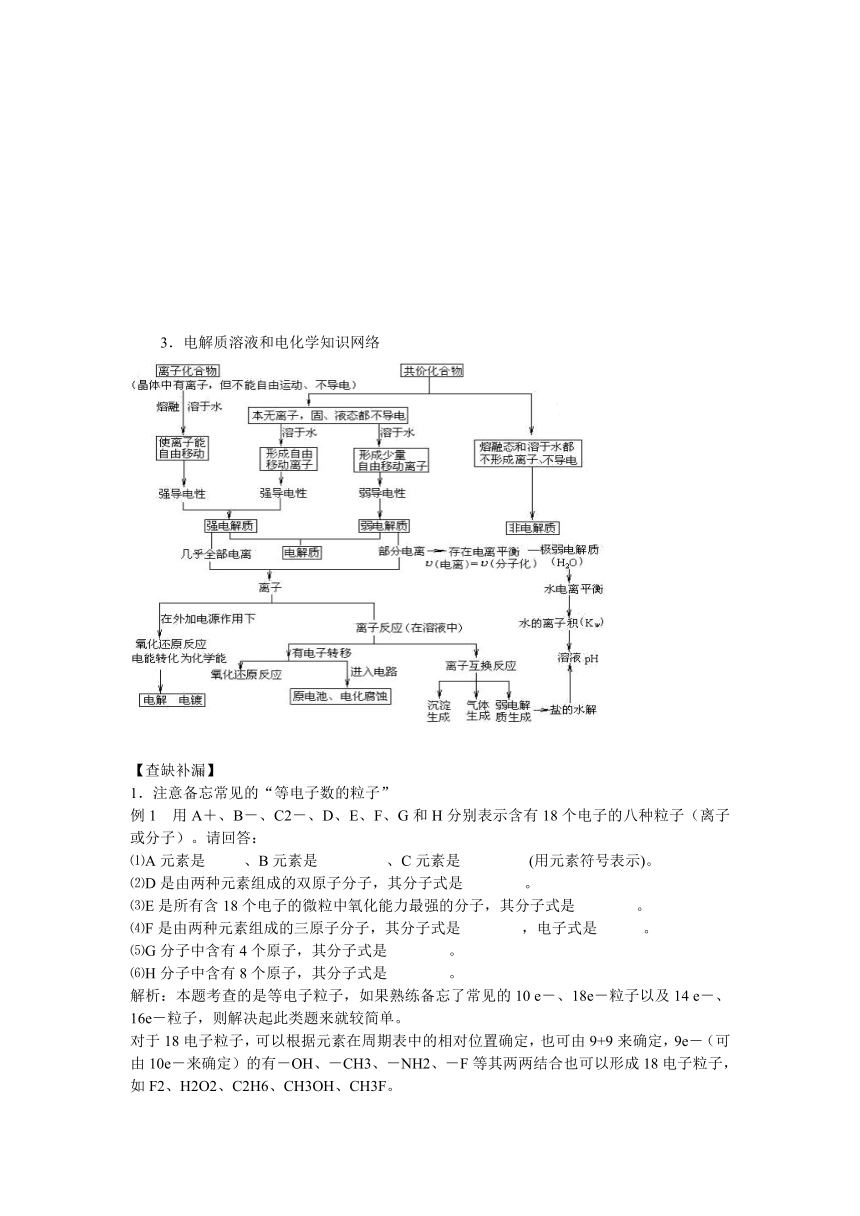
3.电解质溶液和电化学知识网络
【查缺补漏】
1.注意备忘常见的“等电子数的粒子”
例1 用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种粒子(离子或分子)。请回答:
⑴A元素是 、B元素是 、C元素是 (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
⑸G分子中含有4个原子,其分子式是 。
⑹H分子中含有8个原子,其分子式是 。
解析:本题考查的是等电子粒子,如果熟练备忘了常见的10 e -、18e -粒子以及14 e -、16e -粒子,则解决起此类题来就较简单。
对于18电子粒子,可以根据元素在周期表中的相对位置确定,也可由9+9来确定,9e-(可由10e-来确定)的有-OH、-CH3、-NH2、-F等其两两结合也可以形成18电子粒子,如F2、H2O2、C2H6、CH3OH、CH3F。
答案:⑴K,Cl,S ⑵HCl ⑶F2 ⑷H2S H:S:H ⑸H2O2(或PH3)⑹C2H6
附:常见等电子数微粒
(1)“10电子”的微粒:
分子 离子
一核10电子的 Ne N3 、O2 、F 、Na+、Mg2+、Al3+
二核10电子的 HF OH
三核10电子的 H2O NH2
四核10电子的 NH3 H3O+
(2)“18电子”的微粒
分子 离子
一核18电子的 Ar K+、Ca2+、Cl 、S2
二核18电子的 F2、HCl O22-、HS
三核18电子的 H2S
四核18电子的 PH3、H2O2 、NH2F
五核18电子的 SiH4、CH3F 、NH2OH
六核18电子的 N2H4、CH3OH
其它粒子 C2H6 、CH3NH2 N2H5+、N2H62+
(3)其它等电子数的粒子
“9电子”的粒子: —F、—OH、—NH2、-CH3(取代基)
“14电子”的粒子:Si、N2、CO、C2H2
“2电子”的粒子:He、H—、Li+ 、Be2+
(4)质子数及核外电子总数均相等的粒子
①Na+、NH4+、H3O+ ②HS-、Cl- ③F-、OH-、NH2- ④N2、CO、C2H2
2.重视以图、表作为信息源类试题的“自悟”
例2 在2L密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(1)右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
(2)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
解析:(1)从n(NO)随时间变化表可得出,NO的物质的量随时间的推移而减小,NO与O2是反应物,NO2是生成物,NO2的变化曲线只能是a,b中的某一条。反应在3s之后,NO的物质的量不再发生变化,反应过程中NO减小0.013mol,根据方程式可知NO2增加0.013mol,而容器体积2L,所以达到平衡时,NO2的浓度0.065mol/L,曲线b符合。0~2s内,NO减少0.012mol,据反应方程,O2同时减少0.006mol,所以以O2来表示这段时间的平均速率=0.006mol÷2L÷2s=0.0015mol/(L.s)。
(2)a在达没达到平衡都成立,因为反应速率之比等于化学计量数之比。反应2NO(g)+O2(g)
2NO2(g)的反应前后气体分子数目不相等,平衡受压强的影响,压强改变,平衡要移动,b中压强已保持不变,所以b已达平衡状态。根据平衡状态的定义,正逆反应速率相等可得c也达平衡状态。密度等于质量除以体积,该反应的反应物和生成物均为气体,质量不变,而容器的体积2L,也不发生变化,所以任何条件下密度都不发生改变,d不能说明反应是否达到平衡状态。
(3)分离出NO2气体,反应速率减慢,加入催化剂,平衡不移动,升高温度该反应向逆向移动,所以a、b、d均错误。增大反应物O2的浓度,反应速率增大,平衡向正向移动,c正确。
答案:(1)b 1.5×10-3mol/(L.s)(2)b、c (3)c。
(4)4NH3+5NO4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
(5)①46%;②216kg。
3.在“两平衡”(电离平衡和水解平衡)与“两守恒”(电荷守恒和物料守恒)关系的融合上强化训练
例3 下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO)>c(NH)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
解析:A:根据溶液中电荷守恒知:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),当溶液pH=7时,
c(H+)= c(OH-),那么有:c(NH4+)=2c(SO42-) 则A不正确;B:醋酸是弱酸,不同浓度的醋酸其电离程度不同,当pH相差一个单位时,c1>10c2 B不正确;C、.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合时,醋酸过量,溶液显酸性,滴入石蕊溶液呈红色,C正确;
D、向0.1 mol/L的氨水中加入少量硫酸铵固体,氨水的电离平衡向逆方向移动,c(OH-)/c(NH3·H2O)减少。
答案:C。
4.抓住电化学命题中的四个“生长点”:即电极的判断、电极反应式的书写、溶液pH的计算或估算、电子移动的方向判断或计算
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入H2和O2,下解说法不正确的是( )
A.通入H2的电极为负极
B.通入O2的一极电极反应为4H2O+O2+8e=8OH-
C.随着放电的进行,负极附近pH上升
D.标准状况下通入5.6LO2完全反应后有1mol电子转移
解析:本题考点是原电池部分的基础知识,要求学会会判断电源的正负极,会正确书写电极反应式和总电池反应式,高考对这一问题会从两个方面进行考查:
一是根据给出的两个电极反应式,写总反应式:书写时注意使两个电极反应式得失电子数相等后相加两式,消去反应物和生成物中相同的物质即可。注意若反应式同侧出现不共存的离子,如H+和OH-,Pb2-和 SO42-,要写成反应后的物质如H2O和PbSO4。
二是给出总反应式,写电极反应式:
书写步骤为:1)列物质,标得失 2)选离了配电荷,3)配个数,巧用水,4)两式加验总式以氢氧燃料电池为例。已知总电池反应为2H2+O2=2H2O。电解质溶液为KOH溶液,试写出两极反应式。
负极书写步骤为:
1)根据总电池方程式列出总式两边化合价升高的有关物质,标出失去电子的数目:
2H2-4e→2H2O
2)根据电解质溶液的酸碱性,用H+或OH-或其他离子配平,使反应式两边电荷总数相等。
2H2+4OH--4e——2H2O
此时注意:①电子带负电,②在碱性电解质溶液中,电极反应式不宜出现H+,如上式写成2H2-2e——2H2O+4H+就不对了。③上式亦不能写成:2H2-4e——2H2O-4OH-,因为H2失电子,不可能出现OH-。
3)利用H2O使两边元素守恒,即 2H2+4OH--4e=4H2O
同理:正极电极反应式书写如下:
1),2)O2+4e——4OH-
3)O2+2H2O+4e=4OH-
4)将正负极电极方程式相加,若得到总反应式,说明写法正确。
答案:C
【专题聚焦】
第1讲 物质结构 元素周期律
1.用心构建原子的组成及各微粒间的关系网络
精要阐释:
原子
的含义:代表一个质量数为A,质子数为Z,中子数为(A-Z)的原子。
质量数(A)质子数(Z)中子数(N)
质子数核电荷数核外电子数原子序数
母题典范: 13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtǔWthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60 互为同素异形体
C.14N与15N互为同位素 D. 15N的核外电子数与中子数相同
思路与解析:本题属基础题,意在考查考生对含义的领悟情况,若要对选项做出快捷而准确地判断,需调用“质量数(A)质子数(Z)中子数(N)”和“质子数核电荷数核外电子数原子序数”加以判断。
元素符号左下角的可表示原子序数、原子核中的质子数或者电中性时原子核外的电子数;左上角的数字代表原子质量数,即质子数加中子数;右下角的数字可表示单质分子中的原子数。
答案:C
应对策略:原子中微粒数之间的关系一直是高考命题的热点之一。此类题以新发现的元素为载体,情景新颖,但难度不大。解答此类题目时:一是要掌握好各粒子之间的关系,即原子序数=核电荷数=核内质子数=核外电子数(原子中);质量数(X)=中子数(N)+质子数(Z),二是要掌握同位素、同素异形体、同分异构体等概念,正确区分它们研究的对象是致胜法宝。
变式练习 据报道2008年11月9日德国科学家利用数亿个镍原子(28Ni)对数亿个(82Pb)连续轰击数天后制得一种新原子110X(暂用X表示),它属于一种新元素—第110号元素。这种新元素是有史以来制得最重的元素,存在时间不到千分之一秒。经推知它属于过渡元素。下列关于该元素的叙述中正确的是( )
A.这种原子(110X)的中子数为110 B.这种元素肯定是金属元素
C.这种元素与铅属同一族 D.这种元素为第六周期元素
解析:A项,该原子的中子数为269-110=159,故A错;由该元素的原子序数为110,可根据推断元素在周期表中位置的方法,推知它位于第七周期第Ⅷ族,属于副族元素,故它肯定是金属元素,C、D错。
答案:B。
2.“位一构一性”之间的关系,是解决“表”、“律”问题的金钥匙
精要阐释:
母题典范:X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是( )
A.还原性:X的氧化物>Y的氧化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y中都含有共价键
D.Z元素的最高价氧化物的水化物的化学式为HZO4
点拨:本题主要考查元素周期律的应用,此类题目一般难度不大,解题的关键是要理解元素周期律的实质,并掌握原子半径、核外电子排布、元素化合价及元素的金属性、非金属性的递变规律。特别是要灵活运用1—18号元素的原子(或离子)结构特点及有关规律进行分析推断。
思路与解析:X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,则Y为硫元素,Z为氯元素。其最高价氧化物的水化物为HClO4。三种元素中S元素的非金属性最弱,因此其氢化物的还原性最强。根据M2Y又因为X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大判断M为钾元素,SO2为共价化合物含共价键,而K2S属于离子化合物,只含离子键。
答案:D
应对策略: 记住这些元素周期表中特殊位置的元素吧,关键时候,或许能给你带来意
想不到的作用的。
①族序数等于周期数的元素:H、Be、Al;
②族序数等于周期数2倍的元素:C、S;
③族序数等于周期数3倍的元素:O;
④周期数是族序数2倍的元素:Li;
⑤周期数是族序数3倍的元素是:Na;
⑥最高正价不等于族序数的元素是:O、F。
变式练习 X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子
半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
解析:从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W是Mg元素,R是S元素。所以,A项,Y、Z、W具有相同电子层结构的离子(O2-、Na+、Mg2+),其半径依次减小(判断依据:核外电子排布相同的微粒,半径随着核电荷数的增加而减小);B项,X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2);C项,元素Y、R分别与元素X形成的化合物是氢化物,因为Y(O元素)和R(S元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:XmY>XmR;W元素最高价氧化物的水化物是Mg(OH)2,是中强碱,而R元素最高价氧化物的水化物是H2SO4,是强酸。
答案:C
【限时演练】
1.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为( )
A.39∶61 B.61∶39 C.1∶1 D.39∶11
2. 下列说法正确的是( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
解析:金属元素也能形成含氧酸及其含氧酸盐,如高锰酸钾;氧、氟两非金属元素不能形成含氧酸。许多含氧酸如碳酸、磷酸不具有强氧化性,故B、C、D均不正确。
答案:A
3.已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置
如下图所示,下列说法正确的是( )
A.Z元素的原子半径可能比Y元素的小
B.Z元素的最高化合价可能比Y元素的高
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
解析:根据表格,知该四种元素应属于二、三周期,且是第三主族至七主族。如果Y为F,则Z为P,故B成立。
答案:B
4.某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
A.X的最高价含氧酸的分子式可表示为H3XO4
B.X是第二周期ⅤA族元素
C.X是第二周期ⅥA族元素
D.X的最高化合价为+4
解析:此题考查了原子结构、元素在周期表中的位置与物质性质的关系。最高价含氧酸的相对分子质量为98的酸常见有两种:硫酸和磷酸。且磷元素的氢化物的分子式不是H2X,而是PH3,故X应为磷。
答案:A
5.下列选项中所涉及到的两个量的一定相等的是( )
A.11.2LCl2与4.25gNH3所含有的原子数
B.18.0g重水(D2O)与20gNe所含有的电子数
C.标准状况下36gH2O与1.204×1024个O2分子所占的体积
D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
解析:参加反应的Al的物质的量相等,反应中失去的电子数必然相等。
答案:D
6.某短周期元素的最高价氧化物所对应的水化物的化学式为HxROY,气态氢化物的化学式为HzR(或RHZ)。已知1molHxROY比lmolHzR质量多64g。下列说法不正确的是( )
A.2Y—X+Z=8 B.Y=4
C.R一定是硫元素 D.R一定处于第三周期
解析:最高价氧化物所对应的水化物的化学式为HxROY,可得R的最高正价为2Y-X,气态氢化物的化学式为HzR,最低负价为-Z,可得2Y-X+Z=8。1molHxROY比lmolHzR质量多64g,可得X+R+16Y-Z-R=16,联立解得X=Z,Y=4,R为短周期元素,有H4SiO4、SiH4;H2SO4、H2S,R可能为S,也可能为Si,C不正确。
答案:C
7.第四周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.原子半径比镁的原子半径大 D.碳酸盐易溶于水
解析:处于第四周期的主族元素的原子,其最外电子层上有两个电子,说明该元素是Ca,它的原子半径比钾的原子半径小,但比镁的原子半径大;氯化钙能溶于水,碳酸钙难溶于水。
答案:C
8.下列叙述正确的是( )
① 7Li+中含有的中子数与电子数之比为2︰1
② 在C2H6分子中极性共价键与非极性共价键数之比为3︰1
③ 常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1
④ 5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1
A.① ② B.② ③ C.① ③ D.③ ④
解析:①中7Li+的中子数为“7-3=4”,而电子数为2,两者之比刚好为2 :1,①正确;
在C2H6分子中极性共价键为6,非极性共价键数为1,两者之比应为6 :1,②错;不
管何条件下甲烷气体中含有的氢、碳原子数之比总是为4︰1,③对;5.6 g铁即0.1mol铁与足量的氯气反应时铁失去0.3mol电子,即两者之比应为3 :1,④有误。所以,正确组合为C。
答案:C。
9.A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是
由5个原子核组成的粒子。它们之间可发生如下变化:A+B====C+D;B+E====2D,且D与大多数酸性氧化物及碱性氧化物均能反应。
(1)写出A的电子式_______;写出E的电子式_______。
(2)B的化学式为_______;C的化学式为__________;D的化学式为__________;E的化学式为_______。
(3)用电子式表示D的形成过程_______________________________________________。
解析:能与酸性氧化物(如CO2、SO2等)、碱性氧化物(如Na2O、CaO 等)反应的物质应为H2O。由5个原子核组成的粒子常见的有CH4、NH,根据给定的反应式可确定10电子的分子或离子。NH+OH-= NH3+H2O,OH-+H3O+ = 2H2O。
答案:(1)[H H]+ [HH]+
(2)OH- NH3 H2O H3O+
(3)H HHH
10.根据元素周期表1—20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有
___________(填两种化合物的化学式);
(2)属于稀有气体的是___________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是____________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)______________;
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
Na (5)NH3;SiH4
11.已知X+、Y3+ 、Z- 、W2- 是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。
回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,它能溶于水并与水发生反应,试写出该反应的离子方程式 。
(2)①甲在工业上的一种用途是是 ;
②乙的化学式可能是 (写一种即可);若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是
;若W2-和Z-具有相同电子层结构,则乙的电子式是 。
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。
① 若以溶液C为电解质溶液时,正极的反应式为 ;
② 若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
。
解析:看到四种短周期元素的离子符号X+、Y3+ 、Z- 、W2-,结合题给要求,知X、Y、
Z、W四元素依次为Na、Al、Cl、O(或S)
答案:
(1)Cl2+H2O==H++Cl-+HClO
(2)①净水剂
② Na2O或Na2S Al3+ + 3 OH- = Al(OH)3↓(答案合理都给分)
(3)O2+2H2O+4e-=4OH- 4Al+3O2+4KOH=4KAlO2+2H2O
意义:表示化学反应进行快慢的量
化学反应
反应速率
表示方法:用单位时间内反应物浓度的减少或生成物浓度的增加来表示
单位:mol/(L min)或mol/(L s)
影响因素:
浓度
压强
温度
催化剂
其他因素:光、 颗粒大小、溶剂等
特征:逆、动、等、定、变
移动分析
原因:外界条件改变v(正)=v(逆)
方向:v(正)>v(逆)向正反应方向移动
v(正)移动的外因
浓度
压强
温度
勒夏特列原理
化学平衡(反应进行程度)
化学平衡常数
表达式:(新课程)
mA(g)+nB(g)pC(g)+qD(g)
影响因素:只与温度有关
质子 Z个
原子核
中子 (A-Z)个
核外电子 Z个
X
Y
Z
W
H2O
乙
溶液B,pH>7
甲
溶液A,pH<7
溶液C,pH =7
丙
【复习指南】
内容指要:本专题包括对元素周期表(长式)的结构(周期、族)的了解和元素周期律的实质的应用性掌握;能对化学反应速率的概念、反应速率的定量表示方法进行判断,能理解性甑别外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,明了化学平衡常数的含义,并能利用化学平衡常数进行简单的计算;能熟练运用电离和平衡原理分析和处理电解质溶液中的电离平衡、水解平衡及难溶电解质的溶解平衡及沉淀转化;能了解原电池和电解池工作原理,并能结合常见化学电源或新型电源写出电极反应和电池反应方程式。
教材回眸:请认真阅读高中化学必修2“第一章 物质结构 元素周期律”、必修1“第三章 金属极其重要化合物、第四章 非金属及其重要化合物”、高中化学必修2“第二章 第三节”、选修4“第二章 化学反应速率和化学平衡”、高中化学选修4“第三章 水溶液中的离子平衡”、高中化学必修2“第二章 第二节 化学能与电能”、选修4“第四章 电化学基础”等相关内容。
专题重点:
①外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,尤其是对表格、数据等呈现方式的辨析;②结合实例书写和计算平衡常数;③常见化学电源或新型电源的电极反应和电池反应方程式的书写以及金属的电化学腐蚀原理及防腐措施的列举;④突破以元素推断为切入口,与具体物质、其它概念原理、实验、计算相融合的新题型。
所需时间:共7课时,其中授课和课堂互动性练习5课时,习题讲评2课时。
【专题建构】
1.原子结构和元素周期律知识的综合网络
2.化学反应速率和化学平衡知识网络
3.电解质溶液和电化学知识网络
【查缺补漏】
1.注意备忘常见的“等电子数的粒子”
例1 用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种粒子(离子或分子)。请回答:
⑴A元素是 、B元素是 、C元素是 (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
⑸G分子中含有4个原子,其分子式是 。
⑹H分子中含有8个原子,其分子式是 。
解析:本题考查的是等电子粒子,如果熟练备忘了常见的10 e -、18e -粒子以及14 e -、16e -粒子,则解决起此类题来就较简单。
对于18电子粒子,可以根据元素在周期表中的相对位置确定,也可由9+9来确定,9e-(可由10e-来确定)的有-OH、-CH3、-NH2、-F等其两两结合也可以形成18电子粒子,如F2、H2O2、C2H6、CH3OH、CH3F。
答案:⑴K,Cl,S ⑵HCl ⑶F2 ⑷H2S H:S:H ⑸H2O2(或PH3)⑹C2H6
附:常见等电子数微粒
(1)“10电子”的微粒:
分子 离子
一核10电子的 Ne N3 、O2 、F 、Na+、Mg2+、Al3+
二核10电子的 HF OH
三核10电子的 H2O NH2
四核10电子的 NH3 H3O+
(2)“18电子”的微粒
分子 离子
一核18电子的 Ar K+、Ca2+、Cl 、S2
二核18电子的 F2、HCl O22-、HS
三核18电子的 H2S
四核18电子的 PH3、H2O2 、NH2F
五核18电子的 SiH4、CH3F 、NH2OH
六核18电子的 N2H4、CH3OH
其它粒子 C2H6 、CH3NH2 N2H5+、N2H62+
(3)其它等电子数的粒子
“9电子”的粒子: —F、—OH、—NH2、-CH3(取代基)
“14电子”的粒子:Si、N2、CO、C2H2
“2电子”的粒子:He、H—、Li+ 、Be2+
(4)质子数及核外电子总数均相等的粒子
①Na+、NH4+、H3O+ ②HS-、Cl- ③F-、OH-、NH2- ④N2、CO、C2H2
2.重视以图、表作为信息源类试题的“自悟”
例2 在2L密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(1)右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
(2)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
解析:(1)从n(NO)随时间变化表可得出,NO的物质的量随时间的推移而减小,NO与O2是反应物,NO2是生成物,NO2的变化曲线只能是a,b中的某一条。反应在3s之后,NO的物质的量不再发生变化,反应过程中NO减小0.013mol,根据方程式可知NO2增加0.013mol,而容器体积2L,所以达到平衡时,NO2的浓度0.065mol/L,曲线b符合。0~2s内,NO减少0.012mol,据反应方程,O2同时减少0.006mol,所以以O2来表示这段时间的平均速率=0.006mol÷2L÷2s=0.0015mol/(L.s)。
(2)a在达没达到平衡都成立,因为反应速率之比等于化学计量数之比。反应2NO(g)+O2(g)
2NO2(g)的反应前后气体分子数目不相等,平衡受压强的影响,压强改变,平衡要移动,b中压强已保持不变,所以b已达平衡状态。根据平衡状态的定义,正逆反应速率相等可得c也达平衡状态。密度等于质量除以体积,该反应的反应物和生成物均为气体,质量不变,而容器的体积2L,也不发生变化,所以任何条件下密度都不发生改变,d不能说明反应是否达到平衡状态。
(3)分离出NO2气体,反应速率减慢,加入催化剂,平衡不移动,升高温度该反应向逆向移动,所以a、b、d均错误。增大反应物O2的浓度,反应速率增大,平衡向正向移动,c正确。
答案:(1)b 1.5×10-3mol/(L.s)(2)b、c (3)c。
(4)4NH3+5NO4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO。
(5)①46%;②216kg。
3.在“两平衡”(电离平衡和水解平衡)与“两守恒”(电荷守恒和物料守恒)关系的融合上强化训练
例3 下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO)>c(NH)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
解析:A:根据溶液中电荷守恒知:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),当溶液pH=7时,
c(H+)= c(OH-),那么有:c(NH4+)=2c(SO42-) 则A不正确;B:醋酸是弱酸,不同浓度的醋酸其电离程度不同,当pH相差一个单位时,c1>10c2 B不正确;C、.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合时,醋酸过量,溶液显酸性,滴入石蕊溶液呈红色,C正确;
D、向0.1 mol/L的氨水中加入少量硫酸铵固体,氨水的电离平衡向逆方向移动,c(OH-)/c(NH3·H2O)减少。
答案:C。
4.抓住电化学命题中的四个“生长点”:即电极的判断、电极反应式的书写、溶液pH的计算或估算、电子移动的方向判断或计算
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入H2和O2,下解说法不正确的是( )
A.通入H2的电极为负极
B.通入O2的一极电极反应为4H2O+O2+8e=8OH-
C.随着放电的进行,负极附近pH上升
D.标准状况下通入5.6LO2完全反应后有1mol电子转移
解析:本题考点是原电池部分的基础知识,要求学会会判断电源的正负极,会正确书写电极反应式和总电池反应式,高考对这一问题会从两个方面进行考查:
一是根据给出的两个电极反应式,写总反应式:书写时注意使两个电极反应式得失电子数相等后相加两式,消去反应物和生成物中相同的物质即可。注意若反应式同侧出现不共存的离子,如H+和OH-,Pb2-和 SO42-,要写成反应后的物质如H2O和PbSO4。
二是给出总反应式,写电极反应式:
书写步骤为:1)列物质,标得失 2)选离了配电荷,3)配个数,巧用水,4)两式加验总式以氢氧燃料电池为例。已知总电池反应为2H2+O2=2H2O。电解质溶液为KOH溶液,试写出两极反应式。
负极书写步骤为:
1)根据总电池方程式列出总式两边化合价升高的有关物质,标出失去电子的数目:
2H2-4e→2H2O
2)根据电解质溶液的酸碱性,用H+或OH-或其他离子配平,使反应式两边电荷总数相等。
2H2+4OH--4e——2H2O
此时注意:①电子带负电,②在碱性电解质溶液中,电极反应式不宜出现H+,如上式写成2H2-2e——2H2O+4H+就不对了。③上式亦不能写成:2H2-4e——2H2O-4OH-,因为H2失电子,不可能出现OH-。
3)利用H2O使两边元素守恒,即 2H2+4OH--4e=4H2O
同理:正极电极反应式书写如下:
1),2)O2+4e——4OH-
3)O2+2H2O+4e=4OH-
4)将正负极电极方程式相加,若得到总反应式,说明写法正确。
答案:C
【专题聚焦】
第1讲 物质结构 元素周期律
1.用心构建原子的组成及各微粒间的关系网络
精要阐释:
原子
的含义:代表一个质量数为A,质子数为Z,中子数为(A-Z)的原子。
质量数(A)质子数(Z)中子数(N)
质子数核电荷数核外电子数原子序数
母题典范: 13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtǔWthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60 互为同素异形体
C.14N与15N互为同位素 D. 15N的核外电子数与中子数相同
思路与解析:本题属基础题,意在考查考生对含义的领悟情况,若要对选项做出快捷而准确地判断,需调用“质量数(A)质子数(Z)中子数(N)”和“质子数核电荷数核外电子数原子序数”加以判断。
元素符号左下角的可表示原子序数、原子核中的质子数或者电中性时原子核外的电子数;左上角的数字代表原子质量数,即质子数加中子数;右下角的数字可表示单质分子中的原子数。
答案:C
应对策略:原子中微粒数之间的关系一直是高考命题的热点之一。此类题以新发现的元素为载体,情景新颖,但难度不大。解答此类题目时:一是要掌握好各粒子之间的关系,即原子序数=核电荷数=核内质子数=核外电子数(原子中);质量数(X)=中子数(N)+质子数(Z),二是要掌握同位素、同素异形体、同分异构体等概念,正确区分它们研究的对象是致胜法宝。
变式练习 据报道2008年11月9日德国科学家利用数亿个镍原子(28Ni)对数亿个(82Pb)连续轰击数天后制得一种新原子110X(暂用X表示),它属于一种新元素—第110号元素。这种新元素是有史以来制得最重的元素,存在时间不到千分之一秒。经推知它属于过渡元素。下列关于该元素的叙述中正确的是( )
A.这种原子(110X)的中子数为110 B.这种元素肯定是金属元素
C.这种元素与铅属同一族 D.这种元素为第六周期元素
解析:A项,该原子的中子数为269-110=159,故A错;由该元素的原子序数为110,可根据推断元素在周期表中位置的方法,推知它位于第七周期第Ⅷ族,属于副族元素,故它肯定是金属元素,C、D错。
答案:B。
2.“位一构一性”之间的关系,是解决“表”、“律”问题的金钥匙
精要阐释:
母题典范:X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是( )
A.还原性:X的氧化物>Y的氧化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX2、M2Y中都含有共价键
D.Z元素的最高价氧化物的水化物的化学式为HZO4
点拨:本题主要考查元素周期律的应用,此类题目一般难度不大,解题的关键是要理解元素周期律的实质,并掌握原子半径、核外电子排布、元素化合价及元素的金属性、非金属性的递变规律。特别是要灵活运用1—18号元素的原子(或离子)结构特点及有关规律进行分析推断。
思路与解析:X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,则Y为硫元素,Z为氯元素。其最高价氧化物的水化物为HClO4。三种元素中S元素的非金属性最弱,因此其氢化物的还原性最强。根据M2Y又因为X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大判断M为钾元素,SO2为共价化合物含共价键,而K2S属于离子化合物,只含离子键。
答案:D
应对策略: 记住这些元素周期表中特殊位置的元素吧,关键时候,或许能给你带来意
想不到的作用的。
①族序数等于周期数的元素:H、Be、Al;
②族序数等于周期数2倍的元素:C、S;
③族序数等于周期数3倍的元素:O;
④周期数是族序数2倍的元素:Li;
⑤周期数是族序数3倍的元素是:Na;
⑥最高正价不等于族序数的元素是:O、F。
变式练习 X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子
半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
解析:从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W是Mg元素,R是S元素。所以,A项,Y、Z、W具有相同电子层结构的离子(O2-、Na+、Mg2+),其半径依次减小(判断依据:核外电子排布相同的微粒,半径随着核电荷数的增加而减小);B项,X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2);C项,元素Y、R分别与元素X形成的化合物是氢化物,因为Y(O元素)和R(S元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:XmY>XmR;W元素最高价氧化物的水化物是Mg(OH)2,是中强碱,而R元素最高价氧化物的水化物是H2SO4,是强酸。
答案:C
【限时演练】
1.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为( )
A.39∶61 B.61∶39 C.1∶1 D.39∶11
2. 下列说法正确的是( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
解析:金属元素也能形成含氧酸及其含氧酸盐,如高锰酸钾;氧、氟两非金属元素不能形成含氧酸。许多含氧酸如碳酸、磷酸不具有强氧化性,故B、C、D均不正确。
答案:A
3.已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置
如下图所示,下列说法正确的是( )
A.Z元素的原子半径可能比Y元素的小
B.Z元素的最高化合价可能比Y元素的高
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
解析:根据表格,知该四种元素应属于二、三周期,且是第三主族至七主族。如果Y为F,则Z为P,故B成立。
答案:B
4.某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
A.X的最高价含氧酸的分子式可表示为H3XO4
B.X是第二周期ⅤA族元素
C.X是第二周期ⅥA族元素
D.X的最高化合价为+4
解析:此题考查了原子结构、元素在周期表中的位置与物质性质的关系。最高价含氧酸的相对分子质量为98的酸常见有两种:硫酸和磷酸。且磷元素的氢化物的分子式不是H2X,而是PH3,故X应为磷。
答案:A
5.下列选项中所涉及到的两个量的一定相等的是( )
A.11.2LCl2与4.25gNH3所含有的原子数
B.18.0g重水(D2O)与20gNe所含有的电子数
C.标准状况下36gH2O与1.204×1024个O2分子所占的体积
D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
解析:参加反应的Al的物质的量相等,反应中失去的电子数必然相等。
答案:D
6.某短周期元素的最高价氧化物所对应的水化物的化学式为HxROY,气态氢化物的化学式为HzR(或RHZ)。已知1molHxROY比lmolHzR质量多64g。下列说法不正确的是( )
A.2Y—X+Z=8 B.Y=4
C.R一定是硫元素 D.R一定处于第三周期
解析:最高价氧化物所对应的水化物的化学式为HxROY,可得R的最高正价为2Y-X,气态氢化物的化学式为HzR,最低负价为-Z,可得2Y-X+Z=8。1molHxROY比lmolHzR质量多64g,可得X+R+16Y-Z-R=16,联立解得X=Z,Y=4,R为短周期元素,有H4SiO4、SiH4;H2SO4、H2S,R可能为S,也可能为Si,C不正确。
答案:C
7.第四周期某主族元素的原子,它的最外电子层上有两个电子,下列关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.原子半径比镁的原子半径大 D.碳酸盐易溶于水
解析:处于第四周期的主族元素的原子,其最外电子层上有两个电子,说明该元素是Ca,它的原子半径比钾的原子半径小,但比镁的原子半径大;氯化钙能溶于水,碳酸钙难溶于水。
答案:C
8.下列叙述正确的是( )
① 7Li+中含有的中子数与电子数之比为2︰1
② 在C2H6分子中极性共价键与非极性共价键数之比为3︰1
③ 常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1
④ 5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1
A.① ② B.② ③ C.① ③ D.③ ④
解析:①中7Li+的中子数为“7-3=4”,而电子数为2,两者之比刚好为2 :1,①正确;
在C2H6分子中极性共价键为6,非极性共价键数为1,两者之比应为6 :1,②错;不
管何条件下甲烷气体中含有的氢、碳原子数之比总是为4︰1,③对;5.6 g铁即0.1mol铁与足量的氯气反应时铁失去0.3mol电子,即两者之比应为3 :1,④有误。所以,正确组合为C。
答案:C。
9.A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是
由5个原子核组成的粒子。它们之间可发生如下变化:A+B====C+D;B+E====2D,且D与大多数酸性氧化物及碱性氧化物均能反应。
(1)写出A的电子式_______;写出E的电子式_______。
(2)B的化学式为_______;C的化学式为__________;D的化学式为__________;E的化学式为_______。
(3)用电子式表示D的形成过程_______________________________________________。
解析:能与酸性氧化物(如CO2、SO2等)、碱性氧化物(如Na2O、CaO 等)反应的物质应为H2O。由5个原子核组成的粒子常见的有CH4、NH,根据给定的反应式可确定10电子的分子或离子。NH+OH-= NH3+H2O,OH-+H3O+ = 2H2O。
答案:(1)[H H]+ [HH]+
(2)OH- NH3 H2O H3O+
(3)H HHH
10.根据元素周期表1—20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有
___________(填两种化合物的化学式);
(2)属于稀有气体的是___________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是____________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)______________;
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
Na (5)NH3;SiH4
11.已知X+、Y3+ 、Z- 、W2- 是短周期元素X、Y、Z、W形成的离子,下图中的甲、乙、丙均是由上述四种离子中的两种组成的化合物。
回答下列问题:
(1)通常状况下,Z的单质是一种黄绿色气体,它能溶于水并与水发生反应,试写出该反应的离子方程式 。
(2)①甲在工业上的一种用途是是 ;
②乙的化学式可能是 (写一种即可);若将溶液A与溶液B混合,产生白色沉淀,则该反应的离子方程式是
;若W2-和Z-具有相同电子层结构,则乙的电子式是 。
(3)Y单质可用来制造Y—空气燃料电池,该电池通常以溶液C或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。
① 若以溶液C为电解质溶液时,正极的反应式为 ;
② 若以氢氧化钾溶液为电解质溶液时,电池的总反应式为
。
解析:看到四种短周期元素的离子符号X+、Y3+ 、Z- 、W2-,结合题给要求,知X、Y、
Z、W四元素依次为Na、Al、Cl、O(或S)
答案:
(1)Cl2+H2O==H++Cl-+HClO
(2)①净水剂
② Na2O或Na2S Al3+ + 3 OH- = Al(OH)3↓(答案合理都给分)
(3)O2+2H2O+4e-=4OH- 4Al+3O2+4KOH=4KAlO2+2H2O
意义:表示化学反应进行快慢的量
化学反应
反应速率
表示方法:用单位时间内反应物浓度的减少或生成物浓度的增加来表示
单位:mol/(L min)或mol/(L s)
影响因素:
浓度
压强
温度
催化剂
其他因素:光、 颗粒大小、溶剂等
特征:逆、动、等、定、变
移动分析
原因:外界条件改变v(正)=v(逆)
方向:v(正)>v(逆)向正反应方向移动
v(正)
浓度
压强
温度
勒夏特列原理
化学平衡(反应进行程度)
化学平衡常数
表达式:(新课程)
mA(g)+nB(g)pC(g)+qD(g)
影响因素:只与温度有关
质子 Z个
原子核
中子 (A-Z)个
核外电子 Z个
X
Y
Z
W
H2O
乙
溶液B,pH>7
甲
溶液A,pH<7
溶液C,pH =7
丙
同课章节目录
