高中化学 沪科版 高二上学期 8.1.1 铁的化合物课件(共17张PPT)
文档属性
| 名称 | 高中化学 沪科版 高二上学期 8.1.1 铁的化合物课件(共17张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-09 15:18:53 | ||
图片预览




文档简介
(共17张PPT)
铁及其化合物在生活中的存在
——
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
+2价
+3价
+2价、+3价
不溶
不溶
不溶
不稳定
稳定
稳定
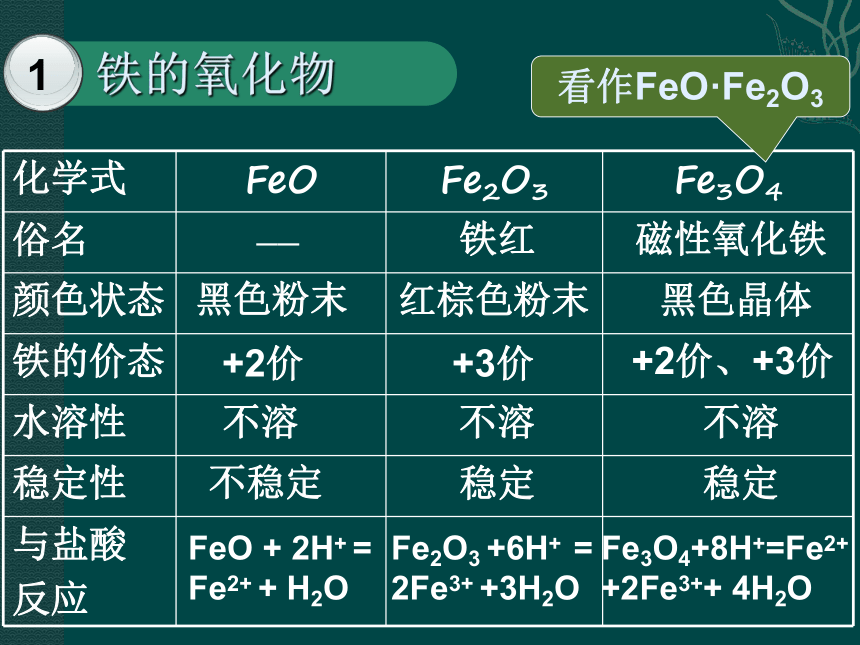
FeO
+
2H+
=
Fe2+
+
H2O
Fe2O3
+6H+
=
2Fe3+
+3H2O
Fe3O4+8H+=Fe2+
+2Fe3++
4H2O
看作FeO·Fe2O3
化学式
FeO
Fe2O3
Fe3O4
俗名
颜色状态
铁的价态
水溶性
稳定性
与盐酸
反应
白色絮状沉淀→灰绿色→红褐色沉淀
红褐色沉淀
Fe3+
+
3OH-
=
Fe(OH)3?
Fe2+
+2OH-=Fe(OH)2?
……
棕黄色溶液
浅绿色溶液
FeCl3溶液
FeSO4溶液
加NaOH
溶液
离子
方程式
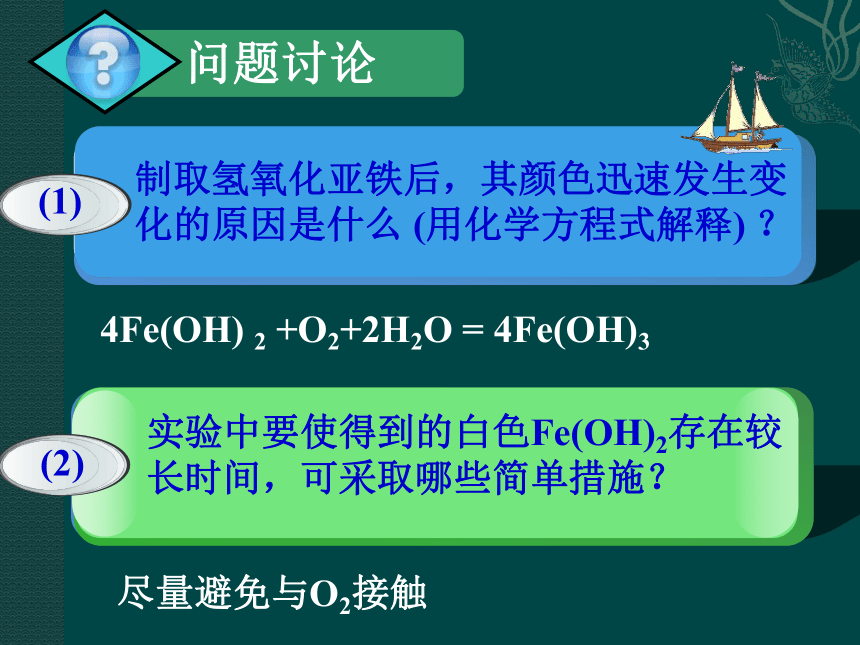
4Fe(OH)
2
+O2+2H2O
=
4Fe(OH)3
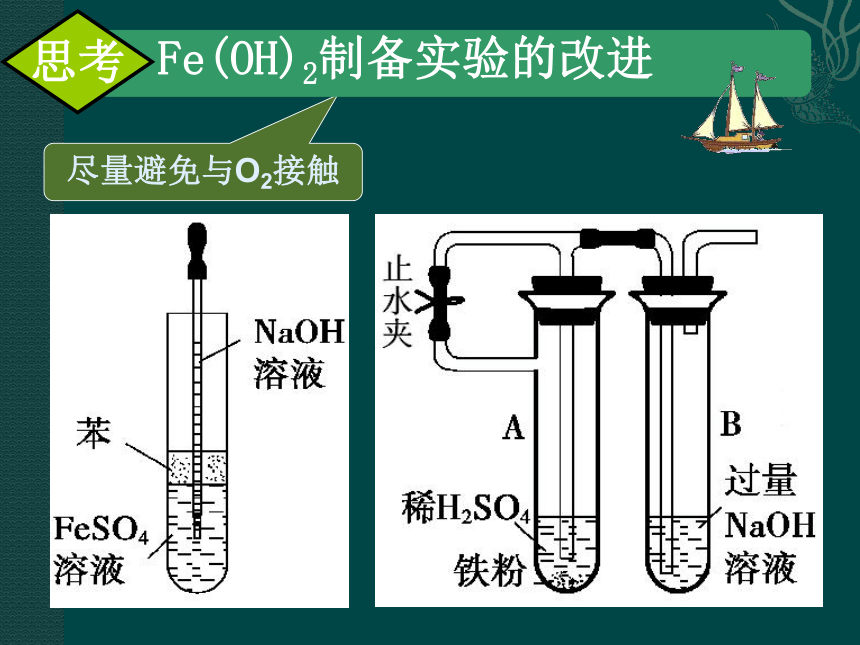
尽量避免与O2接触
尽量避免与O2接触
难溶于水
红褐色固体
白色固体
难溶于水
Fe(OH)2
+
2H+
=
Fe2+
+
2H2O
Fe(OH)3+
3H+
=
Fe3+
+
3H2O
——————
Fe(OH)3
Fe(OH)2
颜色状态
溶解性
与酸反应的离子方程式
受热分解
溶液呈血红色
溶液颜色无变化
FeCl2
FeCl3
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液不显血红色
溶液变成血红色
2Fe2++Cl2
=
2Fe3++2Cl?
2Fe3+
+
Fe
=
3Fe2+
现象
反应的离子方程式
FeCl3溶液中加入铁粉、KSCN溶液
上层清液加氯水,振荡
氧化剂:
Cl2,O2,KMnO4,
H2O2
还原剂:
Fe,
Zn,
KI
Fe3+
Fe2+
课堂练习
为什么?
课堂总结
铁及其化合物在生活中的存在
——
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
+2价
+3价
+2价、+3价
不溶
不溶
不溶
不稳定
稳定
稳定
FeO
+
2H+
=
Fe2+
+
H2O
Fe2O3
+6H+
=
2Fe3+
+3H2O
Fe3O4+8H+=Fe2+
+2Fe3++
4H2O
看作FeO·Fe2O3
化学式
FeO
Fe2O3
Fe3O4
俗名
颜色状态
铁的价态
水溶性
稳定性
与盐酸
反应
白色絮状沉淀→灰绿色→红褐色沉淀
红褐色沉淀
Fe3+
+
3OH-
=
Fe(OH)3?
Fe2+
+2OH-=Fe(OH)2?
……
棕黄色溶液
浅绿色溶液
FeCl3溶液
FeSO4溶液
加NaOH
溶液
离子
方程式
4Fe(OH)
2
+O2+2H2O
=
4Fe(OH)3
尽量避免与O2接触
尽量避免与O2接触
难溶于水
红褐色固体
白色固体
难溶于水
Fe(OH)2
+
2H+
=
Fe2+
+
2H2O
Fe(OH)3+
3H+
=
Fe3+
+
3H2O
——————
Fe(OH)3
Fe(OH)2
颜色状态
溶解性
与酸反应的离子方程式
受热分解
溶液呈血红色
溶液颜色无变化
FeCl2
FeCl3
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液不显血红色
溶液变成血红色
2Fe2++Cl2
=
2Fe3++2Cl?
2Fe3+
+
Fe
=
3Fe2+
现象
反应的离子方程式
FeCl3溶液中加入铁粉、KSCN溶液
上层清液加氯水,振荡
氧化剂:
Cl2,O2,KMnO4,
H2O2
还原剂:
Fe,
Zn,
KI
Fe3+
Fe2+
课堂练习
为什么?
课堂总结
