2020年全国卷Ⅲ理综化学高考试题(word版,含答案)
文档属性
| 名称 | 2020年全国卷Ⅲ理综化学高考试题(word版,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-09 14:41:51 | ||
图片预览


文档简介
绝密★启用前
2020年普通高等学校招生全国统一考试
理科综合能力测试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H
1
C
12
N
14
O
16
Mg
24
S
32
Fe
56
Cu
64
一、选择题:本题共13个小题,每小题6分。共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。下列说法错误的是
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱
D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3
8.金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如下:
下列关于金丝桃苷的叙述,错误的是
A.可与氢气发生加成反应
B.分子含21个碳原子
C.能与乙酸发生酯化反应
D.不能与金属钠反应
9.NA是阿伏加德罗常数的值。下列说法正确的是
A.22.4
L(标准状况)氮气中含有7NA个中子
B.1
mol重水比1
mol水多NA个质子
C.12
g石墨烯和12
g金刚石均含有NA个碳原子
D.1
L
1
mol·L?1
NaCl溶液含有28NA个电子
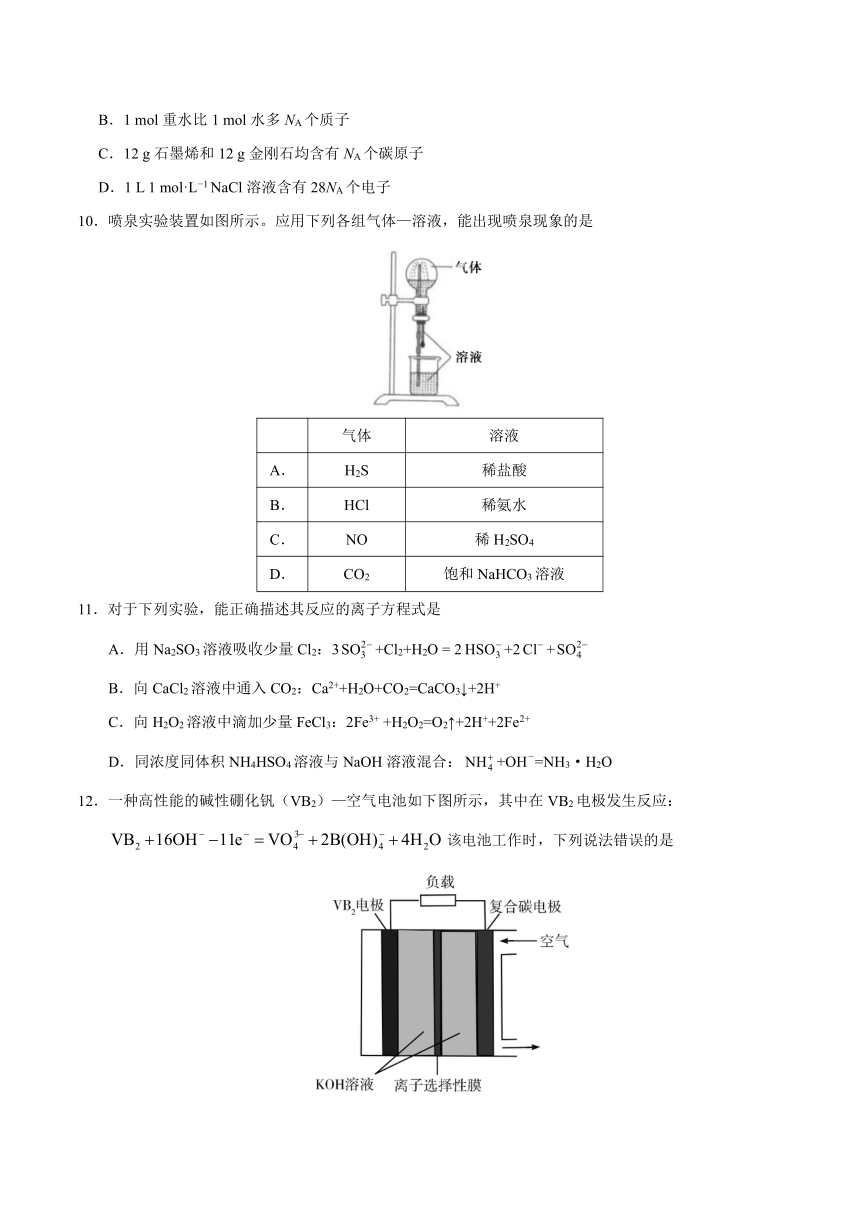
10.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
气体
溶液
A.
H2S
稀盐酸
B.
HCl
稀氨水
C.
NO
稀H2SO4
D.
CO2
饱和NaHCO3溶液
11.对于下列实验,能正确描述其反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3+Cl2+H2O
=
2+2+
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3+
+H2O2=O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:+OH-=NH3·H2O
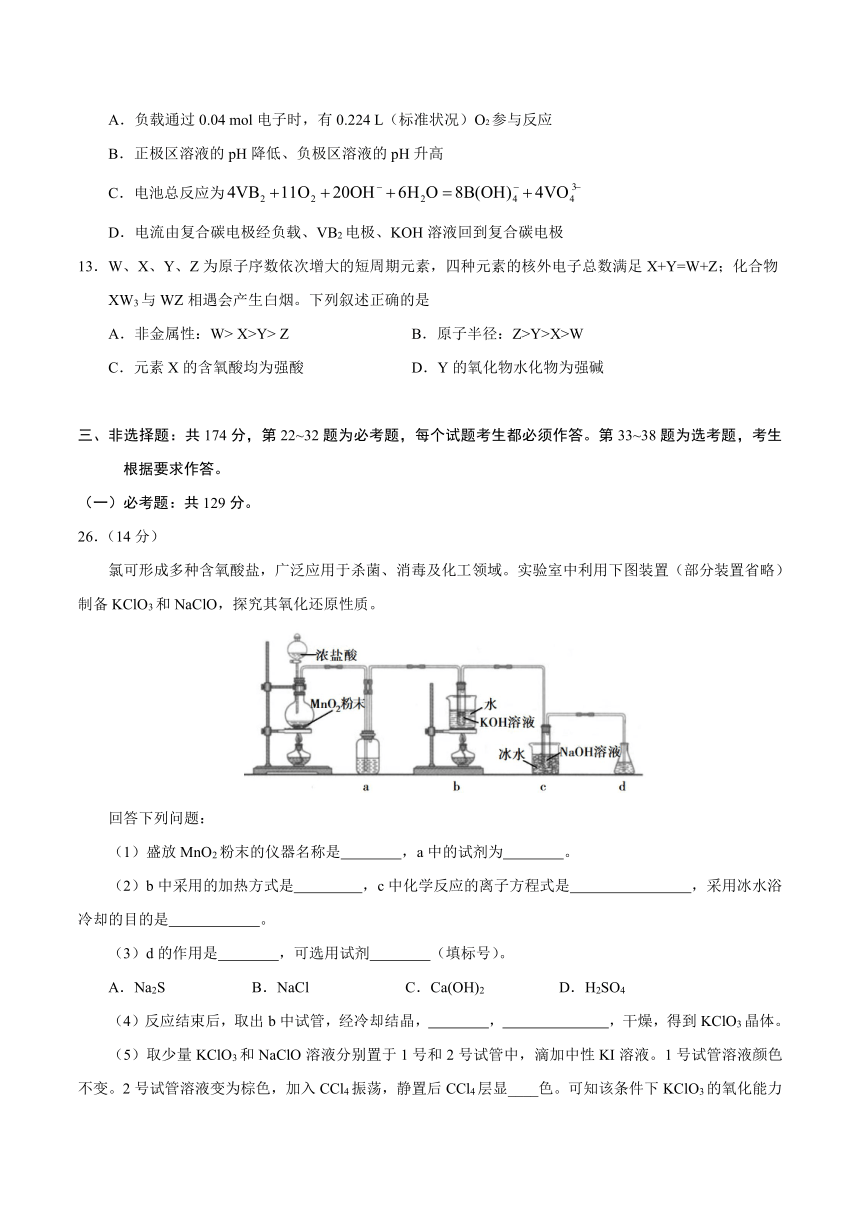
12.一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:
该电池工作时,下列说法错误的是
A.负载通过0.04
mol电子时,有0.224
L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
13.W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
A.非金属性:W>
X>Y>
Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
三、非选择题:共174分,第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(14分)
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是
,a中的试剂为
。
(2)b中采用的加热方式是
,c中化学反应的离子方程式是
,采用冰水浴冷却的目的是
。
(3)d的作用是
,可选用试剂
(填标号)。
A.Na2S
B.NaCl
C.Ca(OH)2
D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,
,
,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”或“小于")。
27.(15分)
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时(c=0.01
mol·L?1)的pH沉淀完全时(c=1.0×10?5
mol·L?1)的pH
7.28.7
3.74.7
2.23.2
7.59.0
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________。
(2)“滤液②”中含有的金属离子是______________。
(3)“转化”中可替代H2O2的物质是______________。若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为______________。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0
mol·L?1,则“调pH”应控制的pH范围是______________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________。
28.(14分)
二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________。当反应达到平衡时,若增大压强,则n(C2H4)___________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是______、______。CO2催化加氢合成C2H4反应的ΔH______0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________(MPa)?3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(2)NH3BH3分子中,N—B化学键称为____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:
3NH3BH3+6H2O=3NH3++9H2
的结构为。在该反应中,B原子的杂化轨道类型由______变为______。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
(4)研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a
pm、b
pm、c
pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ=___________
g·cm?3(列出计算式,设NA为阿伏加德罗常数的值)。
36.[化学——选修5:有机化学基础](15分)
苯基环丁烯酮(
PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
已知如下信息:
回答下列问题:
(1)A的化学名称是___________。
(2)B的结构简式为___________。
(3)由C生成D所用的试别和反应条件为___________;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C8H8O2的副产物,该副产物的结构简式为________。
(4)写出化合物E中含氧官能团的名称__________;E中手性碳(注:连有四个不同的原子或基团的碳)的个数为___________。
(5)M为C的一种同分异构体。已知:1
mol
M与饱和碳酸氢钠溶液充分反应能放出2
mol二氧化碳;M与酸性高锰酸钾溶液反应生成对苯二甲酸。M的结构简式为__________。
(6)对于,选用不同的取代基R',在催化剂作用下与PCBO发生的[4+2]反应进行深入研究,R'对产率的影响见下表:
R'
—CH3
—C2H5
—CH2CH2C6H5
产率/%
91
80
63
请找出规律,并解释原因___________。
2020年普通高等学校招生全国统一考试
理科综合
化学参考答案
7.C
8.D
9.C
10.B
11.A
12.B
13.D
26.(14分)(1)圆底烧瓶
饱和食盐水
(2)水浴加热
Cl2+2OH?=ClO?+Cl?+H2O
避免生成NaClO3
(3)吸收尾气(Cl2)
AC
(4)过滤
少量(冷)水洗涤
(5)紫
小于
27.(15分)
(1)除去油脂,溶解铝及其氧化物
+H+=Al(OH)3↓+H2O
(2)Ni2+、Fe2+、Fe3+
(3)O2或空气
Fe3+
(4)0.01×(107.2?14)2[或10?5×(108.7?14)2]
3.2~6.2
(5)2Ni2++ClO?+4OH?=2NiOOH↓+
Cl?+H2O
(6)提高镍回收率
28.(14分)
(1)1∶4
变大
(2)d
c
小于
(3)或等
(4)选择合适催化剂等
35.(15分)
(1)B
Si(硅)
(2)配位
N
sp3
sp2
(3)N>H>B
CH3CH3
低
Hδ+与Hδ?的静电引力
(4)
36.(15分)
(1)2?羟基苯甲醛(水杨醛)
(2)
(3)乙醇、浓硫酸/加热
(4)羟基、酯基
2
(5)
(6)随着R'体积增大,产率降低;原因是R'体积增大,位阻增大
2020年普通高等学校招生全国统一考试
理科综合能力测试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H
1
C
12
N
14
O
16
Mg
24
S
32
Fe
56
Cu
64
一、选择题:本题共13个小题,每小题6分。共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。下列说法错误的是
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱
D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3
8.金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如下:
下列关于金丝桃苷的叙述,错误的是
A.可与氢气发生加成反应
B.分子含21个碳原子
C.能与乙酸发生酯化反应
D.不能与金属钠反应
9.NA是阿伏加德罗常数的值。下列说法正确的是
A.22.4
L(标准状况)氮气中含有7NA个中子
B.1
mol重水比1
mol水多NA个质子
C.12
g石墨烯和12
g金刚石均含有NA个碳原子
D.1
L
1
mol·L?1
NaCl溶液含有28NA个电子
10.喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
气体
溶液
A.
H2S
稀盐酸
B.
HCl
稀氨水
C.
NO
稀H2SO4
D.
CO2
饱和NaHCO3溶液
11.对于下列实验,能正确描述其反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3+Cl2+H2O
=
2+2+
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3+
+H2O2=O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:+OH-=NH3·H2O
12.一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:
该电池工作时,下列说法错误的是
A.负载通过0.04
mol电子时,有0.224
L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
13.W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
A.非金属性:W>
X>Y>
Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
三、非选择题:共174分,第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。
(一)必考题:共129分。
26.(14分)
氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是
,a中的试剂为
。
(2)b中采用的加热方式是
,c中化学反应的离子方程式是
,采用冰水浴冷却的目的是
。
(3)d的作用是
,可选用试剂
(填标号)。
A.Na2S
B.NaCl
C.Ca(OH)2
D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,
,
,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____色。可知该条件下KClO3的氧化能力____NaClO(填“大于”或“小于")。
27.(15分)
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时(c=0.01
mol·L?1)的pH沉淀完全时(c=1.0×10?5
mol·L?1)的pH
7.28.7
3.74.7
2.23.2
7.59.0
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________。
(2)“滤液②”中含有的金属离子是______________。
(3)“转化”中可替代H2O2的物质是______________。若工艺流程改为先“调pH”后“转化”,即,“滤液③”中可能含有的杂质离子为______________。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0
mol·L?1,则“调pH”应控制的pH范围是______________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________。
28.(14分)
二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________。当反应达到平衡时,若增大压强,则n(C2H4)___________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是______、______。CO2催化加氢合成C2H4反应的ΔH______0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________(MPa)?3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是______。根据对角线规则,B的一些化学性质与元素______的相似。
(2)NH3BH3分子中,N—B化学键称为____键,其电子对由____提供。氨硼烷在催化剂作用下水解释放氢气:
3NH3BH3+6H2O=3NH3++9H2
的结构为。在该反应中,B原子的杂化轨道类型由______变为______。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________。与NH3BH3原子总数相等的等电子体是_________(写分子式),其熔点比NH3BH3____________(填“高”或“低”),原因是在NH3BH3分子之间,存在____________________,也称“双氢键”。
(4)研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a
pm、b
pm、c
pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ=___________
g·cm?3(列出计算式,设NA为阿伏加德罗常数的值)。
36.[化学——选修5:有机化学基础](15分)
苯基环丁烯酮(
PCBO)是一种十分活泼的反应物,可利用它的开环反应合成一系列多官能团化合物。近期我国科学家报道用PCBO与醛或酮发生[4+2]环加成反应,合成了具有生物活性的多官能团化合物(E),部分合成路线如下:
已知如下信息:
回答下列问题:
(1)A的化学名称是___________。
(2)B的结构简式为___________。
(3)由C生成D所用的试别和反应条件为___________;该步反应中,若反应温度过高,C易发生脱羧反应,生成分子式为C8H8O2的副产物,该副产物的结构简式为________。
(4)写出化合物E中含氧官能团的名称__________;E中手性碳(注:连有四个不同的原子或基团的碳)的个数为___________。
(5)M为C的一种同分异构体。已知:1
mol
M与饱和碳酸氢钠溶液充分反应能放出2
mol二氧化碳;M与酸性高锰酸钾溶液反应生成对苯二甲酸。M的结构简式为__________。
(6)对于,选用不同的取代基R',在催化剂作用下与PCBO发生的[4+2]反应进行深入研究,R'对产率的影响见下表:
R'
—CH3
—C2H5
—CH2CH2C6H5
产率/%
91
80
63
请找出规律,并解释原因___________。
2020年普通高等学校招生全国统一考试
理科综合
化学参考答案
7.C
8.D
9.C
10.B
11.A
12.B
13.D
26.(14分)(1)圆底烧瓶
饱和食盐水
(2)水浴加热
Cl2+2OH?=ClO?+Cl?+H2O
避免生成NaClO3
(3)吸收尾气(Cl2)
AC
(4)过滤
少量(冷)水洗涤
(5)紫
小于
27.(15分)
(1)除去油脂,溶解铝及其氧化物
+H+=Al(OH)3↓+H2O
(2)Ni2+、Fe2+、Fe3+
(3)O2或空气
Fe3+
(4)0.01×(107.2?14)2[或10?5×(108.7?14)2]
3.2~6.2
(5)2Ni2++ClO?+4OH?=2NiOOH↓+
Cl?+H2O
(6)提高镍回收率
28.(14分)
(1)1∶4
变大
(2)d
c
小于
(3)或等
(4)选择合适催化剂等
35.(15分)
(1)B
Si(硅)
(2)配位
N
sp3
sp2
(3)N>H>B
CH3CH3
低
Hδ+与Hδ?的静电引力
(4)
36.(15分)
(1)2?羟基苯甲醛(水杨醛)
(2)
(3)乙醇、浓硫酸/加热
(4)羟基、酯基
2
(5)
(6)随着R'体积增大,产率降低;原因是R'体积增大,位阻增大
同课章节目录
