人教版高中化学必修一 2.3氧化还原反应3--氧化还原反应的规律(共21张PPT)
文档属性
| 名称 | 人教版高中化学必修一 2.3氧化还原反应3--氧化还原反应的规律(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 483.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-12 21:18:26 | ||
图片预览







文档简介
(共21张PPT)
第二章
化学物质及其变化
第三节
氧化还原反应
第三课时
氧化还原反应的基本规律
回顾知识
1、氧化还原反应的定义、特征和本质
2、氧化剂、还原剂的概念以及区别和联系
具有还原性
具有氧化性
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得到电子,化合价降低,还原反应,被还原
失去电子,化合价升高,氧化反应,被氧化
Click
to
add
title
in
here
Click
to
add
title
in
here
1
氧化剂和还原剂
种类
实例
活泼的非金属单质
能电离出H+的物质
不活泼金属的阳离子
某些含高价态元素的物质
过氧化物
二、常见的氧化剂和还原剂
(一)常见的氧化剂
F2、Cl2、Br2、I2、O2、S、N2
HCl、H2SO4、NaHSO4
Ag+、Cu2+、Hg2+、Fe3+
MnO2、KMnO4、H2SO4(浓)、HNO3、KClO3
Na2O2、H2O2
Click
to
add
title
in
here
Click
to
add
title
in
here
1
氧化剂和还原剂
二、常见的氧化剂和还原剂
(一)常见的还原剂
种类
实例
金属单质
某些非金属单质
含较低价态元素的物质
Na、Mg、Al、Zn、Fe、K、Ca、Ba、Fe、Cu
H2、C、P、S
CO、SO2、HCl、H2S、FeCl2、Na2SO3
一、物质氧化性、还原性的强弱判断
方法1:根据方程式判断
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
氧化剂
+
还原剂
=
还原产物
+
氧化产物
一、物质氧化性、还原性的强弱判断
方法1:根据方程式判断
示例:2Fe3+
+
2I-
=
2Fe2+
+
I2
,
Br2
+
2Fe2+=2Br-
+
2Fe3+
氧化性由强到弱的顺序是:
>
>
;
还原性由强到弱的顺序是:
>
>
。
Br2
Fe3+
I2
I-
Fe2+
Br-
一、物质氧化性、还原性的强弱判断
方法2:根据物质活动性顺序判断
(1)金属活动性顺序(常见元素)
(2)非金属活泼性顺序(常见元素)
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
原子还原性逐渐减弱,对应阳离子氧化性逐渐增强
氧化性:
F2>O2>Cl2>Br2>I2>S
还原性:F-一、物质氧化性、还原性的强弱判断
方法3:由反应条件的难易判断
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。
示例:
2KMnO4
+
16HCl(浓)====
2KCl
+
2MnCl2
+
5Cl2↑+
8H2O
MnO2
+
4HCl(浓)====
MnCl2
+
Cl2↑+
2H2O
4HCl
+
O2
====
2H2O
+
2Cl2
由上述反应条件的不同,
可判断氧化性:
>
>
。
催化剂
KMnO4
MnO2
O2
一、物质氧化性、还原性的强弱判断
方法4:由根据还原产物或氧化产物的价态高低判断
示例:
例1、KMnO4+A→Mn(+4)
KMnO4+B→Mn(+2)
则A、B还原性比较为:
>
;
例2、
Fe+2HCl==FeCl2+H2
2Fe+3Cl2==2FeCl3
则可以判断氧化性:
>
。
B
A
Cl2
HCl
一、物质氧化性、还原性的强弱判断
Cu
+
4(浓)HNO3
=
Cu(NO3)2
+
2NO2↑
+
2H2O
3Cu
+
8(稀)HNO3
=
3Cu(NO3)2
+
2NO↑
+
4H2O
【注】
氧化
(还原)
性强弱只取决于的是电子的难易,
而不是多少
+5
+5
+2
+4
二、氧化还原反应的基本规律
规律1:价态规律
①处于最高价态时
示例:
在Fe、Fe2+、Fe3+、Cl2、Cl-、ClO-、S、S2—、SO2、H2S、H2SO4(从S的角度来看)中,只有氧化性的是
,只有还原性的是
,既有氧化性,又有还原性的是
。
Fe3+,H2SO4
Fe,Cl-,S2—,H2S
Fe2+,Cl2,
ClO-,
S,SO2
③处于最低价态时
②处于中间价态时
降、得、还
(氧化剂)
具有氧化性
二、氧化还原反应的基本规律
规律1:价态规律
(2)
同种元素相邻价态间不发生氧化还原反应,同种元素不同价态间发生氧化还原反应时化合价只靠拢不交叉。
示例:
H2S
+
H2SO4(浓)
=
S↓+
SO2↑
+
2
H2O
中化合价变化是:
。
判断氧化还原反应能否发生及表明电子转移情况。
二、氧化还原反应的基本规律
规律2:先后规律
氧化剂只有一种,还原剂有多种,则还原性强的先被氧化;还原剂只有一种,氧化剂有多种,则氧化性强的先被还原。
判断物质的稳定性及其反应顺序
二、氧化还原反应的基本规律
规律2:先后规律
示例:
1、在CuSO4和AgNO3的混合溶液中加入适量铁粉,_______先被置换出来,_______后被置换出来。
2、在FeBr2溶液中通入Cl2由少至多,先看到溶液变黄色(生成
),后看到溶液变橙色(生成
),则还原性Fe2+_____Br-。
Cu
Ag
Fe3+
Br2
>
二、氧化还原反应的基本规律
规律3:守恒规律
氧化剂得到的电子总数等于还原剂失去的电子总数,即电子守恒。化合价升降总数也等于电子转移总数,故氧化剂中元素化合价降低总数等于还原剂中元素化合价升高总数。
可进行氧化还原反应方程式配平和有关计算
三、氧化还原反应的类型
1.部分发生氧化还原反应
2.歧化反应
3.归中反应
3Cu
+
8(稀)HNO3
=
3Cu(NO3)2
+
2NO↑
+
4H2O
2H2O2
=
2H2O
+
O2↑
催化剂
O:-1
-2
0
(只靠近不交叉)
H2S
+
H2SO4(浓)
=
S↓+
SO2↑
+
2H2O
二、氧化还原反应的基本规律
氧化还原反应的表示方法:
1、双线桥法:用箭头表示同一元素的原子或离子得到或失去电子的结果。在线上标出“失去”或“得到”电子的数目,一条箭头由氧化剂指向还原产物,另一条由还原剂指向氧化产物。
Fe+2HCl==FeCl2+H2
失去2e-
得到2
x
e-
示例:
Fe+2HCl==FeCl2+H2
练习:
MnO2
+
4HCl(浓)==
MnCl2
+
Cl2↑+
2H2O
二、氧化还原反应的基本规律
氧化还原反应的表示方法:
2、单线桥法:用箭头表示反应物中不同(或相同)原子或离子间的电子转移。在线上标出电子转移的总数,箭头指出电子转移的方向,即箭头由还原剂指向氧化剂。
Fe+2HCl==FeCl2+H2
2e-
示例:
Fe+2HCl==FeCl2+H2
练习:
MnO2
+
4HCl(浓)==
MnCl2
+
Cl2↑+
2H2O
幻想是保持心情愉快的一种方法
第二章
化学物质及其变化
第三节
氧化还原反应
第三课时
氧化还原反应的基本规律
回顾知识
1、氧化还原反应的定义、特征和本质
2、氧化剂、还原剂的概念以及区别和联系
具有还原性
具有氧化性
氧化剂
+
还原剂
=
还原产物
+
氧化产物
得到电子,化合价降低,还原反应,被还原
失去电子,化合价升高,氧化反应,被氧化
Click
to
add
title
in
here
Click
to
add
title
in
here
1
氧化剂和还原剂
种类
实例
活泼的非金属单质
能电离出H+的物质
不活泼金属的阳离子
某些含高价态元素的物质
过氧化物
二、常见的氧化剂和还原剂
(一)常见的氧化剂
F2、Cl2、Br2、I2、O2、S、N2
HCl、H2SO4、NaHSO4
Ag+、Cu2+、Hg2+、Fe3+
MnO2、KMnO4、H2SO4(浓)、HNO3、KClO3
Na2O2、H2O2
Click
to
add
title
in
here
Click
to
add
title
in
here
1
氧化剂和还原剂
二、常见的氧化剂和还原剂
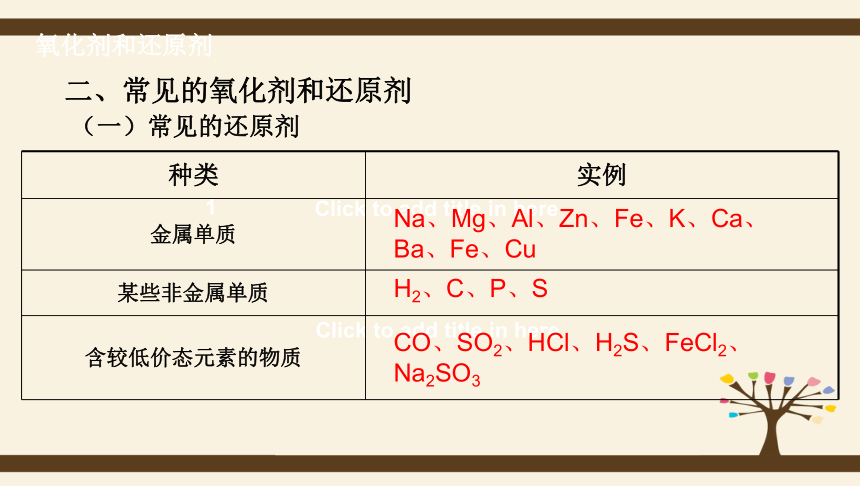
(一)常见的还原剂
种类
实例
金属单质
某些非金属单质
含较低价态元素的物质
Na、Mg、Al、Zn、Fe、K、Ca、Ba、Fe、Cu
H2、C、P、S
CO、SO2、HCl、H2S、FeCl2、Na2SO3
一、物质氧化性、还原性的强弱判断
方法1:根据方程式判断
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
氧化剂
+
还原剂
=
还原产物
+
氧化产物
一、物质氧化性、还原性的强弱判断
方法1:根据方程式判断
示例:2Fe3+
+
2I-
=
2Fe2+
+
I2
,
Br2
+
2Fe2+=2Br-
+
2Fe3+
氧化性由强到弱的顺序是:
>
>
;
还原性由强到弱的顺序是:
>
>
。
Br2
Fe3+
I2
I-
Fe2+
Br-
一、物质氧化性、还原性的强弱判断
方法2:根据物质活动性顺序判断
(1)金属活动性顺序(常见元素)
(2)非金属活泼性顺序(常见元素)
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
原子还原性逐渐减弱,对应阳离子氧化性逐渐增强
氧化性:
F2>O2>Cl2>Br2>I2>S
还原性:F-
方法3:由反应条件的难易判断
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。
示例:
2KMnO4
+
16HCl(浓)====
2KCl
+
2MnCl2
+
5Cl2↑+
8H2O
MnO2
+
4HCl(浓)====
MnCl2
+
Cl2↑+
2H2O
4HCl
+
O2
====
2H2O
+
2Cl2
由上述反应条件的不同,
可判断氧化性:
>
>
。
催化剂
KMnO4
MnO2
O2
一、物质氧化性、还原性的强弱判断
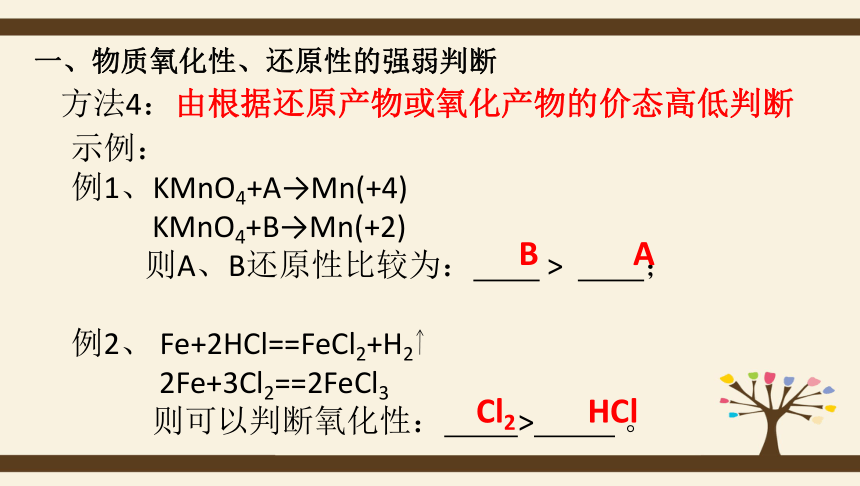
方法4:由根据还原产物或氧化产物的价态高低判断
示例:
例1、KMnO4+A→Mn(+4)
KMnO4+B→Mn(+2)
则A、B还原性比较为:
>
;
例2、
Fe+2HCl==FeCl2+H2
2Fe+3Cl2==2FeCl3
则可以判断氧化性:
>
。
B
A
Cl2
HCl
一、物质氧化性、还原性的强弱判断
Cu
+
4(浓)HNO3
=
Cu(NO3)2
+
2NO2↑
+
2H2O
3Cu
+
8(稀)HNO3
=
3Cu(NO3)2
+
2NO↑
+
4H2O
【注】
氧化
(还原)
性强弱只取决于的是电子的难易,
而不是多少
+5
+5
+2
+4
二、氧化还原反应的基本规律
规律1:价态规律
①处于最高价态时
示例:
在Fe、Fe2+、Fe3+、Cl2、Cl-、ClO-、S、S2—、SO2、H2S、H2SO4(从S的角度来看)中,只有氧化性的是
,只有还原性的是
,既有氧化性,又有还原性的是
。
Fe3+,H2SO4
Fe,Cl-,S2—,H2S
Fe2+,Cl2,
ClO-,
S,SO2
③处于最低价态时
②处于中间价态时
降、得、还
(氧化剂)
具有氧化性
二、氧化还原反应的基本规律
规律1:价态规律
(2)
同种元素相邻价态间不发生氧化还原反应,同种元素不同价态间发生氧化还原反应时化合价只靠拢不交叉。
示例:
H2S
+
H2SO4(浓)
=
S↓+
SO2↑
+
2
H2O
中化合价变化是:
。
判断氧化还原反应能否发生及表明电子转移情况。
二、氧化还原反应的基本规律
规律2:先后规律
氧化剂只有一种,还原剂有多种,则还原性强的先被氧化;还原剂只有一种,氧化剂有多种,则氧化性强的先被还原。
判断物质的稳定性及其反应顺序
二、氧化还原反应的基本规律
规律2:先后规律
示例:
1、在CuSO4和AgNO3的混合溶液中加入适量铁粉,_______先被置换出来,_______后被置换出来。
2、在FeBr2溶液中通入Cl2由少至多,先看到溶液变黄色(生成
),后看到溶液变橙色(生成
),则还原性Fe2+_____Br-。
Cu
Ag
Fe3+
Br2
>
二、氧化还原反应的基本规律
规律3:守恒规律
氧化剂得到的电子总数等于还原剂失去的电子总数,即电子守恒。化合价升降总数也等于电子转移总数,故氧化剂中元素化合价降低总数等于还原剂中元素化合价升高总数。
可进行氧化还原反应方程式配平和有关计算
三、氧化还原反应的类型
1.部分发生氧化还原反应
2.歧化反应
3.归中反应
3Cu
+
8(稀)HNO3
=
3Cu(NO3)2
+
2NO↑
+
4H2O
2H2O2
=
2H2O
+
O2↑
催化剂
O:-1
-2
0
(只靠近不交叉)
H2S
+
H2SO4(浓)
=
S↓+
SO2↑
+
2H2O
二、氧化还原反应的基本规律
氧化还原反应的表示方法:
1、双线桥法:用箭头表示同一元素的原子或离子得到或失去电子的结果。在线上标出“失去”或“得到”电子的数目,一条箭头由氧化剂指向还原产物,另一条由还原剂指向氧化产物。
Fe+2HCl==FeCl2+H2
失去2e-
得到2
x
e-
示例:
Fe+2HCl==FeCl2+H2
练习:
MnO2
+
4HCl(浓)==
MnCl2
+
Cl2↑+
2H2O
二、氧化还原反应的基本规律
氧化还原反应的表示方法:
2、单线桥法:用箭头表示反应物中不同(或相同)原子或离子间的电子转移。在线上标出电子转移的总数,箭头指出电子转移的方向,即箭头由还原剂指向氧化剂。
Fe+2HCl==FeCl2+H2
2e-
示例:
Fe+2HCl==FeCl2+H2
练习:
MnO2
+
4HCl(浓)==
MnCl2
+
Cl2↑+
2H2O
幻想是保持心情愉快的一种方法
