鲁科版高中化学必修一 4.1 硅 无机非金属材料 (2)(共26张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一 4.1 硅 无机非金属材料 (2)(共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 338.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
3、Si单质化学性质
(1)常温下
Si+2F2==
SiF4
,
Si+4HF=
SiF4
↑
+2H2↑
常温下,硅的化学性质很稳定,除F2、HF和强碱外,硅不跟其它物质(如O2、Cl2、H2SO4、HNO3等 )反应。
Si+2NaOH+H2O==Na2SiO3+2H2↑
(与Al相似)
硅的化学性质小结
化学性质:
常温下反应:
Si
+4HF=
SiF4↑+2H2
↑
Si
+
2F2=SiF4
Si+
2NaOH+
H2O=
Na2SiO3
+
2H2
↑
SiO2→酸性氧化物
1:SiO2
+
CaO
==
CaSiO3
高温
2:SiO2
+
2
NaOH
==Na2SiO3+H2O
3:SiO2
与水不反应,
与酸不反应(氢氟酸——HF外)
SiO2
+
4HF
==
SiF4↑+
2H20
4:SiO2与Na2CO3反应
三、硅酸和硅酸盐
1.硅酸
(1)物理性质:难溶于水。
(2)化学性质:
①弱酸性——比碳酸弱
向Na2SiO3溶液中通入CO2的反应方程式为Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。
②不稳定性
受热分解:H2SiO3=SiO2+H2O
(3)用途:硅胶可用作干燥剂、催化剂的载体等。
(1)硅酸盐
由
组成的化合物的总称,是构成地壳岩石的主要成分。
(2)硅酸钠
硅酸钠水溶液俗称
,是无色黏稠液体,常用于制备黏合剂、防腐剂、耐火材料。
硅、氧和金属
水玻璃
2.硅酸盐
(3)硅酸盐组成的表示
通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成:如硅酸钠(Na2SiO3)可表示为
,长石(KAlSi3O8)可表示为:
。
Na2O·SiO2
K2O·Al2O3·6SiO2
四、无机非金属材料
1.硅酸盐材料
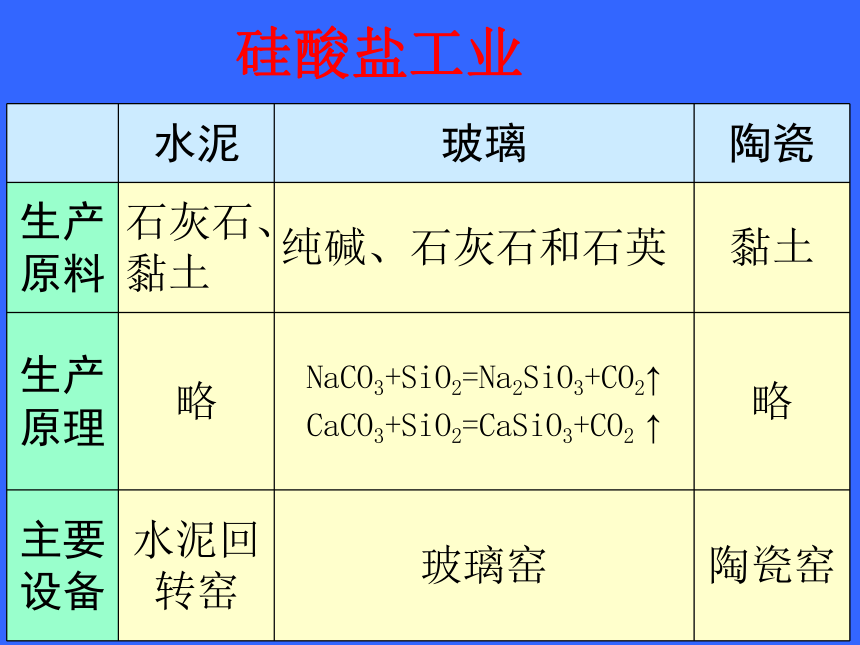
硅酸盐工业
水泥
玻璃
陶瓷
生产原料
石灰石、黏土
纯碱、石灰石和石英
黏土
生产原理
略
NaCO3+SiO2=Na2SiO3+CO2↑
CaCO3+SiO2=CaSiO3+CO2
↑
略
主要设备
水泥回转窑
玻璃窑
陶瓷窑
1、关于硅的叙述中,正确的是(
)
A、硅是构成矿物和岩石的主要元素,
在地壳中含量居第一
B、硅的化学性质不活泼,在自然界中
可以以游离态存在
C、硅在电子工业中,是重要的半导体
材料
D、地壳中硅元素含量最高
C
2、下列说法正确的是(
)
A、SiO2溶于水显酸性
B、二氧化硅也叫硅酐
C、
SiO2是酸性氧化物,它不溶于任何酸
D、
因高温时SiO2与Na2CO3反应放出CO2,所以硅酸酸性比碳酸强
B
3、关于二氧化硅说法错误的是(
)
A、二氧化硅常温下是一种固体
B、不能由二氧化硅跟水直接作用制取硅酸
C、二氧化硅能与氢氟酸反应,又能与烧碱
反应,所以它是两性氧化物
D、二氧化硅和二氧化碳在物理性质上有很
大差别
C
二、二氧化硅
1、二氧化硅的存在
存
在
晶体二氧化硅:石英晶体、水晶、玛瑙
无定形二氧化硅:硅藻土
(具有较强的吸附性)
硅的提纯原理:
在高温下让粗硅(Si)与氯气(Cl2)反应,其产物在高温下被氢气(H2)还原而得到较纯的硅
工业上单质硅的制取
2、
SiO2与CO2物理性质的比较
(1)无色晶体
(2)不溶于水
(3)熔、沸点较高
(4)硬度大
酸性氧化物
化学式
CO2
SiO2
分类
酸性氧化物
物
理
性
质
(1)无色无味气体
(2)能溶于水(1:1常温)
(3)比空气重
(4)无毒
高温
酸性氧化物
CO2+H2O=H2CO3
不反应
CO2+CaO
=
CaCO3
SiO2+CaO
=
CaSiO3
CO2+2NaOH
=
Na2CO3+H2O
SiO2+2NaOH
=
Na2SiO3+H2O
不反应
SiO2+4HF
=
SiF4↑+2H2O
3.化学性质
高温
酸性氧化物
与HF
反应
CO2
SiO2
分类
与水
反应
与碱性氧化物反应
与碱
反应
三、硅酸(H2SiO3)
H2SiO3是SiO2的对应水化物(
SiO2是H2SiO3的酸酐),
Na2SiO3
+
2HCl
==
2NaCl
+
H2SiO3↓
SiO32-
+
2H+
==
H2SiO3↓
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
SiO32-
+
H2O
+
CO2==
CO32-
+
H2SiO3↓
是一种白色不溶性酸,其酸性比H2CO3还弱。
制法:
1、硅酸钠(Na2SiO3)
白色固体,易溶
于水,其水溶液俗名叫水玻璃。
四、硅酸盐
先变干,后燃烧
仅变干,不燃烧
Na2SiO3溶液可作木材、纸张的防火剂
水玻璃是无色粘稠的液体,不能燃烧,不易被腐蚀,热稳定性强。可用作肥皂填料,木材、织物的防腐剂和防火剂,建筑、纸张的黏胶剂。
实验P77
放入蒸馏水
放入Na2SiO3饱和溶液
现象
结论
2、复杂硅酸盐:
滑
石:3MgO?4SiO2?H2O
云
母:K2O?3Al2O3?6SiO2?2H2O
沸
石:Na2O?Al2O3?3SiO2?2H2O
石
棉:3MgO?CaO?4SiO2
高岭石(黏土):Al2O3?2SiO2?2H2O
三、硅酸盐与无机非金属材料
高温
高温
玻璃
水泥
陶瓷
原料
纯碱、石灰石、
石英
粘土、
石灰石
粘土
反应
原理
CaCO3+SiO2
CaSiO3+CO2↑
NaCO3+SiO2
Na2SiO3+CO2↑
高温下发生复杂的物理、化学变化
烧结时发生复杂物理、化学变化
玻璃
水泥
陶瓷
主要
成分
SiO2
CaSiO3
Na2SiO3
硅酸二钙:2CaO·SiO2
硅酸三钙:3CaO·SiO2
铝酸三钙:3CaO·Al2O3
硅酸盐P110
特性
非晶体,透明、无固定熔点,可在一定温度范围内软化
水硬性:无论在水中还是在空气中均能硬化(是不可逆过程)
抗氧化、抗酸碱腐蚀、耐高温、绝缘
用途
化学仪器、光学仪器、运动器材、通讯器材、窗玻璃、玻璃瓶、杯
建筑材料
(1)化学实验中的坩埚、蒸发皿(2)建筑中的砖、瓦(3)电器中的绝缘瓷
HCl
HF
CO2
NaOH
NH3·H2O
SiO2
(1)
(2)
Al
(3)
(4)
Al2O3
(5)
(6)
Al(OH)3
(7)
(8)
AlCl3
(9\10)
(11)
Na[AlOH]4
(12\13)
(14\15)
【归纳】碳与硅化学性质比较
碳(
C
)
硅(Si)
常温下很稳定,在高温或点燃的条件下有较强还原性。
C+O2
CO2
2C+O2
2CO
C+CO2
2CO
C+CuO
CO+Cu
C+H2O(气)
CO+H2
C+2H2SO4(浓)
CO2↑
+2SO2↑+2H2O
C+4HNO3(浓)
CO2↑
+4NO2↑+2H2O
2、
SiO2与CO2化学性质的比较
不反应
不反应
二氧化硅(SiO2)
二氧化碳(CO2)
与水反应
与酸反应
与碱反应
与碱性氧化物反应
与碳反应
思考题
为什么实验室里盛放碱液的试剂瓶用橡胶塞而不用玻璃塞?
新型无机非金属材料的主要品种、性
能及用途
氧化铝(
Al2O3)陶瓷(人造刚玉)
主要
特性
①高熔点;②高硬度;③可制成透明陶瓷;④无毒、不溶于水,强度高;⑤对人体有较好的适应性
主要
用途
高级耐火材料,刚玉球磨机;高压钠灯的灯管、人造骨、人造牙、人造心瓣膜、人造关节等
氮化硅(Si3N4)陶瓷
主要
特性
①超硬度,耐磨损;②抗腐蚀,高温时也抗氧化;③抗冷热冲击而不碎裂;④耐高温且不易传热;⑤本身具有润滑性
主要
用途
制造轴承、汽轮机叶片、机械密封环、永久性模具等机械构件。用于制造柴油机中发动机部件的受热面等
硅酸盐与无机非金属材料
高温
高温
强热
冷却
玻璃
水泥
陶瓷
原料
纯碱、石灰石、
石英
粘土、
石灰石
粘土
反应
原理
CaCO3+SiO2
CaSiO3+CO2↑
NaCO3+SiO2
Na2SiO3+CO2↑
高温下发生复杂的物理、化学变化
烧结时发生复杂物理、化学变化
反应
条件
高温
高温
高温
生产
过程
原料→熔体→玻璃
磨→烧→磨
混合→成型→干燥
凝结→冷却→陶器
主要
成分
SiO2
CaSiO3
Na2SiO3
硅酸二钙:2CaO·SiO2
硅酸三钙:3CaO·SiO2
铝酸三钙:3CaO·Al2O3
硅酸盐
特性
非晶体,透明、无固定熔点,可在一定温度范围内软化
水硬性:无论在水中还是在空气中均能硬化(是不可逆过程)
抗氧化、抗酸碱腐蚀、耐高温、绝缘
种类
普通玻璃、特种玻璃
不同标号
土器、陶器、瓷器、炻器等
用途
化学仪器、光学仪器、运动器材、通讯器材、窗玻璃、玻璃瓶、杯
建筑材料
(1)化学实验中的坩埚、蒸发皿(2)建筑中的砖、瓦(3)电器中的绝缘瓷
3、Si单质化学性质
(1)常温下
Si+2F2==
SiF4
,
Si+4HF=
SiF4
↑
+2H2↑
常温下,硅的化学性质很稳定,除F2、HF和强碱外,硅不跟其它物质(如O2、Cl2、H2SO4、HNO3等 )反应。
Si+2NaOH+H2O==Na2SiO3+2H2↑
(与Al相似)
硅的化学性质小结
化学性质:
常温下反应:
Si
+4HF=
SiF4↑+2H2
↑
Si
+
2F2=SiF4
Si+
2NaOH+
H2O=
Na2SiO3
+
2H2
↑
SiO2→酸性氧化物
1:SiO2
+
CaO
==
CaSiO3
高温
2:SiO2
+
2
NaOH
==Na2SiO3+H2O
3:SiO2
与水不反应,
与酸不反应(氢氟酸——HF外)
SiO2
+
4HF
==
SiF4↑+
2H20
4:SiO2与Na2CO3反应
三、硅酸和硅酸盐
1.硅酸
(1)物理性质:难溶于水。
(2)化学性质:
①弱酸性——比碳酸弱
向Na2SiO3溶液中通入CO2的反应方程式为Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓。
②不稳定性
受热分解:H2SiO3=SiO2+H2O
(3)用途:硅胶可用作干燥剂、催化剂的载体等。
(1)硅酸盐
由
组成的化合物的总称,是构成地壳岩石的主要成分。
(2)硅酸钠
硅酸钠水溶液俗称
,是无色黏稠液体,常用于制备黏合剂、防腐剂、耐火材料。
硅、氧和金属
水玻璃
2.硅酸盐
(3)硅酸盐组成的表示
通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成:如硅酸钠(Na2SiO3)可表示为
,长石(KAlSi3O8)可表示为:
。
Na2O·SiO2
K2O·Al2O3·6SiO2
四、无机非金属材料
1.硅酸盐材料
硅酸盐工业
水泥
玻璃
陶瓷
生产原料
石灰石、黏土
纯碱、石灰石和石英
黏土
生产原理
略
NaCO3+SiO2=Na2SiO3+CO2↑
CaCO3+SiO2=CaSiO3+CO2
↑
略
主要设备
水泥回转窑
玻璃窑
陶瓷窑
1、关于硅的叙述中,正确的是(
)
A、硅是构成矿物和岩石的主要元素,
在地壳中含量居第一
B、硅的化学性质不活泼,在自然界中
可以以游离态存在
C、硅在电子工业中,是重要的半导体
材料
D、地壳中硅元素含量最高
C
2、下列说法正确的是(
)
A、SiO2溶于水显酸性
B、二氧化硅也叫硅酐
C、
SiO2是酸性氧化物,它不溶于任何酸
D、
因高温时SiO2与Na2CO3反应放出CO2,所以硅酸酸性比碳酸强
B
3、关于二氧化硅说法错误的是(
)
A、二氧化硅常温下是一种固体
B、不能由二氧化硅跟水直接作用制取硅酸
C、二氧化硅能与氢氟酸反应,又能与烧碱
反应,所以它是两性氧化物
D、二氧化硅和二氧化碳在物理性质上有很
大差别
C
二、二氧化硅
1、二氧化硅的存在
存
在
晶体二氧化硅:石英晶体、水晶、玛瑙
无定形二氧化硅:硅藻土
(具有较强的吸附性)
硅的提纯原理:
在高温下让粗硅(Si)与氯气(Cl2)反应,其产物在高温下被氢气(H2)还原而得到较纯的硅
工业上单质硅的制取
2、
SiO2与CO2物理性质的比较
(1)无色晶体
(2)不溶于水
(3)熔、沸点较高
(4)硬度大
酸性氧化物
化学式
CO2
SiO2
分类
酸性氧化物
物
理
性
质
(1)无色无味气体
(2)能溶于水(1:1常温)
(3)比空气重
(4)无毒
高温
酸性氧化物
CO2+H2O=H2CO3
不反应
CO2+CaO
=
CaCO3
SiO2+CaO
=
CaSiO3
CO2+2NaOH
=
Na2CO3+H2O
SiO2+2NaOH
=
Na2SiO3+H2O
不反应
SiO2+4HF
=
SiF4↑+2H2O
3.化学性质
高温
酸性氧化物
与HF
反应
CO2
SiO2
分类
与水
反应
与碱性氧化物反应
与碱
反应
三、硅酸(H2SiO3)
H2SiO3是SiO2的对应水化物(
SiO2是H2SiO3的酸酐),
Na2SiO3
+
2HCl
==
2NaCl
+
H2SiO3↓
SiO32-
+
2H+
==
H2SiO3↓
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
SiO32-
+
H2O
+
CO2==
CO32-
+
H2SiO3↓
是一种白色不溶性酸,其酸性比H2CO3还弱。
制法:
1、硅酸钠(Na2SiO3)
白色固体,易溶
于水,其水溶液俗名叫水玻璃。
四、硅酸盐
先变干,后燃烧
仅变干,不燃烧
Na2SiO3溶液可作木材、纸张的防火剂
水玻璃是无色粘稠的液体,不能燃烧,不易被腐蚀,热稳定性强。可用作肥皂填料,木材、织物的防腐剂和防火剂,建筑、纸张的黏胶剂。
实验P77
放入蒸馏水
放入Na2SiO3饱和溶液
现象
结论
2、复杂硅酸盐:
滑
石:3MgO?4SiO2?H2O
云
母:K2O?3Al2O3?6SiO2?2H2O
沸
石:Na2O?Al2O3?3SiO2?2H2O
石
棉:3MgO?CaO?4SiO2
高岭石(黏土):Al2O3?2SiO2?2H2O
三、硅酸盐与无机非金属材料
高温
高温
玻璃
水泥
陶瓷
原料
纯碱、石灰石、
石英
粘土、
石灰石
粘土
反应
原理
CaCO3+SiO2
CaSiO3+CO2↑
NaCO3+SiO2
Na2SiO3+CO2↑
高温下发生复杂的物理、化学变化
烧结时发生复杂物理、化学变化
玻璃
水泥
陶瓷
主要
成分
SiO2
CaSiO3
Na2SiO3
硅酸二钙:2CaO·SiO2
硅酸三钙:3CaO·SiO2
铝酸三钙:3CaO·Al2O3
硅酸盐P110
特性
非晶体,透明、无固定熔点,可在一定温度范围内软化
水硬性:无论在水中还是在空气中均能硬化(是不可逆过程)
抗氧化、抗酸碱腐蚀、耐高温、绝缘
用途
化学仪器、光学仪器、运动器材、通讯器材、窗玻璃、玻璃瓶、杯
建筑材料
(1)化学实验中的坩埚、蒸发皿(2)建筑中的砖、瓦(3)电器中的绝缘瓷
HCl
HF
CO2
NaOH
NH3·H2O
SiO2
(1)
(2)
Al
(3)
(4)
Al2O3
(5)
(6)
Al(OH)3
(7)
(8)
AlCl3
(9\10)
(11)
Na[AlOH]4
(12\13)
(14\15)
【归纳】碳与硅化学性质比较
碳(
C
)
硅(Si)
常温下很稳定,在高温或点燃的条件下有较强还原性。
C+O2
CO2
2C+O2
2CO
C+CO2
2CO
C+CuO
CO+Cu
C+H2O(气)
CO+H2
C+2H2SO4(浓)
CO2↑
+2SO2↑+2H2O
C+4HNO3(浓)
CO2↑
+4NO2↑+2H2O
2、
SiO2与CO2化学性质的比较
不反应
不反应
二氧化硅(SiO2)
二氧化碳(CO2)
与水反应
与酸反应
与碱反应
与碱性氧化物反应
与碳反应
思考题
为什么实验室里盛放碱液的试剂瓶用橡胶塞而不用玻璃塞?
新型无机非金属材料的主要品种、性
能及用途
氧化铝(
Al2O3)陶瓷(人造刚玉)
主要
特性
①高熔点;②高硬度;③可制成透明陶瓷;④无毒、不溶于水,强度高;⑤对人体有较好的适应性
主要
用途
高级耐火材料,刚玉球磨机;高压钠灯的灯管、人造骨、人造牙、人造心瓣膜、人造关节等
氮化硅(Si3N4)陶瓷
主要
特性
①超硬度,耐磨损;②抗腐蚀,高温时也抗氧化;③抗冷热冲击而不碎裂;④耐高温且不易传热;⑤本身具有润滑性
主要
用途
制造轴承、汽轮机叶片、机械密封环、永久性模具等机械构件。用于制造柴油机中发动机部件的受热面等
硅酸盐与无机非金属材料
高温
高温
强热
冷却
玻璃
水泥
陶瓷
原料
纯碱、石灰石、
石英
粘土、
石灰石
粘土
反应
原理
CaCO3+SiO2
CaSiO3+CO2↑
NaCO3+SiO2
Na2SiO3+CO2↑
高温下发生复杂的物理、化学变化
烧结时发生复杂物理、化学变化
反应
条件
高温
高温
高温
生产
过程
原料→熔体→玻璃
磨→烧→磨
混合→成型→干燥
凝结→冷却→陶器
主要
成分
SiO2
CaSiO3
Na2SiO3
硅酸二钙:2CaO·SiO2
硅酸三钙:3CaO·SiO2
铝酸三钙:3CaO·Al2O3
硅酸盐
特性
非晶体,透明、无固定熔点,可在一定温度范围内软化
水硬性:无论在水中还是在空气中均能硬化(是不可逆过程)
抗氧化、抗酸碱腐蚀、耐高温、绝缘
种类
普通玻璃、特种玻璃
不同标号
土器、陶器、瓷器、炻器等
用途
化学仪器、光学仪器、运动器材、通讯器材、窗玻璃、玻璃瓶、杯
建筑材料
(1)化学实验中的坩埚、蒸发皿(2)建筑中的砖、瓦(3)电器中的绝缘瓷
