鲁科版高中化学必修一 3.2 氮的循环 (1)(共24张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一 3.2 氮的循环 (1)(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 00:00:00 | ||
图片预览





文档简介
(共24张PPT)
普通高中课程标准实验教科书
化学1(必修)
第三章
第二节
氮的循环
联想·质疑
闪电时空气中会发
生哪些化学反应?
这些反应和生成的
物质对人类的生产
生活有什么影响?
一、氮在自然界中的循环
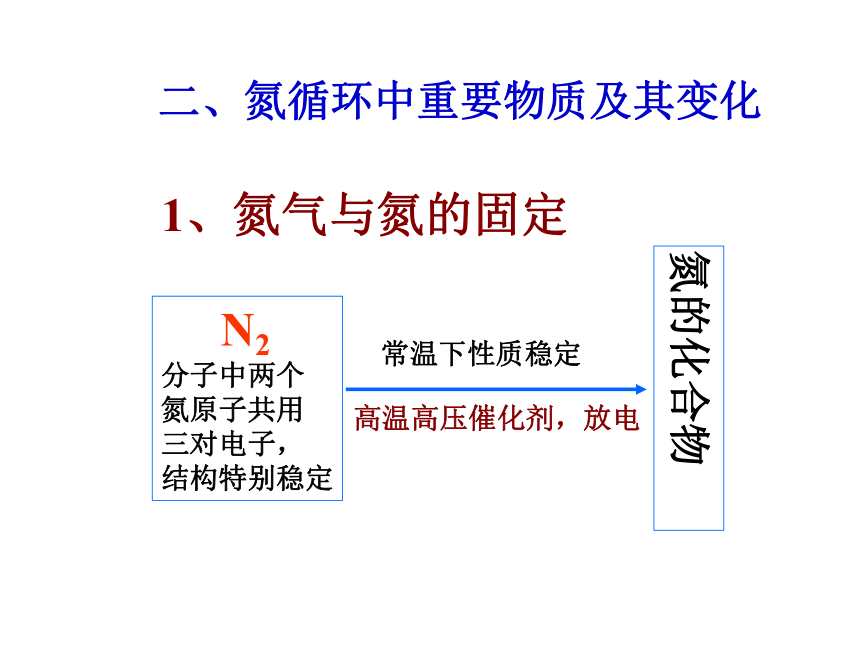
二、氮循环中重要物质及其变化
1、氮气与氮的固定
N2
分子中两个
氮原子共用
三对电子,
结构特别稳定
氮的化合物
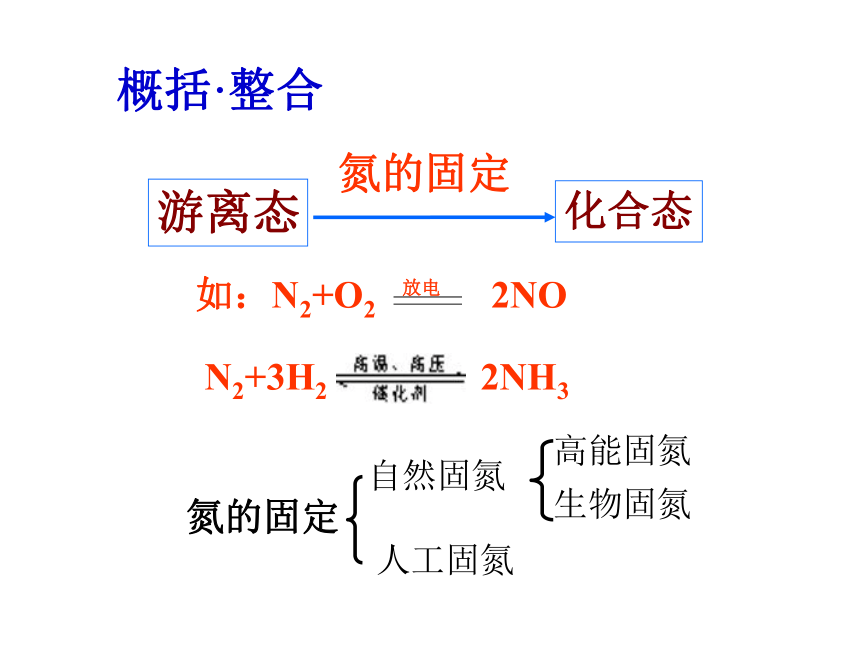
氮的固定
概括·整合
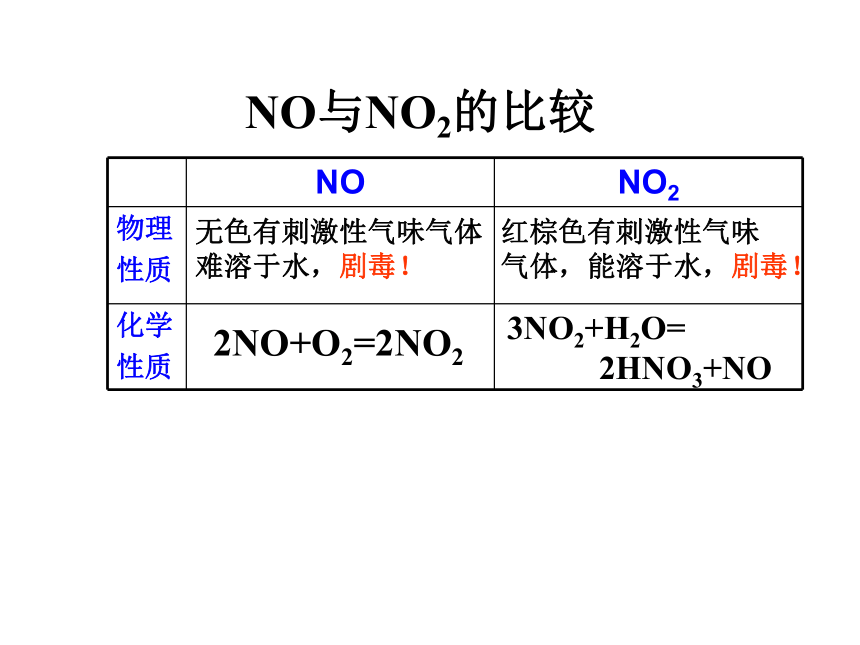
NO与NO2的比较
无色有刺激性气味气体
难溶于水,剧毒!
红棕色有刺激性气味
气体,能溶于水,剧毒!
2NO+O2=2NO2
3NO2+H2O=
2HNO3+NO
0.005mol×30g/mol
+0.045mol×46g/mol
0.05mol
==
44.4g/mol
M1==
(体积比)
13
8
依题意:
3/2x
+y/2
==0.03mol
依题意:
y/2
+z
==0.03mol
解得:
y
==0.04mol
0.004mol×46g/mol
+0.01mol×92g/mol
0.05mol
==
55.2g/mol
M2==
C
?
CO2、H2O
CO、H2
3LH2O(气)
2LCO
1LCO2
C
CuO
CuO
C
CO2、H2O
CO、H2
?
?
?
?
?
故答案为:
(1)不可能;(2)有;(3)没有。
评述:氢气和氧气的反应可以认为是铜作催化剂的反应,由此将5组份体系转化为三组分体系。这种转换符合化学反应原理,是一种等价转换。真是三管变两管,就简又删繁。
NO
NO2
物理
性质
化学
性质
思考·讨论
1、现给你一试管二氧化氮,其它药品和
仪器自选,根据上述反应,请你设计实验,
要求尽可能多的使二氧化氮被水吸收。
2、你的设计对工业上生产硝酸有什么启示?
充分利用原料,减少污染物的排放
4NO2+O2+2H2O=
4HNO3
3、NO2和O2混合溶于水
1)在一烧瓶中将NO2和O2以4:1的体积比(标
准状况)混合,倒置于足量水中充分反应后所得
溶液的物质的量浓度为
mol/L
2)将12mlNO2和O2的混合气体通入足量的水
中,充分反应后余气2ml(气体均在相同状态
下测定)求原各气体的体积。
0.036
NO2
8ml、O2
4ml或NO2
10.8ml、O2
1.2ml
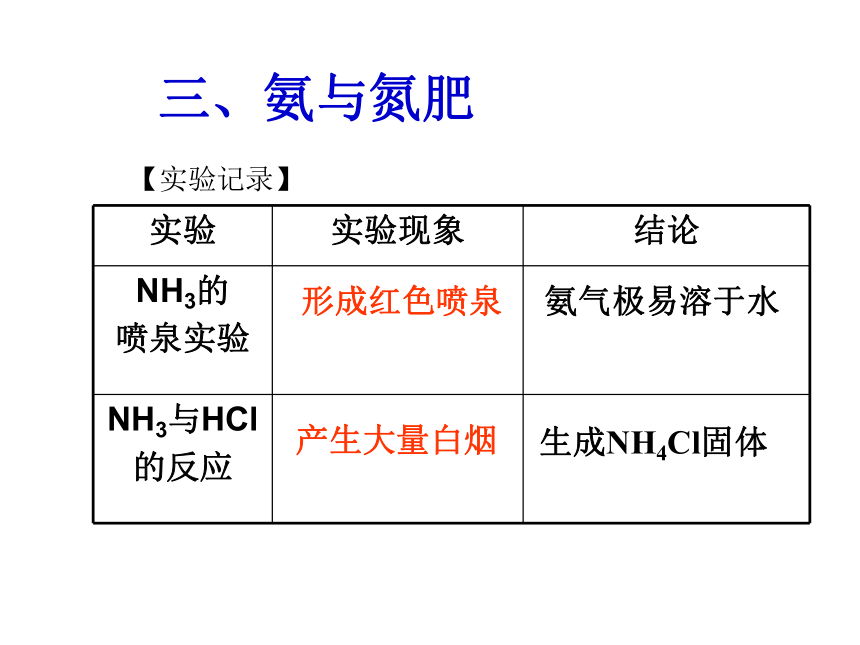
三、氨与氮肥
【实验记录】
形成红色喷泉
产生大量白烟
氨气极易溶于水
生成NH4Cl固体
实验
实验现象
结论
NH3的
喷泉实验
NH3与HCl
的反应
【小结:氨的化学性质】
(1)氨跟水反应——显弱碱性
(2)氨跟酸的反应
NH3+HCl=NH4Cl
(白烟)
NH3+HNO3=NH4NO3
(白烟)
与挥发性的酸反应有白烟
2NH3+H2SO4=(NH4)2SO4
这个反应叫做氨的催化氧化,
它是工业上制硝酸的基础.
-3
+2
(3)NH3具有还原性
-3
氮
肥
种类
化学式
含氮量
性
状
铵
态
氮
肥
NH4HCO3
17.7%
白色结晶,吸湿性很
强,易潮解,溶于水,弱碱性
NH4Cl
26.2%
白色或淡黄色结晶,有吸湿性,溶于水,酸性.
NH4NO3
35%
白色结晶,易潮解,结硬块,溶于水,微酸性,
(NH4)2SO4
21.2%
白色粒状结晶,吸湿性不大,不易结块
有机
氮肥
CO(NH2)2
46.7%
白色或浅黄色针状结晶或小颗粒,溶于水,中性
四、铵盐的性质
都是晶体,都易溶于水
产生氨气
产生使湿润
的红色石蕊
试纸变蓝的
气体
实验现象
结论及化学方程式
物理
性质
加热
与碱反应
五、氨的实验室制法
?1.
原理
2.
装置
3.收集方法
4.检验方法
与制O2相同
向下排空气法
湿润红色石蕊试纸
六、硝酸的性质
1、物理性质
纯硝酸是无色、易挥发、有刺激性气味
的液体。
硝酸能以任意比溶解于水。
质量分数为69%的硝酸为浓硝酸;
质量分数为98%以上的硝酸为发烟硝酸。
2、硝酸的化学性质
1)
具有酸的通性
2
)不稳定性
3)具有强氧化性
go
1)
具有酸的通性
使紫色的石蕊试液变红
与某些金属氧化物起反应
与某些盐起反应
与碱起反应
返回
2
)硝酸的不稳定性
思考:
▲浓硝酸为什么常呈黄色?
▲如何保存硝酸?
返回
返回
七、人类活动对自然界氮
循环和环境的影响
NO
NO2
光化学烟雾
酸
雨
酸雨的形成
水体富营养化
悲哀的海豚
被污染的河流
普通高中课程标准实验教科书
化学1(必修)
第三章
第二节
氮的循环
联想·质疑
闪电时空气中会发
生哪些化学反应?
这些反应和生成的
物质对人类的生产
生活有什么影响?
一、氮在自然界中的循环
二、氮循环中重要物质及其变化
1、氮气与氮的固定
N2
分子中两个
氮原子共用
三对电子,
结构特别稳定
氮的化合物
氮的固定
概括·整合
NO与NO2的比较
无色有刺激性气味气体
难溶于水,剧毒!
红棕色有刺激性气味
气体,能溶于水,剧毒!
2NO+O2=2NO2
3NO2+H2O=
2HNO3+NO
0.005mol×30g/mol
+0.045mol×46g/mol
0.05mol
==
44.4g/mol
M1==
(体积比)
13
8
依题意:
3/2x
+y/2
==0.03mol
依题意:
y/2
+z
==0.03mol
解得:
y
==0.04mol
0.004mol×46g/mol
+0.01mol×92g/mol
0.05mol
==
55.2g/mol
M2==
C
?
CO2、H2O
CO、H2
3LH2O(气)
2LCO
1LCO2
C
CuO
CuO
C
CO2、H2O
CO、H2
?
?
?
?
?
故答案为:
(1)不可能;(2)有;(3)没有。
评述:氢气和氧气的反应可以认为是铜作催化剂的反应,由此将5组份体系转化为三组分体系。这种转换符合化学反应原理,是一种等价转换。真是三管变两管,就简又删繁。
NO
NO2
物理
性质
化学
性质
思考·讨论
1、现给你一试管二氧化氮,其它药品和
仪器自选,根据上述反应,请你设计实验,
要求尽可能多的使二氧化氮被水吸收。
2、你的设计对工业上生产硝酸有什么启示?
充分利用原料,减少污染物的排放
4NO2+O2+2H2O=
4HNO3
3、NO2和O2混合溶于水
1)在一烧瓶中将NO2和O2以4:1的体积比(标
准状况)混合,倒置于足量水中充分反应后所得
溶液的物质的量浓度为
mol/L
2)将12mlNO2和O2的混合气体通入足量的水
中,充分反应后余气2ml(气体均在相同状态
下测定)求原各气体的体积。
0.036
NO2
8ml、O2
4ml或NO2
10.8ml、O2
1.2ml
三、氨与氮肥
【实验记录】
形成红色喷泉
产生大量白烟
氨气极易溶于水
生成NH4Cl固体
实验
实验现象
结论
NH3的
喷泉实验
NH3与HCl
的反应
【小结:氨的化学性质】
(1)氨跟水反应——显弱碱性
(2)氨跟酸的反应
NH3+HCl=NH4Cl
(白烟)
NH3+HNO3=NH4NO3
(白烟)
与挥发性的酸反应有白烟
2NH3+H2SO4=(NH4)2SO4
这个反应叫做氨的催化氧化,
它是工业上制硝酸的基础.
-3
+2
(3)NH3具有还原性
-3
氮
肥
种类
化学式
含氮量
性
状
铵
态
氮
肥
NH4HCO3
17.7%
白色结晶,吸湿性很
强,易潮解,溶于水,弱碱性
NH4Cl
26.2%
白色或淡黄色结晶,有吸湿性,溶于水,酸性.
NH4NO3
35%
白色结晶,易潮解,结硬块,溶于水,微酸性,
(NH4)2SO4
21.2%
白色粒状结晶,吸湿性不大,不易结块
有机
氮肥
CO(NH2)2
46.7%
白色或浅黄色针状结晶或小颗粒,溶于水,中性
四、铵盐的性质
都是晶体,都易溶于水
产生氨气
产生使湿润
的红色石蕊
试纸变蓝的
气体
实验现象
结论及化学方程式
物理
性质
加热
与碱反应
五、氨的实验室制法
?1.
原理
2.
装置
3.收集方法
4.检验方法
与制O2相同
向下排空气法
湿润红色石蕊试纸
六、硝酸的性质
1、物理性质
纯硝酸是无色、易挥发、有刺激性气味
的液体。
硝酸能以任意比溶解于水。
质量分数为69%的硝酸为浓硝酸;
质量分数为98%以上的硝酸为发烟硝酸。
2、硝酸的化学性质
1)
具有酸的通性
2
)不稳定性
3)具有强氧化性
go
1)
具有酸的通性
使紫色的石蕊试液变红
与某些金属氧化物起反应
与某些盐起反应
与碱起反应
返回
2
)硝酸的不稳定性
思考:
▲浓硝酸为什么常呈黄色?
▲如何保存硝酸?
返回
返回
七、人类活动对自然界氮
循环和环境的影响
NO
NO2
光化学烟雾
酸
雨
酸雨的形成
水体富营养化
悲哀的海豚
被污染的河流
