高中化学_沪科课标版_高一上册_原子的构成 22张ppt
文档属性
| 名称 | 高中化学_沪科课标版_高一上册_原子的构成 22张ppt |  | |
| 格式 | ppt | ||
| 文件大小 | 439.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 15:16:38 | ||
图片预览








文档简介
§1.2
本节学习目标
(1)知识与技能:知道原子的构成、元素符号角标的意义、同位素、知道质量数与质子数和中子数的关系,理解原子质量、相对原子质量、近似相对原子质量、元素的相对原子质量以及元素的近似相对原子质量、分子等化学概念并能进行简单计算。学会运用多媒体信息技术辅助学习。
(2)过程与方法:逐步培养学生自主学习能力,对学习内容、过程和方法的反思能力等。让学生认识科学探索的一般方法,掌握化学探究中常用的、有效的实验方法和手段等。
(3)情感态度与价值观:体会和了解科技发展对社会进步的远大推动作用。
本节需1课时
一、原子的构成
原子是由位于原子中心的原子核和核外电子构成的。
原子很小,原子核更小,它的半径是原子的万分之一,体积仅为原子体积的几千亿分之一。
原子核是由质子和中子构成的。
从表中还可以看出:
因为电子的质量很小,仅为质子质量的1 / 1836,所以,原子的质量主要集中在原子核上。
原子(X)
原子核
质子Z个
中子(A-Z)个
核外电子Z个
一、原子的构成
1、构成原子中微粒间的关系
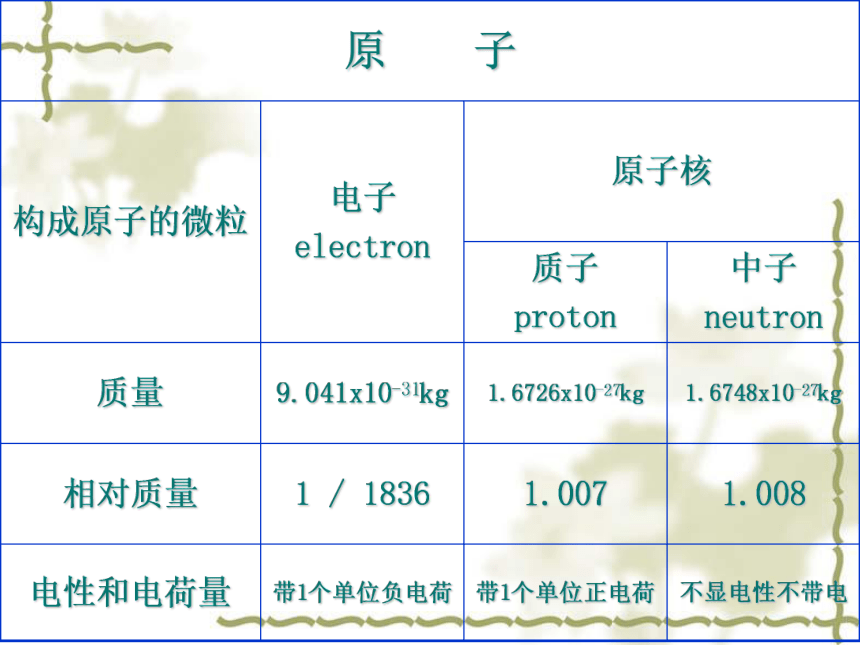
原 子
构成原子的微粒
电子
electron
原子核
质子
proton
中子
neutron
质量
9.041x10-31kg
1.6726x10-27kg
1.6748x10-27kg
相对质量
1 / 1836
1.007
1.008
电性和电荷量
带1个单位负电荷
带1个单位正电荷
不显电性不带电
质量数(A) =质子数(Z)+中子数(N)
原子序数=核电荷数(Z)=核内质子数=核外电子数
则将原子核内所有的质子和中子的近似相对质量数值相加所得数值叫做质量数,可用符号A表示。
2、构成原子的微粒数之间的两个关系
-
X
a
+
化合价
b 离子电荷
-
+
c 原子个数
质量数A
质子数Z
3、化学元素符号角标的意义
1、根据构成原子的各种微粒数之间的关系,求质量数为40、核外电子数为19的钾原子的核电荷数、质子数和中子数。
思考:
2、放射性同位素 可有效治疗肝癌,该原子核内中子数与电子数之差为( )
A. 67 B. 166 C. 32 D. 99
C
二、同位素
1、什么是同位素?
具有相同质子数和不同中子数的同种元素的不同种的原子互称为同位素。
例:
在自然界存在三种不同的氢原子
氕(hydrogen) 符号: 1H 或 H
氘(deuterium) 符号: 2H 或 D
氚(tritium) 符号: 3H 或 T
思考:
是否所有的原子都是由质子、中子和电子构成的?
氕(hydrogen) 符号: 1H 或 H
2、同位素的应用
大多数天然元素都有同位素,我们称它们为天然同位素。
如:H、D、T, ( D、T 制造氢弹)
92号铀元素234U、 235U、238U, (235U制造原子弹 )
6号碳元素12C、13C、 14C等。
(12C相对原子质量基准、 14C碳原子考古断代)
放射性同位素有很多的应用(课本Page10)。
育种
探测金属器件缺陷
研究化学反应机理
保存食物
3、关于同位素的两点说明
★在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的 原子百分比一般是不变的。这个百分比即为天然同位素的丰度。
★同种元素的同位素虽质量不同,但化学性质几乎完全相同
如碳: 12C=98.90% 13C=1. 07 % 14C=1.2X10-14 %
如氢: 1H=99.98% D=0.015% T=10-18%
如氧: 16O=99.76%,17O=0.04% 18O=0.20%。
三、相对原子质量
原子很小,但还是有一定的质量,如:
1、原子的质量
原子
氢
氧
碳
质量(g)
1.674X10-24
2.656X10-23
1.993X10-23
可以发现,以克为单位,原子的质量在数值表达上给记忆和使用带来不便。
比如
相对原子质量是以一个碳-12原子的质量的1/12作为标准,任何一个原子的真实质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。
2、相对原子质量
内含6个质子、6个中子
据此可知
一个碳-12的原子质量为1.993X10-23克,它的1/12为1.661X10-24克,我们很容易理解,碳-12的相对原子质量即为12。那氧-16的相对原子质量为:
2.656X10-23g /1.661X10-24g =15.99≈16
元素的相对原子质量是它的各种同位素的相对原子质量,根据其丰度计算而得的平均值:
A = A1·a1% + A2·a2% + …+ An·an%
3、元素的相对原子质量
因为原子的相对原子质量与质量数在数值是非常接近,所以在计算上常用质量数代替相对原子质量
元素的近似相对原子质量:是它的各种同位素的质量数,根据其丰度计算而得的平均值:
A = A1·a1% + A2·a2% + …+ An·an%
补:10电子微粒
分子:CH4 NH3 H2O HF Ne
原子:Ne
离子:O2- F- Na+ Mg2+ Al3+
OH- NH4+ H3O+
课后作业
1、书本Page12练习题,做在书上;
2、校本练习册;
3、 查阅资料,说明“相对原子质量”为
什么采用碳-12作为标准?
本节学习目标
(1)知识与技能:知道原子的构成、元素符号角标的意义、同位素、知道质量数与质子数和中子数的关系,理解原子质量、相对原子质量、近似相对原子质量、元素的相对原子质量以及元素的近似相对原子质量、分子等化学概念并能进行简单计算。学会运用多媒体信息技术辅助学习。
(2)过程与方法:逐步培养学生自主学习能力,对学习内容、过程和方法的反思能力等。让学生认识科学探索的一般方法,掌握化学探究中常用的、有效的实验方法和手段等。
(3)情感态度与价值观:体会和了解科技发展对社会进步的远大推动作用。
本节需1课时
一、原子的构成
原子是由位于原子中心的原子核和核外电子构成的。
原子很小,原子核更小,它的半径是原子的万分之一,体积仅为原子体积的几千亿分之一。
原子核是由质子和中子构成的。
从表中还可以看出:
因为电子的质量很小,仅为质子质量的1 / 1836,所以,原子的质量主要集中在原子核上。
原子(X)
原子核
质子Z个
中子(A-Z)个
核外电子Z个
一、原子的构成
1、构成原子中微粒间的关系
原 子
构成原子的微粒
电子
electron
原子核
质子
proton
中子
neutron
质量
9.041x10-31kg
1.6726x10-27kg
1.6748x10-27kg
相对质量
1 / 1836
1.007
1.008
电性和电荷量
带1个单位负电荷
带1个单位正电荷
不显电性不带电
质量数(A) =质子数(Z)+中子数(N)
原子序数=核电荷数(Z)=核内质子数=核外电子数
则将原子核内所有的质子和中子的近似相对质量数值相加所得数值叫做质量数,可用符号A表示。
2、构成原子的微粒数之间的两个关系
-
X
a
+
化合价
b 离子电荷
-
+
c 原子个数
质量数A
质子数Z
3、化学元素符号角标的意义
1、根据构成原子的各种微粒数之间的关系,求质量数为40、核外电子数为19的钾原子的核电荷数、质子数和中子数。
思考:
2、放射性同位素 可有效治疗肝癌,该原子核内中子数与电子数之差为( )
A. 67 B. 166 C. 32 D. 99
C
二、同位素
1、什么是同位素?
具有相同质子数和不同中子数的同种元素的不同种的原子互称为同位素。
例:
在自然界存在三种不同的氢原子
氕(hydrogen) 符号: 1H 或 H
氘(deuterium) 符号: 2H 或 D
氚(tritium) 符号: 3H 或 T
思考:
是否所有的原子都是由质子、中子和电子构成的?
氕(hydrogen) 符号: 1H 或 H
2、同位素的应用
大多数天然元素都有同位素,我们称它们为天然同位素。
如:H、D、T, ( D、T 制造氢弹)
92号铀元素234U、 235U、238U, (235U制造原子弹 )
6号碳元素12C、13C、 14C等。
(12C相对原子质量基准、 14C碳原子考古断代)
放射性同位素有很多的应用(课本Page10)。
育种
探测金属器件缺陷
研究化学反应机理
保存食物
3、关于同位素的两点说明
★在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的 原子百分比一般是不变的。这个百分比即为天然同位素的丰度。
★同种元素的同位素虽质量不同,但化学性质几乎完全相同
如碳: 12C=98.90% 13C=1. 07 % 14C=1.2X10-14 %
如氢: 1H=99.98% D=0.015% T=10-18%
如氧: 16O=99.76%,17O=0.04% 18O=0.20%。
三、相对原子质量
原子很小,但还是有一定的质量,如:
1、原子的质量
原子
氢
氧
碳
质量(g)
1.674X10-24
2.656X10-23
1.993X10-23
可以发现,以克为单位,原子的质量在数值表达上给记忆和使用带来不便。
比如
相对原子质量是以一个碳-12原子的质量的1/12作为标准,任何一个原子的真实质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。
2、相对原子质量
内含6个质子、6个中子
据此可知
一个碳-12的原子质量为1.993X10-23克,它的1/12为1.661X10-24克,我们很容易理解,碳-12的相对原子质量即为12。那氧-16的相对原子质量为:
2.656X10-23g /1.661X10-24g =15.99≈16
元素的相对原子质量是它的各种同位素的相对原子质量,根据其丰度计算而得的平均值:
A = A1·a1% + A2·a2% + …+ An·an%
3、元素的相对原子质量
因为原子的相对原子质量与质量数在数值是非常接近,所以在计算上常用质量数代替相对原子质量
元素的近似相对原子质量:是它的各种同位素的质量数,根据其丰度计算而得的平均值:
A = A1·a1% + A2·a2% + …+ An·an%
补:10电子微粒
分子:CH4 NH3 H2O HF Ne
原子:Ne
离子:O2- F- Na+ Mg2+ Al3+
OH- NH4+ H3O+
课后作业
1、书本Page12练习题,做在书上;
2、校本练习册;
3、 查阅资料,说明“相对原子质量”为
什么采用碳-12作为标准?
