苏教化学选修 化学反应原理专题3 第二单元溶液的酸碱性(共20张PPT)
文档属性
| 名称 | 苏教化学选修 化学反应原理专题3 第二单元溶液的酸碱性(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 21:02:53 | ||
图片预览




文档简介
(共20张PPT)
再探溶液的酸碱性
待测液0.1mol/L
HCl
CH3COOH
NaOH
NH3.H2O
NH4Cl
CH3COONa
NaCl
PH
?
?
?
?
?
?
?
如何用PH试纸测定溶液的PH?
在玻璃片上放一张干燥的PH试纸,用干燥的玻璃棒蘸取待测液,滴到PH试纸上,将试纸与比色卡对照,估测PH值。
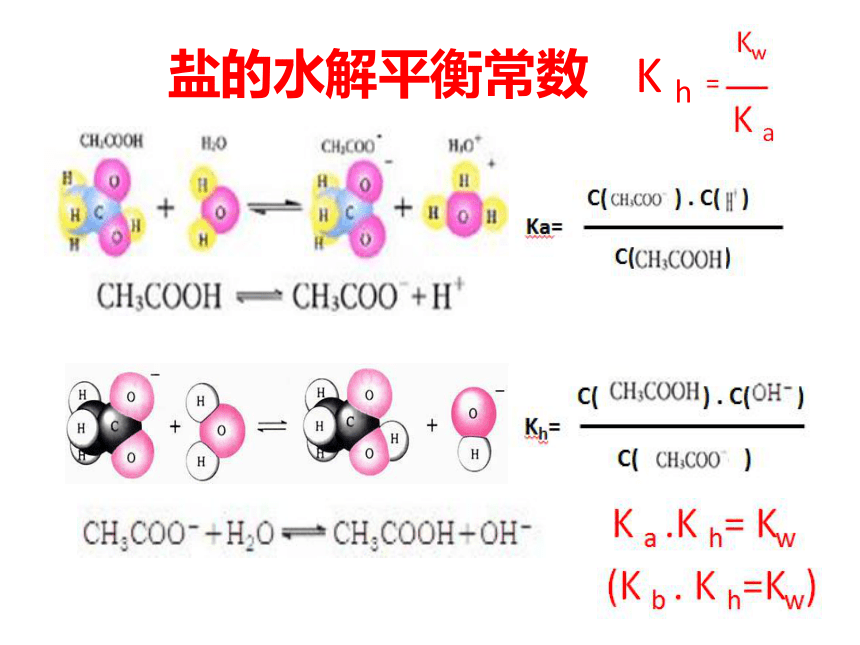
盐的水解平衡常数
K
h
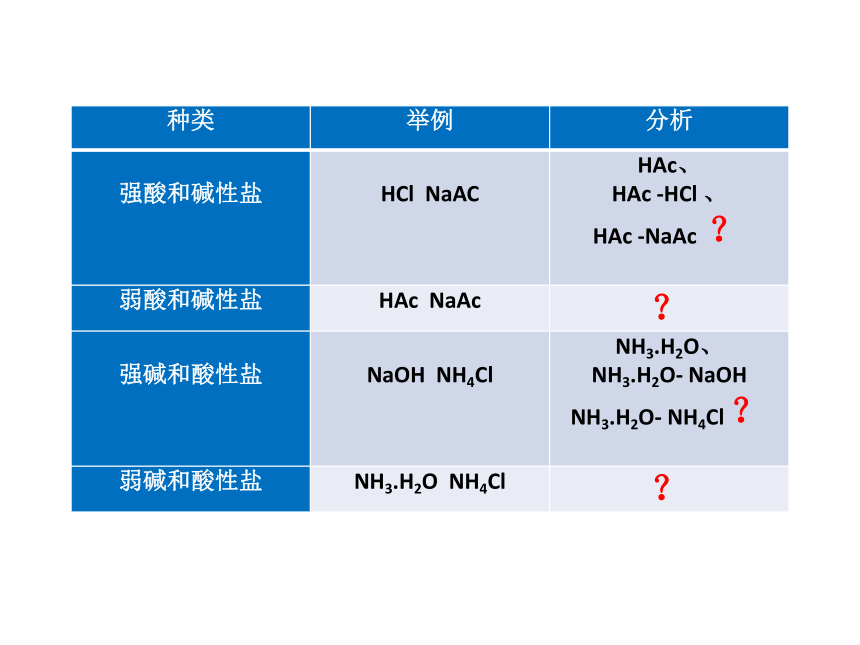
种类
举例
分析
强酸和碱性盐
HCl
NaAC
HAc、
HAc
-HCl
、
HAc
-NaAc
?
弱酸和碱性盐
HAc
NaAc
?
强碱和酸性盐
NaOH
NH4Cl
NH3.H2O、
NH3.H2O-
NaOH
NH3.H2O-
NH4Cl
?
弱碱和酸性盐
NH3.H2O
NH4Cl
?
相同条件下,等浓度混合的CH3COOH-CH3COONa溶液中,电离程度大于水解程度(Ka>Kh),溶液显酸性。
(Ka
=
1.76
10
-5
)
相同条件下,等浓度混合的NH3.H2O-NH4Cl
溶液中,电离程度大于水解程度(Kb>Kh),溶液显碱性。(Kb
=
1.8
10
-5
)
为什么等浓度混合的CH3COOH-CH3COONa溶液显酸性?为什么等浓度混合的NH3.H2O-NH4Cl溶液显碱性?
思考1:
等浓度混合的HCN-NaCN溶液显酸性吗?
(
Ka
=
5
10
-10
)
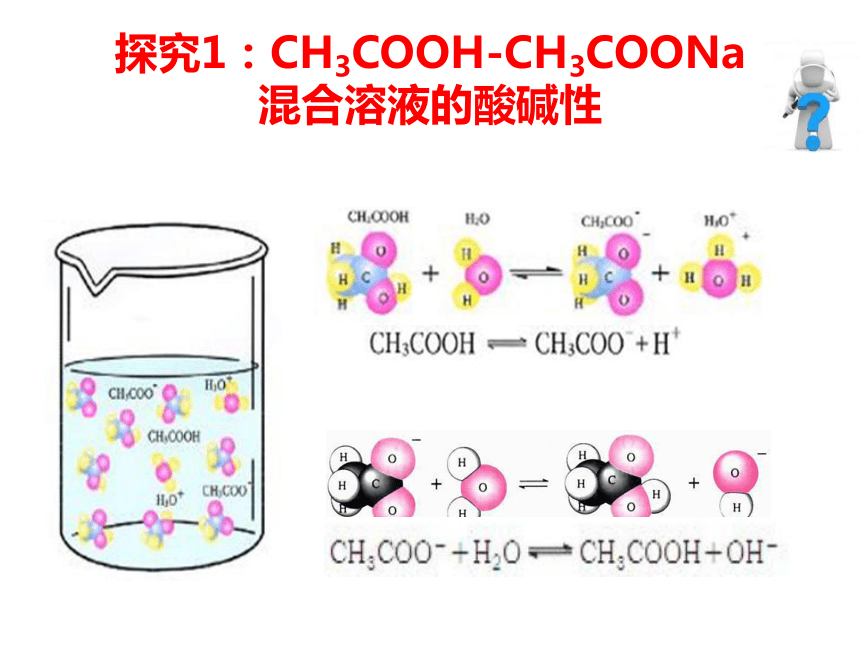
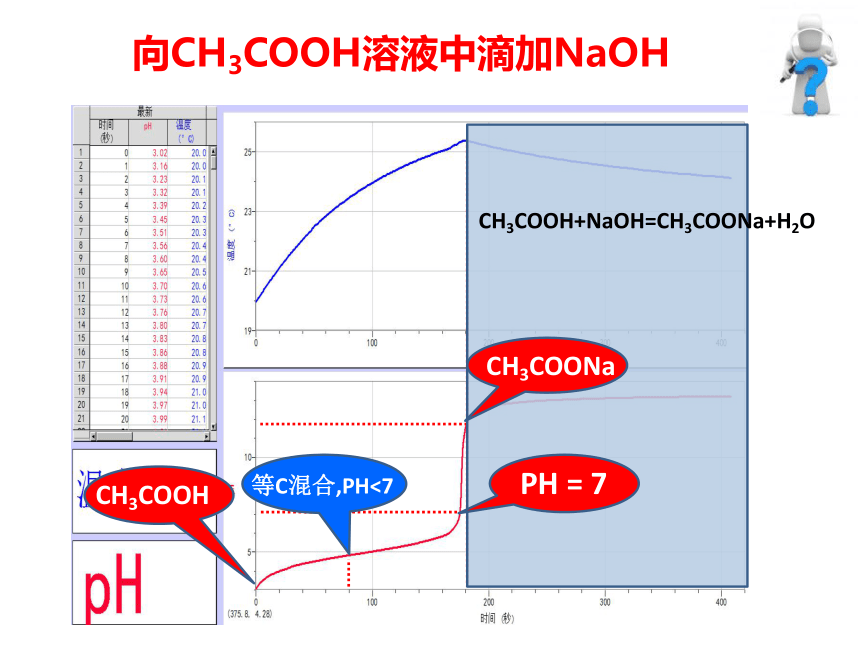
探究1:CH3COOH-CH3COONa
混合溶液的酸碱性
向CH3COOH溶液中滴加少量NaOH
CH3COOH
NaOH
向CH3COOH溶液中滴加NaOH
CH3COONa
PH
=
7
等C混合,PH<7
CH3COOH
CH3COOH+NaOH=CH3COONa+H2O
向NH3.H2O溶液中滴加HCl的图像
PH
<
7
PH
=
7
探究2:
NH3.H2O-NH4Cl
混合溶液的酸碱性
向NH3.H2O溶液中滴加少量HCl
PH
=
7
NH4Cl
等C混合,PH
>
7
NH3.H2O
NH3.H2O+HCl=NH4Cl+H2O
相同条件下,等浓度混合的CH3COOH-CH3COONa溶液中,电离程度大于水解程度(Ka>Kh),溶液显酸性。
(Ka
=
1.76
10
-5
)
相同条件下,等浓度混合的NH3.H2O-NH4Cl
溶液中,电离程度大于水解程度(Kb>Kh),溶液显碱性。(Kb
=
1.8
10
-5
)
为什么等浓度混合的CH3COOH-CH3COONa溶液显酸性?为什么等浓度混合的NH3.H2O-NH4Cl溶液显碱性?
思考1:
等浓度混合时,HCN-NaCN溶液显酸性吗?
(
Ka
=
5
10
-10
)
不等浓度混合时,溶液的酸碱性与浓度比有什么关系呢?
以CH3COOH-CH3COONa混合溶液为例
向CH3COOH溶液中滴加NaOH
CH3COONa
PH
=
7
等C混合,PH<7
CH3COOH
CH3COOH+NaOH=CH3COONa+H2O
以CH3COOH-CH3COONa混合溶液为例
已知PH
=
Pka-lg(C酸/C盐),Ka=1.76
10-5
Pka
=4.76
若等浓度C酸=C盐,
则PH
=
Pka
<
7
若PH=7,即Pka-lg(C酸/C盐)=7,
则C酸/C盐
=10-2.24
结论:
当C酸/C盐
=10-2.24
,PH=7
当C酸/C盐
>10-2.24
,PH<7
当C酸/C盐
<10-2.24
,PH>7
缓冲溶液
由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。
缓冲体系
1、弱
酸
和它的盐(如CH3COOH—CH3COONa)
2、弱
碱和它的盐(NH3·H2O---NH4Cl)
3、多元弱酸的酸式盐及其对应的次级盐
(如NaH2PO4---Na2HPO4)的水溶液组成。
H2C03/NaHCO3
H2C03/NaHCO3
小
结
练习:
1mol/L的NaHCO3溶液和1mol/L的NaHSO3溶液,都呈碱性吗?
(H2CO3的Ka1=4.4×10-7、Ka2=4.7×10-11
,
H2SO3?的Ka1=1.54×10-2??、?Ka2=1.02×10-7
)
谢谢
再探溶液的酸碱性
待测液0.1mol/L
HCl
CH3COOH
NaOH
NH3.H2O
NH4Cl
CH3COONa
NaCl
PH
?
?
?
?
?
?
?
如何用PH试纸测定溶液的PH?
在玻璃片上放一张干燥的PH试纸,用干燥的玻璃棒蘸取待测液,滴到PH试纸上,将试纸与比色卡对照,估测PH值。
盐的水解平衡常数
K
h
种类
举例
分析
强酸和碱性盐
HCl
NaAC
HAc、
HAc
-HCl
、
HAc
-NaAc
?
弱酸和碱性盐
HAc
NaAc
?
强碱和酸性盐
NaOH
NH4Cl
NH3.H2O、
NH3.H2O-
NaOH
NH3.H2O-
NH4Cl
?
弱碱和酸性盐
NH3.H2O
NH4Cl
?
相同条件下,等浓度混合的CH3COOH-CH3COONa溶液中,电离程度大于水解程度(Ka>Kh),溶液显酸性。
(Ka
=
1.76
10
-5
)
相同条件下,等浓度混合的NH3.H2O-NH4Cl
溶液中,电离程度大于水解程度(Kb>Kh),溶液显碱性。(Kb
=
1.8
10
-5
)
为什么等浓度混合的CH3COOH-CH3COONa溶液显酸性?为什么等浓度混合的NH3.H2O-NH4Cl溶液显碱性?
思考1:
等浓度混合的HCN-NaCN溶液显酸性吗?
(
Ka
=
5
10
-10
)
探究1:CH3COOH-CH3COONa
混合溶液的酸碱性
向CH3COOH溶液中滴加少量NaOH
CH3COOH
NaOH
向CH3COOH溶液中滴加NaOH
CH3COONa
PH
=
7
等C混合,PH<7
CH3COOH
CH3COOH+NaOH=CH3COONa+H2O
向NH3.H2O溶液中滴加HCl的图像
PH
<
7
PH
=
7
探究2:
NH3.H2O-NH4Cl
混合溶液的酸碱性
向NH3.H2O溶液中滴加少量HCl
PH
=
7
NH4Cl
等C混合,PH
>
7
NH3.H2O
NH3.H2O+HCl=NH4Cl+H2O
相同条件下,等浓度混合的CH3COOH-CH3COONa溶液中,电离程度大于水解程度(Ka>Kh),溶液显酸性。
(Ka
=
1.76
10
-5
)
相同条件下,等浓度混合的NH3.H2O-NH4Cl
溶液中,电离程度大于水解程度(Kb>Kh),溶液显碱性。(Kb
=
1.8
10
-5
)
为什么等浓度混合的CH3COOH-CH3COONa溶液显酸性?为什么等浓度混合的NH3.H2O-NH4Cl溶液显碱性?
思考1:
等浓度混合时,HCN-NaCN溶液显酸性吗?
(
Ka
=
5
10
-10
)
不等浓度混合时,溶液的酸碱性与浓度比有什么关系呢?
以CH3COOH-CH3COONa混合溶液为例
向CH3COOH溶液中滴加NaOH
CH3COONa
PH
=
7
等C混合,PH<7
CH3COOH
CH3COOH+NaOH=CH3COONa+H2O
以CH3COOH-CH3COONa混合溶液为例
已知PH
=
Pka-lg(C酸/C盐),Ka=1.76
10-5
Pka
=4.76
若等浓度C酸=C盐,
则PH
=
Pka
<
7
若PH=7,即Pka-lg(C酸/C盐)=7,
则C酸/C盐
=10-2.24
结论:
当C酸/C盐
=10-2.24
,PH=7
当C酸/C盐
>10-2.24
,PH<7
当C酸/C盐
<10-2.24
,PH>7
缓冲溶液
由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH值相对稳定。这种溶液称为缓冲溶液。
缓冲体系
1、弱
酸
和它的盐(如CH3COOH—CH3COONa)
2、弱
碱和它的盐(NH3·H2O---NH4Cl)
3、多元弱酸的酸式盐及其对应的次级盐
(如NaH2PO4---Na2HPO4)的水溶液组成。
H2C03/NaHCO3
H2C03/NaHCO3
小
结
练习:
1mol/L的NaHCO3溶液和1mol/L的NaHSO3溶液,都呈碱性吗?
(H2CO3的Ka1=4.4×10-7、Ka2=4.7×10-11
,
H2SO3?的Ka1=1.54×10-2??、?Ka2=1.02×10-7
)
谢谢
