苏教化学选修 化学反应原理专题1第一单元 化学反应中的热效应 (共40张PPT)
文档属性
| 名称 | 苏教化学选修 化学反应原理专题1第一单元 化学反应中的热效应 (共40张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 923.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 21:23:48 | ||
图片预览










文档简介
(共40张PPT)
第一章
化学反应与能量
第一节
化学反应与能量的变化
(焓变
反应热
热化学方程式)
思
考
①所有的燃烧反应
②所有的中和反应
③活泼金属与水、酸、碱的反应
④大多数化合反应
①大多数分解反应如:CaCO3高温分解
②强碱与铵盐Ba(OH)2.8H2O+NH4Cl
③水煤气的生成反应C+CO2
④
特殊的反应:H2+CuO,
C+H2O
,
你所知道的化学反应中有哪些是放热反应?哪些是吸热反应?
放热反应
吸热反应
一
、反应热
焓变
1、定义:
2、符号:△H
3、单位:kJ·mol-1或kJ/mol
在恒压的条件下,化学反应过程中所放出或吸收的热量称为反应的焓变。
化学反应过程中放出或吸收的热量(或转换成相应的热量)叫做化学反应的反应热。
①反应热描述的是化学反应前后的热量变化
②反应热描述的是一定温度下的热量变化
③任何化学反应都有反应热,表现为吸热反应或者放热反应
注意
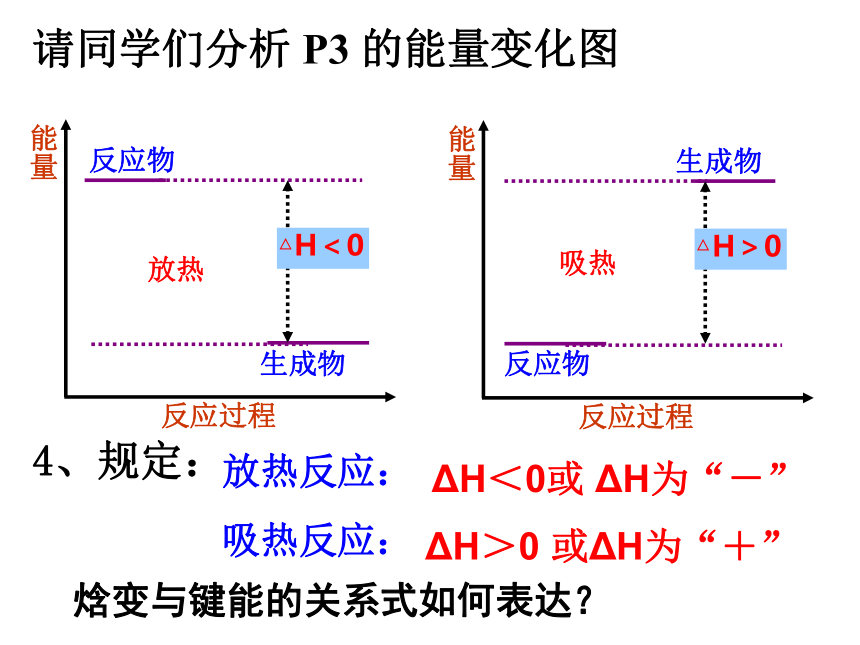
放热反应:
吸热反应:
ΔH<0或
ΔH为“-”
ΔH>0
或ΔH为“+”
放热
△H<0
吸热
△H>0
4、规定:
请同学们分析
P3
的能量变化图
焓变与键能的关系式如何表达?
5、焓变与键能的关系
ΔH
=
反应物的键能总和
生成物的键能总和
–
例
1:1
mol
C与
1
mol
H2O(g)
反应生成
l
mol
CO(g)
和1
mol
H2(g),需要吸收131.5
kJ的热量,该反应的反应热为△H
=
kJ/mol。
+131.5
例
2:拆开
1
mol
H-H键、1
mol
N-H键、1
mol
N≡N键分别需要的能量是436
kJ、391
kJ、946
kJ,则1mol
N2生成NH3的反应热为△H=
,
-92.0
kJ/mol
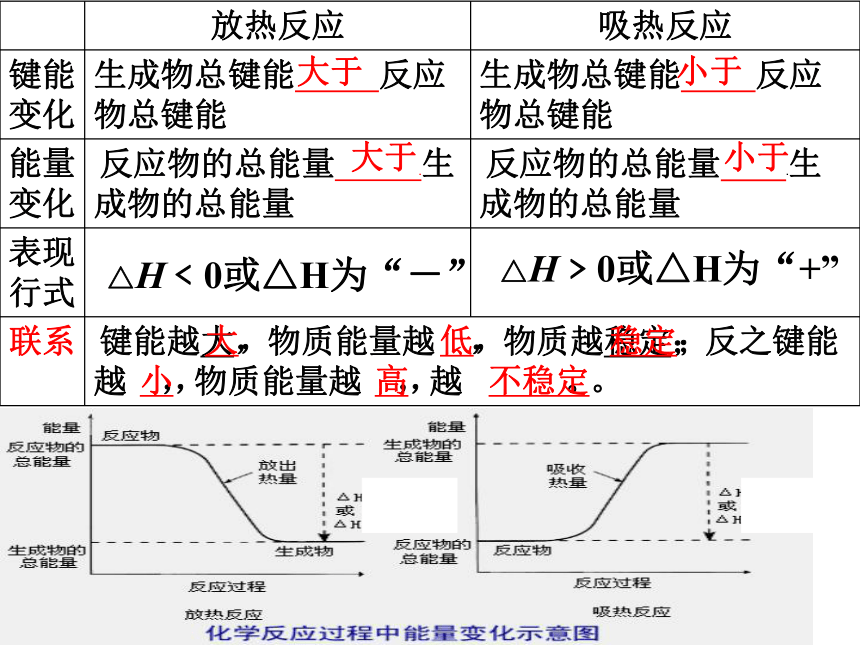
大于
大于
△H﹤0或△H为“-”
小于
小于
△H﹥0或△H为“+”
大,
低,
稳定;
小,
高,
不稳定。
放热反应
吸热反应
键能
变化
生成物总键能
反应物总键能
生成物总键能
反应物总键能
能量
变化
反应物的总能量
.生成物的总能量
反应物的总能量
.生成物的总能量
表现
行式
联系
键能越大,物质能量越低,物质越稳定;反之键能越小,物质能量越高,越不稳定。
练习
1.下列叙述正确的是(
)
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量
C
2.已知:H
+
H
═
H2;
△H
=
-436KJ/mol,则下列叙述正确的是(
)
A.
H
原子的能量高于
H2
的能量
B.
H
原子的能量低于
H2
的能量
C.
H
原子比
H2分子稳定
D.
H2分子比
H
原子稳定
D
4.下列过程中,需要吸收能量的是(
)
A.H+H=H2
B.H+Cl=HCl
C.I2→I+I
D.S+O2=SO2
C
书写热化学方程式的注意点:
1、需注明反应的温度和压强;
(如在25℃
101kPa下进行的反应,可不注明)
2、应注明反应物和生成物的状态;
3、对于相同的反应,当化学计量数不同时,其△H对应成比例。
2H2(g)+O2(g)==2H2O(g)
△H=-483.6kJ/mol
例1:当1mol气态H2与1mol气态Cl2反应生成2
mol气态HCl,放出184.6
kJ的热量,请写出该反应的热化学方程式。
H2(g)
+
Cl2(g)
=
2HCl(g)
?H
=-184.6
kJ/mol
2H2(g)
+
2Cl2(g)
=
4HCl(g)
?H
=-369.2
kJ/mol
例2:1mol
N2(g)
与适量O2(g)
反应生成NO
(g),需吸收68kJ的热量;写出热化学方程式。
N2(g)
+
2O2(g)
=
2NO(g)
?H
=
+
68
kJ/mol
例3、沼气的主要成分是甲烷。0.5
mol
CH4完全燃烧
生成CO2和H2O时,放出445
kJ的热量。则下列热化学方程式中正确的是(
)
A、2CH4(
g
)
+
4O2(
g
)
=
2CO2(
g
)
+
4H2O
(
l
)
ΔH
=
+
890
kJ/mol
B、CH4
+
2O2
=
CO2
+
H2O
ΔH
=
–
890
kJ/mol
C、CH4
(
g
)
+
2
O2
(
g
)
=
CO2
(
g
)
+
2
H2O
(
l
)
ΔH
=
–
890
kJ/mol
D、
1/2CH4
(
g
)
+
O2
(
g
)
=
1/2CO2
(
g
)
+
H2O
(
l
)
ΔH
=
–
890
kJ/mol
C
ΔH
=
–
445
kJ/mol
A
例4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是(
)
A.
H2O(g)=H2(g)+1/2O2(g)
ΔH=+242kJ·mol-1
B.
2H2(g)+O2(g)=
2H2O(l)
ΔH=-484kJ·mol-1
C.
H2(g)+1/2O2(g)=
H2O(g)
ΔH=+242kJ·mol-1
D.
2H2(g)+O2(g)=
2H2O(g)
ΔH=+484kJ·mol-1
练习:
A.
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-4b
kJ/mol
B.
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=+2b
kJ/mol
C.
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2b
kJ/mol
D.
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=+b
kJ/mol
已知充分燃烧a
g
乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
A
练习
2、已知
(1)H2(
g
)+1/2O2
(
g
)
=
H2O
(
g
)
ΔH1
=
a
kJ/mol
(2)2H2(
g
)+O2
(
g
)
=2H2O
(
g
)
ΔH2
=
b
kJ/mol
(3)
H2(
g
)+1/2O2
(
g
)
=
H2O
(
l
)
ΔH3
=
c
kJ/mol
(4)
2H2(
g
)+O2
(
g
)
=2H2O
(
l
)
ΔH4
=
d
kJ/mol
则a、b、c、d的关系正确的是
。
A、aB、b>d>0
C、2a=b<
0
D、2c=d>0
C
3、氢气在氧气中燃烧产生蓝色火焰,已知
破坏1
mol
H-H键消耗的能量为Q1kJ,
破坏1
mol
O
、
O键消耗的能量为Q2kJ,
形成1
mol
H-O键释放的能量为Q3kJ。
下列关系式中正确的是(
)
A.
2Q1
+
Q2
>
4Q3
B.
2Q1
+
Q2
<
4Q3
C.
Q1
+
Q2
<
Q3
D.
Q1
+
Q2
=
Q3
B
课堂练习
4、写出下列反应的热化学方程式:
1.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,
2.已知在25℃、101kPa下,1g
C8H18
(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ
热量。
2H2(g)+O2(g)=2H2O(
g
);
ΔH=-484kJ·mol-1
C8H18(l)+25/2
O2(g)=8CO2(g)
+9H2O(l)
△H=
-
5518kJ·mol
-1
3.46g
C2H5OH
(l)完全
燃烧生成CO2
(g)
和H2O
(l)
,放出1366.8KJ热量。
C2H5OH
(l)
+
3O2(g)=
2CO2(g)
+3H2O(l)
△H=
-
1366.8KJ·mol
-1
二、反应热的计算
【交流与讨论】
如何测定C(s)+1/2O2(g)==CO(g)的反应热△H?
①能直接测定吗?如何测?
②若不能直接测,怎么办?
不能直接测定
盖斯定律
不管化学反应是一步完成或分几步完成,其总的热效应是完全相同的。
化学反应的焓变(ΔH)只与反应体系的始态和终态有关,而与反应的途径无关。
△H=△H1+△H2
盖斯定律直观化
CO(g)
C(s)
CO2(g)
盖斯定律举例
+
如何测出这个反应的反应热:
①
C(s)+1/2O2(g)==CO(g)
;ΔH1=?
②CO(g)+1/2O2(g)=
CO2(g)
ΔH2
=
-283.0kJ.mol-1
③C(s)+O2(g)=CO2(g)
ΔH
=
-393.5kJ.mol-1
①
+
②
=
③
得ΔH1
+
ΔH2
=ΔH
则ΔH1
=ΔH
-
ΔH2
=-393.5kJ.mol-1+
283.0kJ.mol-1
=-110.5kJ.mol-1
自主归纳:
解题步骤
①确定待求的反应方程式;
②找出待求方程式中各物质出现在已知方程式的什么位置;
③根据未知方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;
④实施叠加并检验上述分析的正确与否。
盖斯定律应用
(1)若一个反应的焓变△H=a
kJ·mol?1,则其逆反
应的焓变△H=-a
kJ·mol?1
(2)若一个化学反应方程式可由另外几个反应
的化学方程式相加减而得到,则该反应的
焓变亦可以由这几个反应的焓变相加减而
得到。
例1:已知:
请计算下列反应的焓变。
(1)氢气与氯气反应生成1mol氯化氢气体
(2)氯化氢气体分解生成1mol氢气和1mol氯气
ΔH
=
-
92.
3kJ.mol-1
ΔH
=
+
184.
6kJ.mol-1
例2:根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变。
①C(石墨)+O2(g)=CO2(g)
ΔH1
=
-393.5kJ.mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ.mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H3=-2599.2kJ.mol-1
④2C(石墨)+H2
(g)=
C2H2(g)
ΔH
=
?
④=2×
①
+
1/2
×
②-
1/2
×
③
ΔH
=2×
ΔH1
+
1/2
×
△H2
-
1/2
×
△H3
=2
×(-393.5)+1/2
×(-571.6)-1/2×(-2599.2)
=+226.8kJ.mol-1
注意:
1、计量数的变化与反应热数值的变化要对应
2、反应方向发生改变反应热的符号也要改变
练习1:发射火箭,所用的能量来自于N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g)
△H1=
+
67.2kJ.mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(l)
△H2=-534kJ.mol-1
请写出发射火箭反应的热化学方程式。
2N2H4(g)+
2NO2(g)
=
3N2(g)
+
4H2O(l)
△H=-1135.2kJ.mol-1
练习2:已知
①
CO(g)
+
1/2
O2(g)
=
CO2(g)
ΔH1=
-283.0
kJ.mol-1
②
H2(g)
+
1/2
O2(g)
=
H2O(l)
ΔH2=
-285.8
kJ.mol-1
③C2H5OH(l)
+
3
O2(g)
=
2
CO2(g)
+
3
H2O(l)
ΔH3=
-
1370
kJ.mol-1
计算④2CO(g)+
4
H2(g)=
H2O(l)+
C2H5OH(l)
的ΔH
?????
【解】:①×2
+
②×4
-
③
=
④
?
所以,ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?=-283.2×2
-285.8×4
+1370
=-339.2
kJ.mol-1
练习3、同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
P4(s、白磷)+5O2(g)=P4O10(s);
=
-
2983.2
kJ.mol-1
P(s、红磷)+5/4O2(g)=1/4P4O10(s);
=
-738.5
kJ.mol-1
试写出白磷转化为红磷的热化学方程式
。
练习4:已知:
H2(g)+1/2
O2(g)
=H2O(g)
;
△H1
=
-241.8kJ.mol-1
H2(g)+
1/2
O2(g)
=H2O(l)
;
△H2
=
-285.8kJ.mol-1
求H2O(l)
=
H2O(g)
;
△H3
=?
△H3
=
+
44.0kJ.mol-1
练习5、0.3
mol的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态三氧化二硼和液态水,放出649.5
kJ热量,其热化学方程式为___________________________
。
1016.5
实践活动
中和反应
反应热的测定
反应热的测量与计算
几个相关概念间的关系
反应热
中和热
燃烧热
燃烧热
定义:在25℃、101kPa时,1mol纯物质完全
燃烧生成稳定的化合物时所放出的热量,叫
做该物质的燃烧热。
2.
燃烧热的单位一般用kJ/mol表示。
3.
燃烧热表示:
H2的燃烧热是285.8kJ/mol,则H2的燃烧热
表示为△Hc=-285.8kJ/mol
如何理解燃烧热?
1.
我们要从四个方面入手:
①
25℃、101kPa;
②
1mol纯物质;
③
完全燃烧;
④
稳定的化合物。
注:一般情况下,物质燃烧生成的稳定的化合物有:
C→CO2(g);H→H2O(l);S→SO2(g)。
2.
燃烧热表示的意义:
如:C的燃烧热为393.5kJ/mol,
它的意义表示在25℃、101kPa时,1molC完全燃烧生成CO2时放出393.5kJ的热量。
如何理解燃烧热?
3.
书写热化学方程式时,燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以1mol可燃物为标准来配平其余物质的化学计量数。
4.计算一定量物质完全燃烧时所放出的热量:Q=n(可燃物)×△Hc;式中Q为可燃物燃烧反应放出的热量,n(可燃物)为可燃物的物质的量,△Hc为可燃物的燃烧热。
中和反应反应热的测量
1.中和热的定义:
在稀溶液中,酸跟碱发生中和反应而生成1molH20,这时的反应热叫做中和热。
活动与探究
大烧杯(500
mL)、小烧杯(100
mL)、
温度计、
泡沫塑料或纸条、
泡沫塑料板或硬纸板(中心有两个小孔)、
环形玻璃搅拌棒。
2.
简易量热计的构造
实验步骤:阅读P4-5并回答问题
1.
中和热的测定
大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?对此装置,你有何更好的建议?
2. 温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么?
答案:1.两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失;填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。
2、因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而放热使温度计测量碱的温度不准确,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。
[练习]50
mL
0.50
mol/L盐酸与50
mL
0.55
mol/L
NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
。
(2)烧杯间填满碎纸条的作用是
。
(3)大烧杯上如不盖硬纸板,求得的中和热数值
(填“偏大”“偏小”“无影响”)
(4)实验中改用60
mL
0.50
mol/L盐酸跟50
mL
0.55
mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量
(填“相等”“不相等”),所求中和热
(填“相等”“不相等”),简述理由:
。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
;用50
mL
0.50mol/L
NaOH溶液进行上述实验,测得的中和热的数值会
。(均填“偏大”“偏小”“无影响”)
环形玻璃搅拌棒
减少实验过程中的热量损失
偏小
不等
相等
因为中和热是指酸跟碱发生中和反应生成1
mol
H2O所放出的热量,与酸碱的用量无关
偏小
偏小
第一章
化学反应与能量
第一节
化学反应与能量的变化
(焓变
反应热
热化学方程式)
思
考
①所有的燃烧反应
②所有的中和反应
③活泼金属与水、酸、碱的反应
④大多数化合反应
①大多数分解反应如:CaCO3高温分解
②强碱与铵盐Ba(OH)2.8H2O+NH4Cl
③水煤气的生成反应C+CO2
④
特殊的反应:H2+CuO,
C+H2O
,
你所知道的化学反应中有哪些是放热反应?哪些是吸热反应?
放热反应
吸热反应
一
、反应热
焓变
1、定义:
2、符号:△H
3、单位:kJ·mol-1或kJ/mol
在恒压的条件下,化学反应过程中所放出或吸收的热量称为反应的焓变。
化学反应过程中放出或吸收的热量(或转换成相应的热量)叫做化学反应的反应热。
①反应热描述的是化学反应前后的热量变化
②反应热描述的是一定温度下的热量变化
③任何化学反应都有反应热,表现为吸热反应或者放热反应
注意
放热反应:
吸热反应:
ΔH<0或
ΔH为“-”
ΔH>0
或ΔH为“+”
放热
△H<0
吸热
△H>0
4、规定:
请同学们分析
P3
的能量变化图
焓变与键能的关系式如何表达?
5、焓变与键能的关系
ΔH
=
反应物的键能总和
生成物的键能总和
–
例
1:1
mol
C与
1
mol
H2O(g)
反应生成
l
mol
CO(g)
和1
mol
H2(g),需要吸收131.5
kJ的热量,该反应的反应热为△H
=
kJ/mol。
+131.5
例
2:拆开
1
mol
H-H键、1
mol
N-H键、1
mol
N≡N键分别需要的能量是436
kJ、391
kJ、946
kJ,则1mol
N2生成NH3的反应热为△H=
,
-92.0
kJ/mol
大于
大于
△H﹤0或△H为“-”
小于
小于
△H﹥0或△H为“+”
大,
低,
稳定;
小,
高,
不稳定。
放热反应
吸热反应
键能
变化
生成物总键能
反应物总键能
生成物总键能
反应物总键能
能量
变化
反应物的总能量
.生成物的总能量
反应物的总能量
.生成物的总能量
表现
行式
联系
键能越大,物质能量越低,物质越稳定;反之键能越小,物质能量越高,越不稳定。
练习
1.下列叙述正确的是(
)
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量
C
2.已知:H
+
H
═
H2;
△H
=
-436KJ/mol,则下列叙述正确的是(
)
A.
H
原子的能量高于
H2
的能量
B.
H
原子的能量低于
H2
的能量
C.
H
原子比
H2分子稳定
D.
H2分子比
H
原子稳定
D
4.下列过程中,需要吸收能量的是(
)
A.H+H=H2
B.H+Cl=HCl
C.I2→I+I
D.S+O2=SO2
C
书写热化学方程式的注意点:
1、需注明反应的温度和压强;
(如在25℃
101kPa下进行的反应,可不注明)
2、应注明反应物和生成物的状态;
3、对于相同的反应,当化学计量数不同时,其△H对应成比例。
2H2(g)+O2(g)==2H2O(g)
△H=-483.6kJ/mol
例1:当1mol气态H2与1mol气态Cl2反应生成2
mol气态HCl,放出184.6
kJ的热量,请写出该反应的热化学方程式。
H2(g)
+
Cl2(g)
=
2HCl(g)
?H
=-184.6
kJ/mol
2H2(g)
+
2Cl2(g)
=
4HCl(g)
?H
=-369.2
kJ/mol
例2:1mol
N2(g)
与适量O2(g)
反应生成NO
(g),需吸收68kJ的热量;写出热化学方程式。
N2(g)
+
2O2(g)
=
2NO(g)
?H
=
+
68
kJ/mol
例3、沼气的主要成分是甲烷。0.5
mol
CH4完全燃烧
生成CO2和H2O时,放出445
kJ的热量。则下列热化学方程式中正确的是(
)
A、2CH4(
g
)
+
4O2(
g
)
=
2CO2(
g
)
+
4H2O
(
l
)
ΔH
=
+
890
kJ/mol
B、CH4
+
2O2
=
CO2
+
H2O
ΔH
=
–
890
kJ/mol
C、CH4
(
g
)
+
2
O2
(
g
)
=
CO2
(
g
)
+
2
H2O
(
l
)
ΔH
=
–
890
kJ/mol
D、
1/2CH4
(
g
)
+
O2
(
g
)
=
1/2CO2
(
g
)
+
H2O
(
l
)
ΔH
=
–
890
kJ/mol
C
ΔH
=
–
445
kJ/mol
A
例4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是(
)
A.
H2O(g)=H2(g)+1/2O2(g)
ΔH=+242kJ·mol-1
B.
2H2(g)+O2(g)=
2H2O(l)
ΔH=-484kJ·mol-1
C.
H2(g)+1/2O2(g)=
H2O(g)
ΔH=+242kJ·mol-1
D.
2H2(g)+O2(g)=
2H2O(g)
ΔH=+484kJ·mol-1
练习:
A.
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-4b
kJ/mol
B.
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=+2b
kJ/mol
C.
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=-2b
kJ/mol
D.
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H=+b
kJ/mol
已知充分燃烧a
g
乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
A
练习
2、已知
(1)H2(
g
)+1/2O2
(
g
)
=
H2O
(
g
)
ΔH1
=
a
kJ/mol
(2)2H2(
g
)+O2
(
g
)
=2H2O
(
g
)
ΔH2
=
b
kJ/mol
(3)
H2(
g
)+1/2O2
(
g
)
=
H2O
(
l
)
ΔH3
=
c
kJ/mol
(4)
2H2(
g
)+O2
(
g
)
=2H2O
(
l
)
ΔH4
=
d
kJ/mol
则a、b、c、d的关系正确的是
。
A、a
C、2a=b<
0
D、2c=d>0
C
3、氢气在氧气中燃烧产生蓝色火焰,已知
破坏1
mol
H-H键消耗的能量为Q1kJ,
破坏1
mol
O
、
O键消耗的能量为Q2kJ,
形成1
mol
H-O键释放的能量为Q3kJ。
下列关系式中正确的是(
)
A.
2Q1
+
Q2
>
4Q3
B.
2Q1
+
Q2
<
4Q3
C.
Q1
+
Q2
<
Q3
D.
Q1
+
Q2
=
Q3
B
课堂练习
4、写出下列反应的热化学方程式:
1.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,
2.已知在25℃、101kPa下,1g
C8H18
(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ
热量。
2H2(g)+O2(g)=2H2O(
g
);
ΔH=-484kJ·mol-1
C8H18(l)+25/2
O2(g)=8CO2(g)
+9H2O(l)
△H=
-
5518kJ·mol
-1
3.46g
C2H5OH
(l)完全
燃烧生成CO2
(g)
和H2O
(l)
,放出1366.8KJ热量。
C2H5OH
(l)
+
3O2(g)=
2CO2(g)
+3H2O(l)
△H=
-
1366.8KJ·mol
-1
二、反应热的计算
【交流与讨论】
如何测定C(s)+1/2O2(g)==CO(g)的反应热△H?
①能直接测定吗?如何测?
②若不能直接测,怎么办?
不能直接测定
盖斯定律
不管化学反应是一步完成或分几步完成,其总的热效应是完全相同的。
化学反应的焓变(ΔH)只与反应体系的始态和终态有关,而与反应的途径无关。
△H=△H1+△H2
盖斯定律直观化
CO(g)
C(s)
CO2(g)
盖斯定律举例
+
如何测出这个反应的反应热:
①
C(s)+1/2O2(g)==CO(g)
;ΔH1=?
②CO(g)+1/2O2(g)=
CO2(g)
ΔH2
=
-283.0kJ.mol-1
③C(s)+O2(g)=CO2(g)
ΔH
=
-393.5kJ.mol-1
①
+
②
=
③
得ΔH1
+
ΔH2
=ΔH
则ΔH1
=ΔH
-
ΔH2
=-393.5kJ.mol-1+
283.0kJ.mol-1
=-110.5kJ.mol-1
自主归纳:
解题步骤
①确定待求的反应方程式;
②找出待求方程式中各物质出现在已知方程式的什么位置;
③根据未知方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;
④实施叠加并检验上述分析的正确与否。
盖斯定律应用
(1)若一个反应的焓变△H=a
kJ·mol?1,则其逆反
应的焓变△H=-a
kJ·mol?1
(2)若一个化学反应方程式可由另外几个反应
的化学方程式相加减而得到,则该反应的
焓变亦可以由这几个反应的焓变相加减而
得到。
例1:已知:
请计算下列反应的焓变。
(1)氢气与氯气反应生成1mol氯化氢气体
(2)氯化氢气体分解生成1mol氢气和1mol氯气
ΔH
=
-
92.
3kJ.mol-1
ΔH
=
+
184.
6kJ.mol-1
例2:根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变。
①C(石墨)+O2(g)=CO2(g)
ΔH1
=
-393.5kJ.mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ.mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)
△H3=-2599.2kJ.mol-1
④2C(石墨)+H2
(g)=
C2H2(g)
ΔH
=
?
④=2×
①
+
1/2
×
②-
1/2
×
③
ΔH
=2×
ΔH1
+
1/2
×
△H2
-
1/2
×
△H3
=2
×(-393.5)+1/2
×(-571.6)-1/2×(-2599.2)
=+226.8kJ.mol-1
注意:
1、计量数的变化与反应热数值的变化要对应
2、反应方向发生改变反应热的符号也要改变
练习1:发射火箭,所用的能量来自于N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g)
△H1=
+
67.2kJ.mol-1
N2H4(g)+O2(g)==N2(g)+2H2O(l)
△H2=-534kJ.mol-1
请写出发射火箭反应的热化学方程式。
2N2H4(g)+
2NO2(g)
=
3N2(g)
+
4H2O(l)
△H=-1135.2kJ.mol-1
练习2:已知
①
CO(g)
+
1/2
O2(g)
=
CO2(g)
ΔH1=
-283.0
kJ.mol-1
②
H2(g)
+
1/2
O2(g)
=
H2O(l)
ΔH2=
-285.8
kJ.mol-1
③C2H5OH(l)
+
3
O2(g)
=
2
CO2(g)
+
3
H2O(l)
ΔH3=
-
1370
kJ.mol-1
计算④2CO(g)+
4
H2(g)=
H2O(l)+
C2H5OH(l)
的ΔH
?????
【解】:①×2
+
②×4
-
③
=
④
?
所以,ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?=-283.2×2
-285.8×4
+1370
=-339.2
kJ.mol-1
练习3、同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
P4(s、白磷)+5O2(g)=P4O10(s);
=
-
2983.2
kJ.mol-1
P(s、红磷)+5/4O2(g)=1/4P4O10(s);
=
-738.5
kJ.mol-1
试写出白磷转化为红磷的热化学方程式
。
练习4:已知:
H2(g)+1/2
O2(g)
=H2O(g)
;
△H1
=
-241.8kJ.mol-1
H2(g)+
1/2
O2(g)
=H2O(l)
;
△H2
=
-285.8kJ.mol-1
求H2O(l)
=
H2O(g)
;
△H3
=?
△H3
=
+
44.0kJ.mol-1
练习5、0.3
mol的气态高能燃料乙硼烷(B2H6)在氧气中完全燃烧,生成固态三氧化二硼和液态水,放出649.5
kJ热量,其热化学方程式为___________________________
。
1016.5
实践活动
中和反应
反应热的测定
反应热的测量与计算
几个相关概念间的关系
反应热
中和热
燃烧热
燃烧热
定义:在25℃、101kPa时,1mol纯物质完全
燃烧生成稳定的化合物时所放出的热量,叫
做该物质的燃烧热。
2.
燃烧热的单位一般用kJ/mol表示。
3.
燃烧热表示:
H2的燃烧热是285.8kJ/mol,则H2的燃烧热
表示为△Hc=-285.8kJ/mol
如何理解燃烧热?
1.
我们要从四个方面入手:
①
25℃、101kPa;
②
1mol纯物质;
③
完全燃烧;
④
稳定的化合物。
注:一般情况下,物质燃烧生成的稳定的化合物有:
C→CO2(g);H→H2O(l);S→SO2(g)。
2.
燃烧热表示的意义:
如:C的燃烧热为393.5kJ/mol,
它的意义表示在25℃、101kPa时,1molC完全燃烧生成CO2时放出393.5kJ的热量。
如何理解燃烧热?
3.
书写热化学方程式时,燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以1mol可燃物为标准来配平其余物质的化学计量数。
4.计算一定量物质完全燃烧时所放出的热量:Q=n(可燃物)×△Hc;式中Q为可燃物燃烧反应放出的热量,n(可燃物)为可燃物的物质的量,△Hc为可燃物的燃烧热。
中和反应反应热的测量
1.中和热的定义:
在稀溶液中,酸跟碱发生中和反应而生成1molH20,这时的反应热叫做中和热。
活动与探究
大烧杯(500
mL)、小烧杯(100
mL)、
温度计、
泡沫塑料或纸条、
泡沫塑料板或硬纸板(中心有两个小孔)、
环形玻璃搅拌棒。
2.
简易量热计的构造
实验步骤:阅读P4-5并回答问题
1.
中和热的测定
大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?对此装置,你有何更好的建议?
2. 温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么?
答案:1.两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失;填碎纸条的作用是为了达到保温隔热、减少实验过程中热量损失的目的。若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。
2、因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而放热使温度计测量碱的温度不准确,故要冲洗干净;冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。
[练习]50
mL
0.50
mol/L盐酸与50
mL
0.55
mol/L
NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
。
(2)烧杯间填满碎纸条的作用是
。
(3)大烧杯上如不盖硬纸板,求得的中和热数值
(填“偏大”“偏小”“无影响”)
(4)实验中改用60
mL
0.50
mol/L盐酸跟50
mL
0.55
mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量
(填“相等”“不相等”),所求中和热
(填“相等”“不相等”),简述理由:
。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
;用50
mL
0.50mol/L
NaOH溶液进行上述实验,测得的中和热的数值会
。(均填“偏大”“偏小”“无影响”)
环形玻璃搅拌棒
减少实验过程中的热量损失
偏小
不等
相等
因为中和热是指酸跟碱发生中和反应生成1
mol
H2O所放出的热量,与酸碱的用量无关
偏小
偏小
