高中化学沪科课标版高一上册第三章第三节化学键 32张ppt
文档属性
| 名称 | 高中化学沪科课标版高一上册第三章第三节化学键 32张ppt |
|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 00:00:00 | ||
图片预览










文档简介
第一章 物质结构 元素周期表
第三节 化学健
你有想过吗?
1.为什么一百多种元素可形成千千万万种物
质?元素的原子间通过什么作用形成如此丰富
多彩的物质呢?
2.物质中原子为什么总是按一定数目相结合?
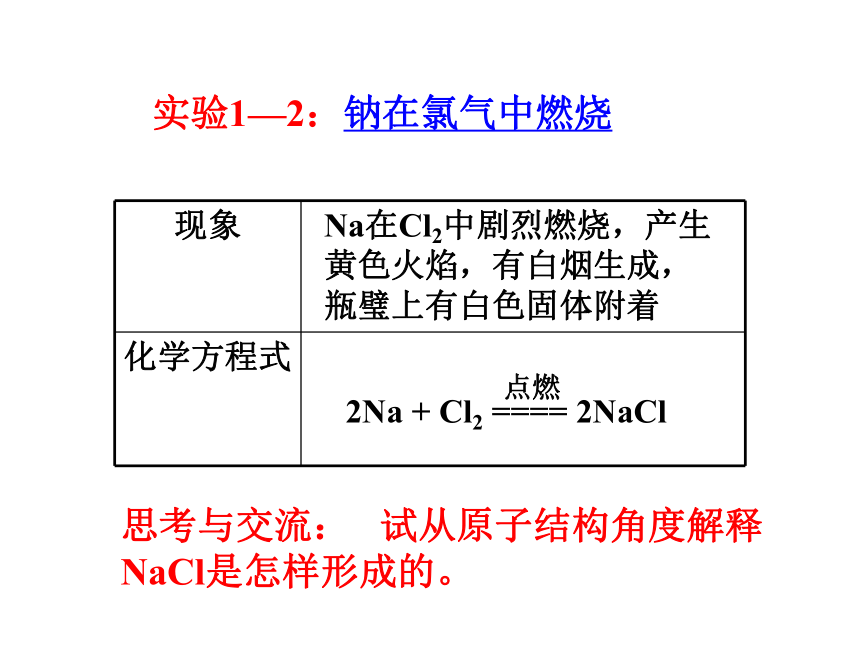
实验1—2:钠在氯气中燃烧
现象
化学方程式
Na在Cl2中剧烈燃烧,产生黄色火焰,有白烟生成,瓶璧上有白色固体附着
2Na + Cl2 ==== 2NaCl
点燃
思考与交流: 试从原子结构角度解释NaCl是怎样形成的。
Na+
Cl-
电子转移
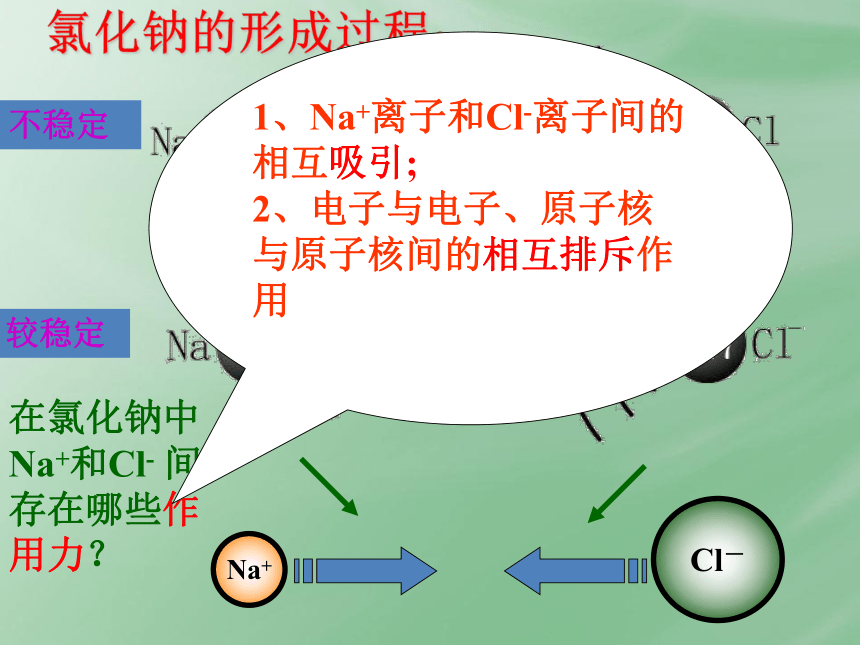
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na+和Cl- 间存在哪些作用力?
1、Na+离子和Cl-离子间的相互吸引;
2、电子与电子、原子核与原子核间的相互排斥作用
离子键
三、化学键
1、离子键
(1)定义:带相反电荷离子之间的相互作用称为离子键。
(2) 构成离子键的粒子:
阴、阳离子
(3)离子键的实质:
静电作用
静电引力
静电斥力
(4)成键条件
活泼金属和活泼非金属化合是易形成离子键。(AlCl3例外)
由离子键构成的化合物叫做离子化合物。
思考
哪些物质属于离子化合物,含有离子键?
1)活泼金属与活泼非金属形成的化合物。如NaCl、Na2O、K2S等
2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等
3)大多数盐:如Na2CO3、BaSO4
4)铵盐:如NH4Cl
小结:一般含金属元素的物质+铵盐。
课堂练习
练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠离子与氯离子通过离子键结合形成氯化钠
D
练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C. 11与17 D.6与14
C
二、表示方法
在元素符号周围用“.”或“x”表示最外层电子的式子叫电子式
·Mg ·
·S·
··
··
Cl ·
··
··
··
1.原子的电子式:
原子的电子式:在元素符号周围用小点“.”或小叉“×”来表示其最外层电子数。
· Si ·
·
·
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
Na ·
· Al ·
·
·P·
··
·
2.离子的电子式:
阳离子的电子式:简单阳离子的电子式就是它的离子符号,复杂阳离子(NH4+)例外。
Na+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出所带电荷“n-”。
[ 练习] 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
Al3+
w
‥
‥
‥
‥
练习:下列电子式有误的是 ( )
A.氯原子 ? Cl∶ B.硫离子∶S∶
C.溴离子 [∶Br∶] D.钙离子Ca2+
‥
‥
BC
3.离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并
AB型
AB2型
A2B型
式中: “+”表示“相遇”;
“ ”表示电子得失
“ ”表示“形成”.
4、用电子式表示离子化合物的形成过程:
Cl
Na
Cl
Na
S
K
K
化 学 键
k
S
2-
k
练习
例:用电子式表示硫化钠、溴化钙的形成过程
1.原子A的电子式 + 原子B的电子式→化合物的电子式
3.不能把“→”写成“=”。
4.在箭号右边,不能把相同离子归在一起。
2.用弧线标明电子的转移
使阴阳离子结合成化合物的静电作用,叫做离子键。
含有离子键的化合物一定是离子化合物
非金属元素之间的成键情况?
双方都不想失去电子。
我是非金属,我很少失电子
我才不会失电子给你
解决方法
H2 + Cl2 ==== 2HCl的动画演示
点燃
从微观角度分析氯化氢分子的形成过程
共用电子对
(1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
(2)仅含有共价键的化合物是共价化合物
成键微粒:原子
本质:共用电子对
2、共价键
形成共价键的条件
非金属元素的原子之间或非金属元素的原子与不活泼的某些金属元素原子之间形成共价键。
实例:
Cl2、CCl4、H2O、HF、HNO3、CO2 AlCl3
说明:非金属氢化物,酸分子,非金属氧化物,大多数有机物是共价化合物。
同种元素原子
不同种元素原子
原子吸引电子
能力相同
原子吸引电子
能力不相同
电子对不发生偏移成键原子不显电性
电子对发生偏移成键原子显电性
(3)共价键的类型
H H
··
Cl
··
··
H
··
··
极性共价键(极性键)
非极性共价键 (非极性键)
反馈检测:
1、下列物质中,只含有非极性共价键的是( )
A、 NaBr B、NaCI
C、 Br2 D、 H2S
C
CD
2、下列物质中,含有极性共价键的是( )
A、I 2 B、MgCI2
C、 NaOH D、 H2O
分子
共价化合物电子式
H2
N2
H2O
CO2
CH4
[练习] 写出下列物质的电子式和结构式。
电子式 结构式
HCl
H2O
NH3
N2
CO2
H2O2
H—Cl
H—O—H
H—N—H
H
—
N≡N
O=C=O
H—O—O—H
氢分子的形成:
H ·
氯化氢分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
H﹣H(结构式)
H﹣Cl(结构式)
4.用电子式表示物质形成过程
以氯化钠和氯化氢为例,比较离子键和共价键形成过程的区别?
没有形成阴阳离子,不需标出离子电荷、[ ]和电子转移。
碘
用电子式表示下列共价分子的形成过程
水
二氧化碳
氨
硫化氢
2
· C ·
·
·
+
··
· O ·
··
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
+
→
+
→
2 H ·
··
· O ·
··
﹕
H O H
﹕
﹕
﹕
2 H ·
+
→
﹕
H S H
﹕
﹕
﹕
··
· S ·
··
3 H ·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· I
··
··
:
I ·
··
··
:
··
··
I
··
:
I
··
:
:
从有关离子键和化合键的讨论中,我们可以看到,离子键使离子结合成离子化合物;共价键使原子结合成共价化合物.这种使离子相结合或原子相结合的作用力统称为化学键。
化学键
离子键与共价键的比较
离子键
共价键
概念
成键粒子
实质
存在范围
电子式
阴、阳离子间的静电作用
原子间通过共用电子对所形成的相互作用
阴、阳离子
原子
阴、阳离子间的静电作用
共用电子对
非金属元素之间(除铵盐外)
O
··
··
·
·
H
H
[小结]
活泼金属与活泼非金属元素之间
离子化合物与共价化合物的比较
离子化合物
共价化合物
概念
粒子间的作用力
熔沸点
硬度
溶解性
导电性
实例
含离子键的化合物
只含共价键的化合物
离子键
分子内是共价键,分子间是分子间作用力
强碱、活泼金属的氧化物、大多数盐
酸、非金属氧化物、非金属的氢化物、大多数有机物
较高
一般较低,个别很大
较大
一般较小,个别很大
一般易溶于水
部分溶于水
熔融或水溶液导电
熔融时不导电、水溶液部分导电
阅读课本P23讨论:
用化学键的观点来分析化学反应的本质是什么?
化学反应的实质
反应物分子被破坏
生成物分子生成
旧化学键被破坏
新化学键的生成
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
第三节 化学健
你有想过吗?
1.为什么一百多种元素可形成千千万万种物
质?元素的原子间通过什么作用形成如此丰富
多彩的物质呢?
2.物质中原子为什么总是按一定数目相结合?
实验1—2:钠在氯气中燃烧
现象
化学方程式
Na在Cl2中剧烈燃烧,产生黄色火焰,有白烟生成,瓶璧上有白色固体附着
2Na + Cl2 ==== 2NaCl
点燃
思考与交流: 试从原子结构角度解释NaCl是怎样形成的。
Na+
Cl-
电子转移
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na+和Cl- 间存在哪些作用力?
1、Na+离子和Cl-离子间的相互吸引;
2、电子与电子、原子核与原子核间的相互排斥作用
离子键
三、化学键
1、离子键
(1)定义:带相反电荷离子之间的相互作用称为离子键。
(2) 构成离子键的粒子:
阴、阳离子
(3)离子键的实质:
静电作用
静电引力
静电斥力
(4)成键条件
活泼金属和活泼非金属化合是易形成离子键。(AlCl3例外)
由离子键构成的化合物叫做离子化合物。
思考
哪些物质属于离子化合物,含有离子键?
1)活泼金属与活泼非金属形成的化合物。如NaCl、Na2O、K2S等
2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等
3)大多数盐:如Na2CO3、BaSO4
4)铵盐:如NH4Cl
小结:一般含金属元素的物质+铵盐。
课堂练习
练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠离子与氯离子通过离子键结合形成氯化钠
D
练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C. 11与17 D.6与14
C
二、表示方法
在元素符号周围用“.”或“x”表示最外层电子的式子叫电子式
·Mg ·
·S·
··
··
Cl ·
··
··
··
1.原子的电子式:
原子的电子式:在元素符号周围用小点“.”或小叉“×”来表示其最外层电子数。
· Si ·
·
·
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
Na ·
· Al ·
·
·P·
··
·
2.离子的电子式:
阳离子的电子式:简单阳离子的电子式就是它的离子符号,复杂阳离子(NH4+)例外。
Na+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出所带电荷“n-”。
[ 练习] 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
Al3+
w
‥
‥
‥
‥
练习:下列电子式有误的是 ( )
A.氯原子 ? Cl∶ B.硫离子∶S∶
C.溴离子 [∶Br∶] D.钙离子Ca2+
‥
‥
BC
3.离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并
AB型
AB2型
A2B型
式中: “+”表示“相遇”;
“ ”表示电子得失
“ ”表示“形成”.
4、用电子式表示离子化合物的形成过程:
Cl
Na
Cl
Na
S
K
K
化 学 键
k
S
2-
k
练习
例:用电子式表示硫化钠、溴化钙的形成过程
1.原子A的电子式 + 原子B的电子式→化合物的电子式
3.不能把“→”写成“=”。
4.在箭号右边,不能把相同离子归在一起。
2.用弧线标明电子的转移
使阴阳离子结合成化合物的静电作用,叫做离子键。
含有离子键的化合物一定是离子化合物
非金属元素之间的成键情况?
双方都不想失去电子。
我是非金属,我很少失电子
我才不会失电子给你
解决方法
H2 + Cl2 ==== 2HCl的动画演示
点燃
从微观角度分析氯化氢分子的形成过程
共用电子对
(1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。
(2)仅含有共价键的化合物是共价化合物
成键微粒:原子
本质:共用电子对
2、共价键
形成共价键的条件
非金属元素的原子之间或非金属元素的原子与不活泼的某些金属元素原子之间形成共价键。
实例:
Cl2、CCl4、H2O、HF、HNO3、CO2 AlCl3
说明:非金属氢化物,酸分子,非金属氧化物,大多数有机物是共价化合物。
同种元素原子
不同种元素原子
原子吸引电子
能力相同
原子吸引电子
能力不相同
电子对不发生偏移成键原子不显电性
电子对发生偏移成键原子显电性
(3)共价键的类型
H H
··
Cl
··
··
H
··
··
极性共价键(极性键)
非极性共价键 (非极性键)
反馈检测:
1、下列物质中,只含有非极性共价键的是( )
A、 NaBr B、NaCI
C、 Br2 D、 H2S
C
CD
2、下列物质中,含有极性共价键的是( )
A、I 2 B、MgCI2
C、 NaOH D、 H2O
分子
共价化合物电子式
H2
N2
H2O
CO2
CH4
[练习] 写出下列物质的电子式和结构式。
电子式 结构式
HCl
H2O
NH3
N2
CO2
H2O2
H—Cl
H—O—H
H—N—H
H
—
N≡N
O=C=O
H—O—O—H
氢分子的形成:
H ·
氯化氢分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
H﹣H(结构式)
H﹣Cl(结构式)
4.用电子式表示物质形成过程
以氯化钠和氯化氢为例,比较离子键和共价键形成过程的区别?
没有形成阴阳离子,不需标出离子电荷、[ ]和电子转移。
碘
用电子式表示下列共价分子的形成过程
水
二氧化碳
氨
硫化氢
2
· C ·
·
·
+
··
· O ·
··
→
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
+
→
+
→
2 H ·
··
· O ·
··
﹕
H O H
﹕
﹕
﹕
2 H ·
+
→
﹕
H S H
﹕
﹕
﹕
··
· S ·
··
3 H ·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
· I
··
··
:
I ·
··
··
:
··
··
I
··
:
I
··
:
:
从有关离子键和化合键的讨论中,我们可以看到,离子键使离子结合成离子化合物;共价键使原子结合成共价化合物.这种使离子相结合或原子相结合的作用力统称为化学键。
化学键
离子键与共价键的比较
离子键
共价键
概念
成键粒子
实质
存在范围
电子式
阴、阳离子间的静电作用
原子间通过共用电子对所形成的相互作用
阴、阳离子
原子
阴、阳离子间的静电作用
共用电子对
非金属元素之间(除铵盐外)
O
··
··
·
·
H
H
[小结]
活泼金属与活泼非金属元素之间
离子化合物与共价化合物的比较
离子化合物
共价化合物
概念
粒子间的作用力
熔沸点
硬度
溶解性
导电性
实例
含离子键的化合物
只含共价键的化合物
离子键
分子内是共价键,分子间是分子间作用力
强碱、活泼金属的氧化物、大多数盐
酸、非金属氧化物、非金属的氢化物、大多数有机物
较高
一般较低,个别很大
较大
一般较小,个别很大
一般易溶于水
部分溶于水
熔融或水溶液导电
熔融时不导电、水溶液部分导电
阅读课本P23讨论:
用化学键的观点来分析化学反应的本质是什么?
化学反应的实质
反应物分子被破坏
生成物分子生成
旧化学键被破坏
新化学键的生成
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
