苏教化学选修 化学反应原理专题2 第一单元 化学反应速率(共29张PPT)
文档属性
| 名称 | 苏教化学选修 化学反应原理专题2 第一单元 化学反应速率(共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 21:32:14 | ||
图片预览







文档简介
(共29张PPT)
化学反应速率
影响化学反应速率的因素
煤是古代植物埋藏在地下经历了复杂的变化,经过几亿年的时间,逐渐形成的固体可燃性矿物
大多数石油是由埋藏在地下沉积层中的有机物经过几百万年在75~200摄氏度的温度下形成的
影响化学反应速率的因素
内因:
反应物的性质
外因:
浓度、温度、压强、催化剂等
请选择合适的实验用品,设计实验,探究某一条件的改变对化学反应速率的影响。
实验方案设计
已知:
2
KMnO4+5
H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验目的
请选择合适的实验用品,设计实验,探究某一条件的改变对化学反应速率的影响。
实验方案设计
已知:
2
KMnO4+5
H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
②KMnO4+
H2C2O4
③H2O2分解
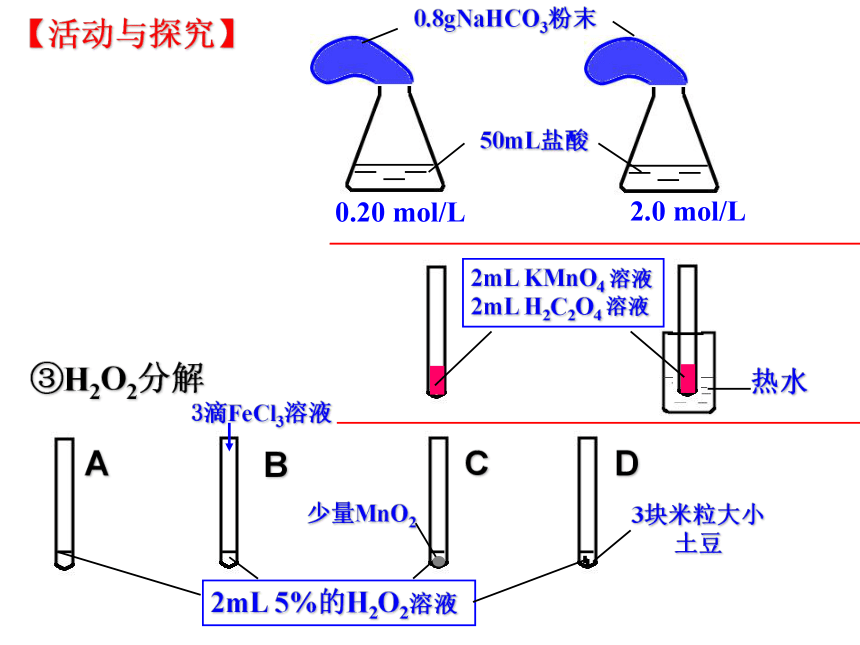
【活动与探究】
实验探究①
实验原理:
实验现象:
[结论]
NaHCO3+HCl=NaCl+H2O+CO2↑
其他条件相同时,增大反应物的浓度,反应速率增大;
减小反应物的浓度,反应速率减小
浓度
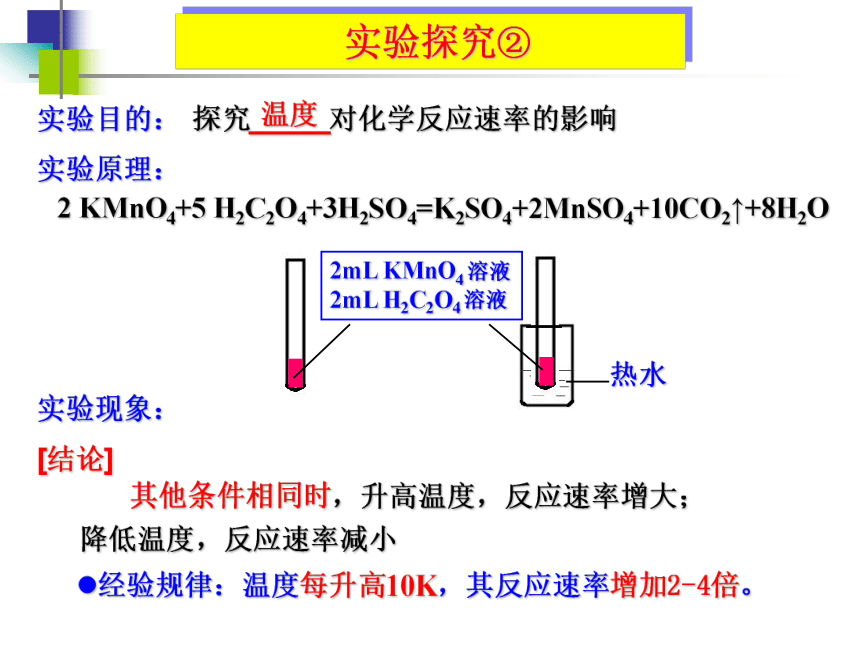
实验探究②
[结论]
实验原理:
实验现象:
2
KMnO4+5
H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
其他条件相同时,升高温度,反应速率增大;
降低温度,反应速率减小
经验规律:温度每升高10K,其反应速率增加2-4倍。
温度
实验探究③
实验原理:
实验现象:
[结论]
2H2O2=2H2O+O2↑
其他条件相同时,使用催化剂,能加快化学反应的速率
使用催化剂,能够成千上万倍的改变反应速率
催化剂
观察与思考
实验原理:
SO2+2H2S=3S+2H2O
其他条件相同时,对于有气体参加的反应,增大压强,反应速率增大;减小压强,反应速率减小
实验目的:探究压强对化学反应速率的影响
[结论]
实验现象:
影响化学反应速率的因素
增大反应物的浓度
使用催化剂
增大压强
升高温度
加快反应速率
影响化学反应速率的因素
1909年 W.
奥斯特瓦尔德(德国人)
从事催化作用、化学平衡以及反应速度的研究
1929年 A.
哈登(英国人),
冯·奥伊勒
–
歇尔平(瑞典人)
阐明了糖发酵过程和酶的作用
1963年 K.
齐格勒(德国人)、
G.
纳塔(意大利人)
发现了利用新型催化剂进行聚合的方法,并从事
这方面的基础研究
与化学反应速率相关的诺贝尔化学奖
1967年 R.G.W.诺里会、
G.
波特(英国人)
M.
艾根(德国人)
发明了测定快速化学反应的技术
1999年
A.
兹韦勒美籍埃及人
利用激光闪烁研究化学反应(飞秒化学)
2001年 威廉·诺尔斯、巴里·夏普莱斯(美国人)
、
野依良治(日本人)
在“手性催化氢化反应”领域取得成就
与化学反应速率相关的诺贝尔化学奖
自学:教材P36~P38的相关内容,能用碰撞理论简单解释浓度、压强、温度对反应速率的影响,用过渡态理论简单解释使用催化剂加快化学反应速率的原因。
[碰撞理论]
[过渡态理论]
①什么样的碰撞才能使反应发生?
②能发生上述碰撞的是什么分子?
③如何用碰撞理论简单解释浓度、压强、温度对反应速率的影响?
①活化能越低,反应速率越_____
②催化剂是通过_______反应的活化能来增大反应速率的
思考
【交流与讨论】
用碰撞理论简单解释浓度、压强、温度对反应速率的影响
有效碰撞
①什么样的碰撞才能使反应发生?
活化分子
②能发生上述碰撞的是什么分子?
碰撞理论
③如何应用碰撞理论简单解释浓度、压强、温度对反应速率的影响?
a.增加反应物的浓度,_______________________数目增多,___________次数增多,反应速率增大。
有效碰撞
单位体积内反应物的活化分子
b.增大压强,相当于增大__________________,所以________________________数目增多,_______次数增多,反应速率增大。
有效碰撞
单位体积内反应物的活化分子
增大反应物的浓度
c.升高温度,___________________________数目增多,
___________次数增多,反应速率增大。
有效碰撞
单位体积内反应物的活化分子
碰撞理论
单位体积活化分子数目增多
碰撞理论
增大反应物的浓度
升高
温度
增大压强减小体积
过渡态理论
【交流与讨论】
用过渡态理论简单解释使用催化剂加快化学反应速率的原因。
①活化能越低,反应速率越_____
②催化剂是通过_______反应的活化能来增大反应速率
大
降低
过渡态理论
无催化剂过渡态
Ea2
Ea1
有催化剂过渡态
过渡态理论
影响化学反应速率的因素
其他因素对反应速率的影响
(1)增大反应物接触面积,反应速率增大。
(2)光、电磁波、超声波、磁场等因素也会
对反应速率产生影响。
【练习与实践】
将一定浓度的盐酸倒入块状碳酸钙固体中,若作如下改变,其中能使最初的化学反应速率增大的是
(
)
A、盐酸的浓度不变,而使盐酸的用量增加一倍
B、盐酸的浓度增大一倍,但盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的质量
D、盐酸和碳酸钙不变,增大压强
E、将块状CaCO3用CaCO3粉末代替
BE
影响化学反应速率的因素
NO和
CO都是汽车尾气中的物质,它们能很缓慢地反应生成CO2
和
N2
,反应的化学方程式为2CO+2NO=N2+2CO2,为了控制大气污染,提出下列建议:
A、使用催化剂
B、改变压强
C、提高反应温度
你认为可行的方法是____________________
理由是___________________________
A
【练习与实践】
影响化学反应速率的因素
(1)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2产生的速率(V)与时间(t)的变化情况如图,其中0~t1的速率变化的主要原因是
;
t1~t2速率变化的主要原因是主要原因是
。
解释下列化学反应的反应速率的变化关系曲线。
【练习与实践】
影响化学反应速率的因素
(2)过氧化氢在酶的催化作用下的分解反应速率随
温度的变化关系。
【练习与实践】
解释下列化学反应的反应速率的变化关系曲线。
影响化学反应速率的因素
【趣味实验】滴水生烟
实验原理:碘与锌反应(滴加几滴水)时放出大量
的热,使碘升华为碘蒸气
实验步骤:
1.用药匙分别取少量干燥的碘和锌粉,在纸上混
合均匀。
2.用小纸条将碘和锌的混合物送入大试管的底部,
用带滴管(预先吸入水)的橡胶塞塞住试管口。
3.向试管的混合物中逐滴滴入3滴水,观察现象。
思考:水在这个反应中到底起什么作用?
如何设计实验证明你的判断?
影响化学反应速率的因素
化学反应速率
影响化学反应速率的因素
煤是古代植物埋藏在地下经历了复杂的变化,经过几亿年的时间,逐渐形成的固体可燃性矿物
大多数石油是由埋藏在地下沉积层中的有机物经过几百万年在75~200摄氏度的温度下形成的
影响化学反应速率的因素
内因:
反应物的性质
外因:
浓度、温度、压强、催化剂等
请选择合适的实验用品,设计实验,探究某一条件的改变对化学反应速率的影响。
实验方案设计
已知:
2
KMnO4+5
H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验目的
请选择合适的实验用品,设计实验,探究某一条件的改变对化学反应速率的影响。
实验方案设计
已知:
2
KMnO4+5
H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
②KMnO4+
H2C2O4
③H2O2分解
【活动与探究】
实验探究①
实验原理:
实验现象:
[结论]
NaHCO3+HCl=NaCl+H2O+CO2↑
其他条件相同时,增大反应物的浓度,反应速率增大;
减小反应物的浓度,反应速率减小
浓度
实验探究②
[结论]
实验原理:
实验现象:
2
KMnO4+5
H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
其他条件相同时,升高温度,反应速率增大;
降低温度,反应速率减小
经验规律:温度每升高10K,其反应速率增加2-4倍。
温度
实验探究③
实验原理:
实验现象:
[结论]
2H2O2=2H2O+O2↑
其他条件相同时,使用催化剂,能加快化学反应的速率
使用催化剂,能够成千上万倍的改变反应速率
催化剂
观察与思考
实验原理:
SO2+2H2S=3S+2H2O
其他条件相同时,对于有气体参加的反应,增大压强,反应速率增大;减小压强,反应速率减小
实验目的:探究压强对化学反应速率的影响
[结论]
实验现象:
影响化学反应速率的因素
增大反应物的浓度
使用催化剂
增大压强
升高温度
加快反应速率
影响化学反应速率的因素
1909年 W.
奥斯特瓦尔德(德国人)
从事催化作用、化学平衡以及反应速度的研究
1929年 A.
哈登(英国人),
冯·奥伊勒
–
歇尔平(瑞典人)
阐明了糖发酵过程和酶的作用
1963年 K.
齐格勒(德国人)、
G.
纳塔(意大利人)
发现了利用新型催化剂进行聚合的方法,并从事
这方面的基础研究
与化学反应速率相关的诺贝尔化学奖
1967年 R.G.W.诺里会、
G.
波特(英国人)
M.
艾根(德国人)
发明了测定快速化学反应的技术
1999年
A.
兹韦勒美籍埃及人
利用激光闪烁研究化学反应(飞秒化学)
2001年 威廉·诺尔斯、巴里·夏普莱斯(美国人)
、
野依良治(日本人)
在“手性催化氢化反应”领域取得成就
与化学反应速率相关的诺贝尔化学奖
自学:教材P36~P38的相关内容,能用碰撞理论简单解释浓度、压强、温度对反应速率的影响,用过渡态理论简单解释使用催化剂加快化学反应速率的原因。
[碰撞理论]
[过渡态理论]
①什么样的碰撞才能使反应发生?
②能发生上述碰撞的是什么分子?
③如何用碰撞理论简单解释浓度、压强、温度对反应速率的影响?
①活化能越低,反应速率越_____
②催化剂是通过_______反应的活化能来增大反应速率的
思考
【交流与讨论】
用碰撞理论简单解释浓度、压强、温度对反应速率的影响
有效碰撞
①什么样的碰撞才能使反应发生?
活化分子
②能发生上述碰撞的是什么分子?
碰撞理论
③如何应用碰撞理论简单解释浓度、压强、温度对反应速率的影响?
a.增加反应物的浓度,_______________________数目增多,___________次数增多,反应速率增大。
有效碰撞
单位体积内反应物的活化分子
b.增大压强,相当于增大__________________,所以________________________数目增多,_______次数增多,反应速率增大。
有效碰撞
单位体积内反应物的活化分子
增大反应物的浓度
c.升高温度,___________________________数目增多,
___________次数增多,反应速率增大。
有效碰撞
单位体积内反应物的活化分子
碰撞理论
单位体积活化分子数目增多
碰撞理论
增大反应物的浓度
升高
温度
增大压强减小体积
过渡态理论
【交流与讨论】
用过渡态理论简单解释使用催化剂加快化学反应速率的原因。
①活化能越低,反应速率越_____
②催化剂是通过_______反应的活化能来增大反应速率
大
降低
过渡态理论
无催化剂过渡态
Ea2
Ea1
有催化剂过渡态
过渡态理论
影响化学反应速率的因素
其他因素对反应速率的影响
(1)增大反应物接触面积,反应速率增大。
(2)光、电磁波、超声波、磁场等因素也会
对反应速率产生影响。
【练习与实践】
将一定浓度的盐酸倒入块状碳酸钙固体中,若作如下改变,其中能使最初的化学反应速率增大的是
(
)
A、盐酸的浓度不变,而使盐酸的用量增加一倍
B、盐酸的浓度增大一倍,但盐酸的用量减少到原来的一半
C、盐酸的浓度和用量都不变,增加碳酸钙的质量
D、盐酸和碳酸钙不变,增大压强
E、将块状CaCO3用CaCO3粉末代替
BE
影响化学反应速率的因素
NO和
CO都是汽车尾气中的物质,它们能很缓慢地反应生成CO2
和
N2
,反应的化学方程式为2CO+2NO=N2+2CO2,为了控制大气污染,提出下列建议:
A、使用催化剂
B、改变压强
C、提高反应温度
你认为可行的方法是____________________
理由是___________________________
A
【练习与实践】
影响化学反应速率的因素
(1)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2产生的速率(V)与时间(t)的变化情况如图,其中0~t1的速率变化的主要原因是
;
t1~t2速率变化的主要原因是主要原因是
。
解释下列化学反应的反应速率的变化关系曲线。
【练习与实践】
影响化学反应速率的因素
(2)过氧化氢在酶的催化作用下的分解反应速率随
温度的变化关系。
【练习与实践】
解释下列化学反应的反应速率的变化关系曲线。
影响化学反应速率的因素
【趣味实验】滴水生烟
实验原理:碘与锌反应(滴加几滴水)时放出大量
的热,使碘升华为碘蒸气
实验步骤:
1.用药匙分别取少量干燥的碘和锌粉,在纸上混
合均匀。
2.用小纸条将碘和锌的混合物送入大试管的底部,
用带滴管(预先吸入水)的橡胶塞塞住试管口。
3.向试管的混合物中逐滴滴入3滴水,观察现象。
思考:水在这个反应中到底起什么作用?
如何设计实验证明你的判断?
影响化学反应速率的因素
