苏教版高中化学选修 化学反应原理专题2 第三单元 化学平衡的移动----化学平衡常数(共21张PPT)
文档属性
| 名称 | 苏教版高中化学选修 化学反应原理专题2 第三单元 化学平衡的移动----化学平衡常数(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 826.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 21:39:57 | ||
图片预览








文档简介
(共21张PPT)
组织建设
化学
·
选修4
2.2.3
化学平衡常数
交流与讨论:
P48
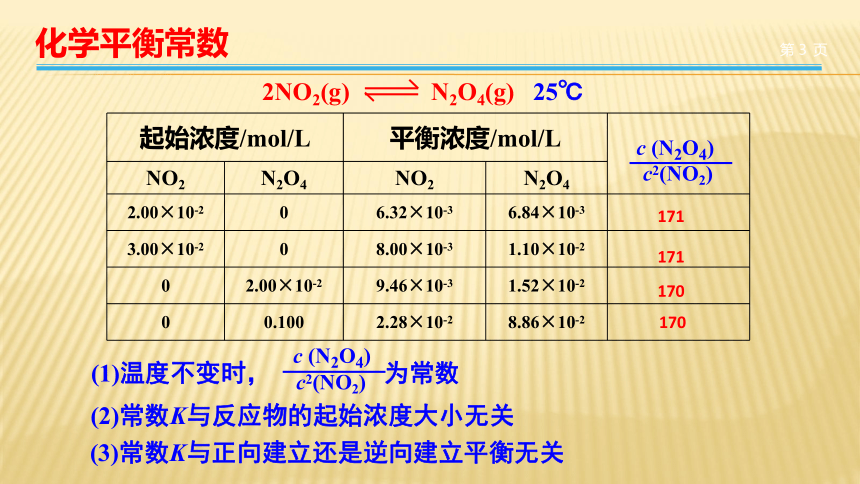
二氧化氮
四氧化二氮的相互转化是一个可逆反应:
25℃,
如果用不同起始浓度的二氧化氮或四氧化二氮进行反应,平衡后得到下列实验数据,请填写空格,总结归纳平衡时各浓度的关系。
2NO2(g)
N2O4(g)
起始浓度/mol/L
平衡浓度/mol/L
NO2
N2O4
NO2
N2O4
2.00×10-2
0
6.32×10-3
6.84×10-3
3.00×10-2
0
8.00×10-3
1.10×10-2
0
2.00×10-2
9.46×10-3
1.52×10-2
0
0.100
2.28×10-2
8.86×10-2
2NO2(g)
N2O4(g)
25℃
c
(N2O4)
c2(NO2)
(2)常数K与反应物的起始浓度大小无关
(3)常数K与正向建立还是逆向建立平衡无关
(1)温度不变时,
为常数
c
(N2O4)
c2(NO2)
171
171
170
170
1、定义
在一定温度下,对达到平衡的一个可逆反应而言,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。
2、表达式
符号
一、化学平衡常数
K=
cc(C)cd(D)
ca(A)cb(B)
反应aA+bB
cC+dD
K
3、单位
浓度单位为mol·L-1,K单位为(mol·L-1)?n,一般情况下不写单位
K值越大,反应进行的程度越大。
4、化学平衡常数的意义
定量地衡量化学反应进行的程度
交流与讨论:P49
阅读分析表2-8和表2-9,总结可逆反应平衡常数的使用条件和书写平衡常数表达式的注意事项。
写出下列反应平衡常数的表达式
2SO2+O2
2SO3
H2+I2
2HI
CaCO3(s)
CaO(s)+CO2(g)
CO2(g)+H2(g)
CO(g)+H2O(l)
K
=
c(CO2)
?
?
?
5、平衡常数表达式与方程式的关系
(1)纯液体(如水)
和固体不出现在K表达式中
?
K1
=
K22
(2)K表达式与化学方程式书写形式有关
2NO2(g)
2NO(g)
+
O2(g)
K2
2NO(g)
+
O2(g)
2NO2(g)
K1
?
(3)同一化学反应,正、逆反应的平衡常数互为倒数
N2+3H2
2NH3
K1
已知反应如下:
FeO(s)+CO(g)
Fe(s)+CO2(g)
△H>0
其平衡常数为:_______________。已知1100℃,K=0.263。1100℃时,测得c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应_______(填“是”或“否”)
处于平衡状态。
否
?
■利用K可判断反应是否建立平衡状态
?
浓度商
①
QC<K
,反应向正方向进行
②
QC=K
,反应处于平衡状态
③QC>K
,反应向逆方向进行
6、平衡常数的应用
■以“三段式”进行化学平衡常数的计算
起始浓度(mol/L):a
b
0
0
转化浓度(mol/L):mx
nx
px
qx
平衡浓度(mol/L):a-mx
b-nx
px
qx
mA
+
nB
pC
+
qD
K
=
?
=
?
二
平衡转化率
×100%
?
=
该反应物的起始浓度-该反应物的平衡浓度
该反应物的起始浓度
可逆反应在一定条件下达到平衡时,某一反应物的平衡转化率为:
除了化学平衡常数外,还有没有其他方法能用来表示化学反应进行的限度呢?
平衡转化率的意义:能表示在一定温度和一定
起始浓度下反应进行的限度。
【例1】某温度下,向10L真空容器中注入1.00
mol
H2(g)
和
1.00
mol
I2(g),反应平衡后I2(g)的浓度为0.020
0
mol·L-1。试求该温度下
H2(g)+I2(g)
2HI(g)的平衡常数。
平衡常数和转化率的计算
解:据题意可知,起始时c(H2)=c(I2)=0.100mol·L-1,平衡时c(H2)=c(I2)=0.0200mol·L-1,生成的c(HI)
=
0.160mol·L-1
H2(g)
+
I2(g)
2HI(g)
起始时各物质的浓度/mol·L-1
0.100
0.100
0
变化的各物质的浓度/mol·L-1
平衡时各物质的浓度/mol·L-1
0.0800
0.0800
0.160
0.0200
0.0200
0.160
K
=
(0.160)2
(0.0200)2
=
64.0
c2(HI)
c(H2)
·
c(I2)
=
答:平衡常数为64.0。
平衡常数和转化率的计算
【例2】在一密闭容器中,CO与H2O混合加热到800℃达到下列平衡:
CO(g)+H2O(g)
CO2(g)+H2(g)
K=1.00
若反应开始时CO和H2O的浓度分别为0.200
mol·L-1
和1.00mol·L-1,求达到平衡时CO转化为CO2转化率是多少?
平衡常数和转化率的计算
c(平)/mol·L-1
0.200-x
0.200-x
x
x
解得:
x
=
0.100
解:设平衡时CO2和H2的浓度为x
mol·L-1
K
=
x2
(0.200-x)(0.200-x)
CO(g)
+
H2O(g)
CO2(g)
+
H2(g)
c(始)
/mol·L-1
0.200
1.00
0
0
c(变)/mol·L-1
x
x
x
x
=
1.00
c(CO2)
·
c(H2)
c(CO)
·c(H2O)
=
平衡常数和转化率的计算
答:平衡时CO转化为CO2转化率是50%
。
?
=
×100%=
50%
0.100
0.200
平衡常数和转化率的计算
850K时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得:SO2、O2和SO3的浓度分别为6.0×10-3
mol·L-1
、8.0×10-3
mol·L-1
和
4.4×10-2
mol·L-1。计算:
(1)该温度下反应
的平
衡常数。
(2)达平衡状态时,
SO2的转化率。
2SO2+O2
2SO3
平衡常数和转化率的计算
练习1、450K时一容器中通入氮N2和H2,在一定条件下反应达平衡后,测得C(N2)=3mol/L,C(H2)=9mol/L,C(NH3)
=4
mol/L,求K及N2和H2的起始浓度。
3
9
4
0
4
2
6
5
15
?
解:
N2
+
3H2
2NH3
起始浓度(mol/L)
转化浓度(mol/L)
平衡浓度(mol/L)
练习2、在一定体积的密闭容器中,进行如下化学反应:
CO2(g)
+
H2(g)
CO(g)
+H2O(g),其化学平衡常数K和温度t的关系如下表:
某温度下反应达到平衡,各物质的平衡浓度符合下式:
c(CO2)·c(H2)
=
c(CO)·c(H2O),试判断此时的温度为
℃。
t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
830
练习3、
一定温度下的密闭容器中存在如下反应:
2SO2+O2
2SO3
已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
当SO2转化率为50%时,该反应
(“是”或“否”)达到平衡状态,若未达到,则反应向
(“正”或“逆”)方向进行。
否
正
应用
形式和特点
3、K大小只与温度有关,与反应物和生成物的浓度无关
1、K与方程式书写形式有关,纯液体和固体不出现在K中
4、K值越大,反应物转化率越大,反应越完全
2、不同方程式呈相加(或相减)关系,则K间可相乘(或相除)
应用
形式和特点
1、对比平衡常数K与浓度熵Qc大小判断是否达到平衡或反应方向
2、以“三段式”进行化学平衡常数的计算(转化率等)
组织建设
化学
·
选修4
2.2.3
化学平衡常数
交流与讨论:
P48
二氧化氮
四氧化二氮的相互转化是一个可逆反应:
25℃,
如果用不同起始浓度的二氧化氮或四氧化二氮进行反应,平衡后得到下列实验数据,请填写空格,总结归纳平衡时各浓度的关系。
2NO2(g)
N2O4(g)
起始浓度/mol/L
平衡浓度/mol/L
NO2
N2O4
NO2
N2O4
2.00×10-2
0
6.32×10-3
6.84×10-3
3.00×10-2
0
8.00×10-3
1.10×10-2
0
2.00×10-2
9.46×10-3
1.52×10-2
0
0.100
2.28×10-2
8.86×10-2
2NO2(g)
N2O4(g)
25℃
c
(N2O4)
c2(NO2)
(2)常数K与反应物的起始浓度大小无关
(3)常数K与正向建立还是逆向建立平衡无关
(1)温度不变时,
为常数
c
(N2O4)
c2(NO2)
171
171
170
170
1、定义
在一定温度下,对达到平衡的一个可逆反应而言,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。
2、表达式
符号
一、化学平衡常数
K=
cc(C)cd(D)
ca(A)cb(B)
反应aA+bB
cC+dD
K
3、单位
浓度单位为mol·L-1,K单位为(mol·L-1)?n,一般情况下不写单位
K值越大,反应进行的程度越大。
4、化学平衡常数的意义
定量地衡量化学反应进行的程度
交流与讨论:P49
阅读分析表2-8和表2-9,总结可逆反应平衡常数的使用条件和书写平衡常数表达式的注意事项。
写出下列反应平衡常数的表达式
2SO2+O2
2SO3
H2+I2
2HI
CaCO3(s)
CaO(s)+CO2(g)
CO2(g)+H2(g)
CO(g)+H2O(l)
K
=
c(CO2)
?
?
?
5、平衡常数表达式与方程式的关系
(1)纯液体(如水)
和固体不出现在K表达式中
?
K1
=
K22
(2)K表达式与化学方程式书写形式有关
2NO2(g)
2NO(g)
+
O2(g)
K2
2NO(g)
+
O2(g)
2NO2(g)
K1
?
(3)同一化学反应,正、逆反应的平衡常数互为倒数
N2+3H2
2NH3
K1
已知反应如下:
FeO(s)+CO(g)
Fe(s)+CO2(g)
△H>0
其平衡常数为:_______________。已知1100℃,K=0.263。1100℃时,测得c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应_______(填“是”或“否”)
处于平衡状态。
否
?
■利用K可判断反应是否建立平衡状态
?
浓度商
①
QC<K
,反应向正方向进行
②
QC=K
,反应处于平衡状态
③QC>K
,反应向逆方向进行
6、平衡常数的应用
■以“三段式”进行化学平衡常数的计算
起始浓度(mol/L):a
b
0
0
转化浓度(mol/L):mx
nx
px
qx
平衡浓度(mol/L):a-mx
b-nx
px
qx
mA
+
nB
pC
+
qD
K
=
?
=
?
二
平衡转化率
×100%
?
=
该反应物的起始浓度-该反应物的平衡浓度
该反应物的起始浓度
可逆反应在一定条件下达到平衡时,某一反应物的平衡转化率为:
除了化学平衡常数外,还有没有其他方法能用来表示化学反应进行的限度呢?
平衡转化率的意义:能表示在一定温度和一定
起始浓度下反应进行的限度。
【例1】某温度下,向10L真空容器中注入1.00
mol
H2(g)
和
1.00
mol
I2(g),反应平衡后I2(g)的浓度为0.020
0
mol·L-1。试求该温度下
H2(g)+I2(g)
2HI(g)的平衡常数。
平衡常数和转化率的计算
解:据题意可知,起始时c(H2)=c(I2)=0.100mol·L-1,平衡时c(H2)=c(I2)=0.0200mol·L-1,生成的c(HI)
=
0.160mol·L-1
H2(g)
+
I2(g)
2HI(g)
起始时各物质的浓度/mol·L-1
0.100
0.100
0
变化的各物质的浓度/mol·L-1
平衡时各物质的浓度/mol·L-1
0.0800
0.0800
0.160
0.0200
0.0200
0.160
K
=
(0.160)2
(0.0200)2
=
64.0
c2(HI)
c(H2)
·
c(I2)
=
答:平衡常数为64.0。
平衡常数和转化率的计算
【例2】在一密闭容器中,CO与H2O混合加热到800℃达到下列平衡:
CO(g)+H2O(g)
CO2(g)+H2(g)
K=1.00
若反应开始时CO和H2O的浓度分别为0.200
mol·L-1
和1.00mol·L-1,求达到平衡时CO转化为CO2转化率是多少?
平衡常数和转化率的计算
c(平)/mol·L-1
0.200-x
0.200-x
x
x
解得:
x
=
0.100
解:设平衡时CO2和H2的浓度为x
mol·L-1
K
=
x2
(0.200-x)(0.200-x)
CO(g)
+
H2O(g)
CO2(g)
+
H2(g)
c(始)
/mol·L-1
0.200
1.00
0
0
c(变)/mol·L-1
x
x
x
x
=
1.00
c(CO2)
·
c(H2)
c(CO)
·c(H2O)
=
平衡常数和转化率的计算
答:平衡时CO转化为CO2转化率是50%
。
?
=
×100%=
50%
0.100
0.200
平衡常数和转化率的计算
850K时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得:SO2、O2和SO3的浓度分别为6.0×10-3
mol·L-1
、8.0×10-3
mol·L-1
和
4.4×10-2
mol·L-1。计算:
(1)该温度下反应
的平
衡常数。
(2)达平衡状态时,
SO2的转化率。
2SO2+O2
2SO3
平衡常数和转化率的计算
练习1、450K时一容器中通入氮N2和H2,在一定条件下反应达平衡后,测得C(N2)=3mol/L,C(H2)=9mol/L,C(NH3)
=4
mol/L,求K及N2和H2的起始浓度。
3
9
4
0
4
2
6
5
15
?
解:
N2
+
3H2
2NH3
起始浓度(mol/L)
转化浓度(mol/L)
平衡浓度(mol/L)
练习2、在一定体积的密闭容器中,进行如下化学反应:
CO2(g)
+
H2(g)
CO(g)
+H2O(g),其化学平衡常数K和温度t的关系如下表:
某温度下反应达到平衡,各物质的平衡浓度符合下式:
c(CO2)·c(H2)
=
c(CO)·c(H2O),试判断此时的温度为
℃。
t℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
830
练习3、
一定温度下的密闭容器中存在如下反应:
2SO2+O2
2SO3
已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L,经测定该反应在该温度下的平衡常数K≈19,试判断:
当SO2转化率为50%时,该反应
(“是”或“否”)达到平衡状态,若未达到,则反应向
(“正”或“逆”)方向进行。
否
正
应用
形式和特点
3、K大小只与温度有关,与反应物和生成物的浓度无关
1、K与方程式书写形式有关,纯液体和固体不出现在K中
4、K值越大,反应物转化率越大,反应越完全
2、不同方程式呈相加(或相减)关系,则K间可相乘(或相除)
应用
形式和特点
1、对比平衡常数K与浓度熵Qc大小判断是否达到平衡或反应方向
2、以“三段式”进行化学平衡常数的计算(转化率等)
