苏教化学选修 化学反应原理专题1第一单元 化学反应中的热效应(共36张PPT)
文档属性
| 名称 | 苏教化学选修 化学反应原理专题1第一单元 化学反应中的热效应(共36张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 21:41:01 | ||
图片预览










文档简介
(共36张PPT)
专题1
化学反应与能量变化
第一单元
化学反应中的热效应
化学反应的焓变
【学习目标】
1.了解反应热和焓变的含义,知道放热反应和吸热反应的概念,理解化学反应过程中能量变化的原因并能利用键能计算反应的焓变。
2.知道热化学方程式的概念,能通过比较的方法理解热化学方程式与化学方程式的区别,能正确书写热化学方程式。
【猜一猜】
自热米饭最有可能采用下列哪种方式加热?
A.太阳能加热
B.生石灰和水反应加热
简易冰袋可以在野外短时期保存食物的原理?
【猜一猜】
原理:利用里面的物质发生化学反应从环境吸收热量.
我们知道所有的化学反应过程中既有物质变化,又有能量变化,且释放或吸收能量是化学反应中能量变化的主要形式之一。高一时我们已经学过很多化学反应,你能再举些利用化学反应中释放或吸收的热量为生产生活服务的例子吗?
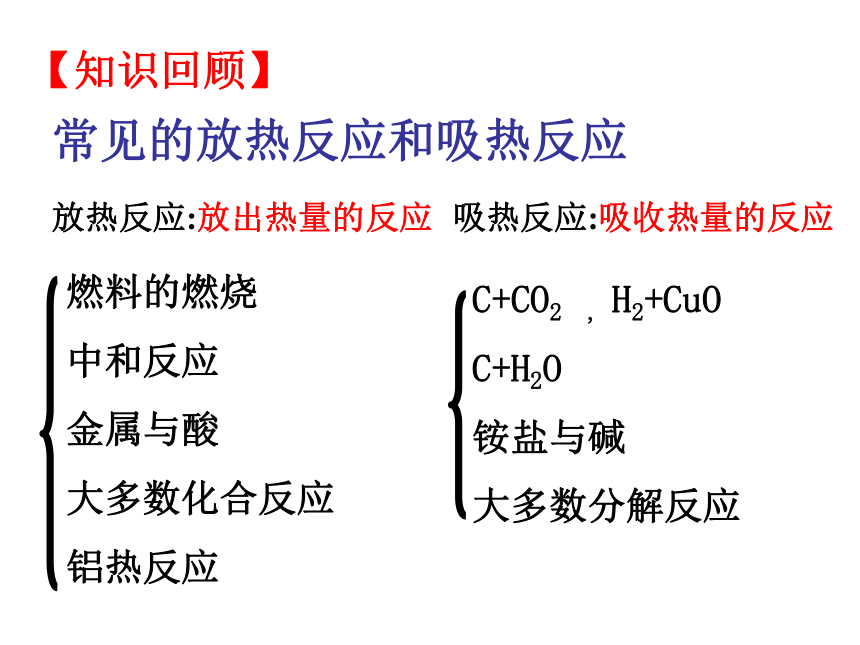
【知识回顾】
常见的放热反应和吸热反应
放热反应:放出热量的反应
吸热反应:吸收热量的反应
燃料的燃烧
中和反应
金属与酸
大多数化合反应
铝热反应
C+CO2
,
H2+CuO
C+H2O
铵盐与碱
大多数分解反应
【知识回顾】
2、符号:
ΔH
,单位:kJ/mol
或
kJ?mol-1
化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
一、反应热
焓变
1、定义:
放热反应:
ΔH<0
或
ΔH为“-”
ΔH>0
或
ΔH为“+”
吸热反应:
【想一想】反应热与焓变关系?
说明:由于化工生产以及科学实验中很多的反应都是在敞口的体系中进行的,压强恒定,所以现在我们通常所说的反应热就是焓变.
化学反应中为什么会有能量的变化?
1.宏观:
反应物和生成物所具有的能量不同。
【问题探究】
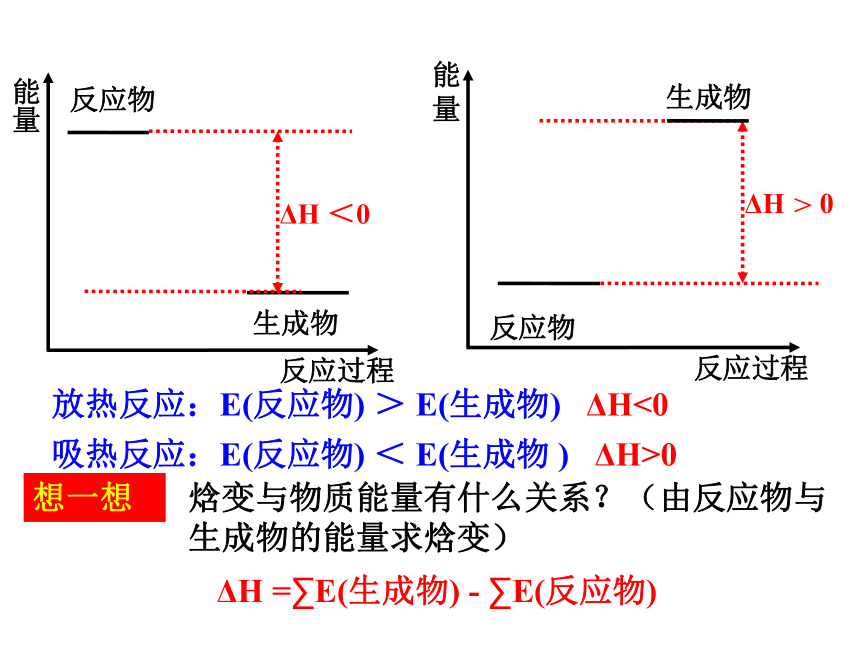
请画出放热、吸热反应过程中反应物与生成物的能量图.
放热反应:E(反应物)
>
E(生成物)
ΔH<0
吸热反应:E(反应物)
<
E(生成物
)
ΔH>0
ΔH
=∑E(生成物)
-
∑E(反应物)
化学反应中为什么会有能量的变化?
宏观:
反应物和生成物所具有的能量不同.
微观:
【问题探究】
【思考】
请以2H2+O2=2H2O的反应为例从微观角度分析一下化学反应发生的过程.
化学反应的本质是什么?
化学键的断裂和形成
旧键断裂需要
能量,
新键形成会
能量。
放
出
吸
收
【问题探究】
总能量的变化取决于上述两个过程能量变化的相对大小。
吸热:前者
后者
放热:前者
后者
﹤
﹥
N2(g)+O2(g)=2NO(g)反应的能量变化如图所示:
由图可知:
1
mol
N2分子中的化学键断裂吸收的能量是
;
1
mol
O2分子中的化学键断裂吸收的能量是
;
2
mol
NO分子中的化学键形成释放的能量是
;
则N2(g)+O2(g)=2NO(g)的反应吸收的热量为
。
【问题解决1】
946
kJ
180
kJ
1264
kJ
498kJ
已知:断裂1molH2(g)中的H—H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1molH—O键放出463kJ的能量。
请你判断2H2+O2=2H2O是放热还是吸热,并求出相应的反应热?
【问题解决2】
ΔH=-482KJ/mol
【归纳小结】化学键与反应热的关系
ΔH
=反应物总键能
–
生成物总键能
【概念辨析】
在加热条件下发生的反应一定是吸热反应,这个说法对吗?为什么?
1.下列说法正确的是( )
A.反应焓变是指1
mol物质参加反应时的能量变化
B.当反应放热时,ΔH
>0,反应吸热时,ΔH
<0
C.放热反应在常温下一定很容易发生
D.一个化学反应中,当反应物能量大于生成物能量时,反应放热,ΔH为“-”
D
【活学活用
】
2.反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0) ②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
D
3.已知H2(g)+1/2O2(g)=H2O(g),反应过程中能量变化如图所示,则:
(1)a、b、c分别代表什么意义?
a
;
b
;
c
。
(2)该反应是
反应(填“吸热”或“放热”),ΔH
0(填“>”或“<”)
旧化学键断裂吸收的能量
新化学键形成放出的能量
反应热
放热
>
二、热化学方程式:
1、概念:
可以表示反应热的化学方程式叫做热化学方程式。
【交流与讨论1】课本P2
1.为什么集聚状态不同(s、l、g、aq),热量值不同?
2.若反应物状态不同,而生成物状态相同,那么热量值相同吗?
3.为什么热化学方程式的化学计量数可以用分数表示?
【思考】
【交流与讨论2】课本P3
2、热化学方程式的书写方法及要求
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)在右端注明热量的变化:吸热反应,ΔH
0;放热反应,ΔH
0。(
△H的
“+”与“-”一定要注明,
△H的单位总是
).
(3)要注明反应物和生成物的
。
(4)化学计量数只表示
,因此可以是
,也可以是
。
(5)化学计量数改变,
要相应改变;逆反应的ΔH数值与正反应的数值相等、符号
。
﹥
﹥
﹤
KJ/mol
聚集状态
物质的量
整数
分数
ΔH
相反
1、N2
(g)与H2
(g)反应生成17gNH3
(g)
,放出46.1
kJ热量。
2、1molC2H5OH
(l)完全燃烧生成CO2
(g)
和H2O
(l)
,放出1366.
8
kJ热量。
3、标准状况下,44.8
LC2H2
(g)在O2
(g)中完全燃烧生成CO2
(g)和H2O
(l)
,放出2598.
8
kJ热量
4、24g
C(石墨)与适量H2O
(g)反应生成CO
(g)和H2
(g)
,吸收262.6
kJ热量。
【问题与解决1】课本P4
1.写出下列反应的热化学方程式:
(1)1.7
g
NH3(g)发生催化氧化反应生成气态产物,放出22.67
kJ的热量:___________________________________。
(2)沼气是一种能源,它的主要成分是CH4.0.5molCH4完全燃烧生成CO2和液态H2O时,放出445KJ热量:
.
【备用练习】
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)
ΔH=-906.8
kJ/mol
CH4(g)+2O2(g)
→CO2(g)+2H2O(l)
ΔH=-890
kJ/mol
④2H2(g)+O2(g)=2H2O(l)
△H=
d
kJ/mol
②2H2(g)+O2(g)=2H2O(g)
△H=
b
kJ/mol
下列关系中正确的是(
)
A、aB、b>d>0
C、2a=b<0
D、2c=d>0
C
【问题与解决2】书本P11
1.已知
2、在同温同压下,下列各组热化学方程式中Q2>Q1的是
(
)
A、H2(g)+Cl2(g)=2HCl(g)
△H=
-
Q1
1/2H2(g)+1/2Cl2(g)=HCl(g)
△H=
-
Q2
B、C(s)+1/2O2(g)=CO
(g)
△H=
-
Q1
C(s)+O2(g)=CO2
(g)
△H=
-
Q2
C、2H2(g)+O2(g)=2H2O(l)
△H=
-
Q1
2H2(g)+O2(g)=2H2O(g)
△H=
-
Q2
D、S(g)+O2(g)=SO2
(g)
△H=
-
Q1
S(s)+O2(g)=SO2
(g)
△H=
-
Q2
B
【问题与解决2】
1.CO(g)与H2O(g)反应过程的
能量变化如图所示,有关两者
反应的说法中正确的是( )
A.该反应为吸热反应
B.CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)所具有的总能量
C.反应的热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)
ΔH=+41
kJ·mol-1
D.1
mol
CO2(g)和1
mol
H2(g)反应生成1
mol
CO(g)和H2O(g)要放出41
kJ的热量
B
【达标检测
】
H2(g)+Cl2(g)=2HCl(g)
ΔH=-183
kJ/mol
2.已知几种化学键的键能:H-H:436KJ/mol
Cl-Cl:243KJ/mol
H-Cl:431KJ/mol
请写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式
。
【达标检测
】
3.已知H—H键键能(断裂时吸收或生成时释放的能量)为436
kJ·mol-1,H—N键键能为391
kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)
?
2NH3(g)
ΔH=-92.4kJ·mo-1。则N≡N键的键能是( )
A.431
kJ·mol-1
B.946
kJ·mol-1
C.649
kJ·mol-1
D.896
kJ·mol-1
B
【典型解悟
】
4.白磷的化学式为P4,分子的空间构型是正四面体(如图)。白磷在空气中燃烧生成十氧化四磷(P4O10),在十氧化四磷分子里只存在P—O和P=O两种共价键。
已知几种共价键的键能:P—O
360
kJ·mol-1;P=O
585
kJ·mol-1;P—P
198
kJ·mol-1;O=O
498
kJ·mol-1。
请问:在P4(s)+5O2(g)=P4O10(s
)中,ΔH=______________。
-2982KJ/mol
1.化学反应过程中既有物质变化,又有能量变化。
【课堂学习小结】
从键能角度看:ΔH
=反应物总键能
–
生成物总键能
从能量角度看:ΔH
=E(生成物)
-
E(反应物)
2.热化学方程式与普通化学方程式的区别
普通化学方程式
热化学方程式
化学计量数
是整数,既表示微粒个数又表示该物质的物质的量
可以是整数也可以是分数,只表示物质的物质的量
状态
不要求注明
必须在分子式后注明
ΔH正负号及单位
无
必须注明(正号常省略)
意义
表明了化学反应中的物质变化
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
遵循规律
原子守恒
原子守恒和能量守恒
专题1
化学反应与能量变化
第一单元
化学反应中的热效应
化学反应的焓变
【学习目标】
1.了解反应热和焓变的含义,知道放热反应和吸热反应的概念,理解化学反应过程中能量变化的原因并能利用键能计算反应的焓变。
2.知道热化学方程式的概念,能通过比较的方法理解热化学方程式与化学方程式的区别,能正确书写热化学方程式。
【猜一猜】
自热米饭最有可能采用下列哪种方式加热?
A.太阳能加热
B.生石灰和水反应加热
简易冰袋可以在野外短时期保存食物的原理?
【猜一猜】
原理:利用里面的物质发生化学反应从环境吸收热量.
我们知道所有的化学反应过程中既有物质变化,又有能量变化,且释放或吸收能量是化学反应中能量变化的主要形式之一。高一时我们已经学过很多化学反应,你能再举些利用化学反应中释放或吸收的热量为生产生活服务的例子吗?
【知识回顾】
常见的放热反应和吸热反应
放热反应:放出热量的反应
吸热反应:吸收热量的反应
燃料的燃烧
中和反应
金属与酸
大多数化合反应
铝热反应
C+CO2
,
H2+CuO
C+H2O
铵盐与碱
大多数分解反应
【知识回顾】
2、符号:
ΔH
,单位:kJ/mol
或
kJ?mol-1
化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为化学反应的反应热。
在恒温、恒压的条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
一、反应热
焓变
1、定义:
放热反应:
ΔH<0
或
ΔH为“-”
ΔH>0
或
ΔH为“+”
吸热反应:
【想一想】反应热与焓变关系?
说明:由于化工生产以及科学实验中很多的反应都是在敞口的体系中进行的,压强恒定,所以现在我们通常所说的反应热就是焓变.
化学反应中为什么会有能量的变化?
1.宏观:
反应物和生成物所具有的能量不同。
【问题探究】
请画出放热、吸热反应过程中反应物与生成物的能量图.
放热反应:E(反应物)
>
E(生成物)
ΔH<0
吸热反应:E(反应物)
<
E(生成物
)
ΔH>0
ΔH
=∑E(生成物)
-
∑E(反应物)
化学反应中为什么会有能量的变化?
宏观:
反应物和生成物所具有的能量不同.
微观:
【问题探究】
【思考】
请以2H2+O2=2H2O的反应为例从微观角度分析一下化学反应发生的过程.
化学反应的本质是什么?
化学键的断裂和形成
旧键断裂需要
能量,
新键形成会
能量。
放
出
吸
收
【问题探究】
总能量的变化取决于上述两个过程能量变化的相对大小。
吸热:前者
后者
放热:前者
后者
﹤
﹥
N2(g)+O2(g)=2NO(g)反应的能量变化如图所示:
由图可知:
1
mol
N2分子中的化学键断裂吸收的能量是
;
1
mol
O2分子中的化学键断裂吸收的能量是
;
2
mol
NO分子中的化学键形成释放的能量是
;
则N2(g)+O2(g)=2NO(g)的反应吸收的热量为
。
【问题解决1】
946
kJ
180
kJ
1264
kJ
498kJ
已知:断裂1molH2(g)中的H—H键需要吸收436kJ的能量,断裂1molO2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1molH—O键放出463kJ的能量。
请你判断2H2+O2=2H2O是放热还是吸热,并求出相应的反应热?
【问题解决2】
ΔH=-482KJ/mol
【归纳小结】化学键与反应热的关系
ΔH
=反应物总键能
–
生成物总键能
【概念辨析】
在加热条件下发生的反应一定是吸热反应,这个说法对吗?为什么?
1.下列说法正确的是( )
A.反应焓变是指1
mol物质参加反应时的能量变化
B.当反应放热时,ΔH
>0,反应吸热时,ΔH
<0
C.放热反应在常温下一定很容易发生
D.一个化学反应中,当反应物能量大于生成物能量时,反应放热,ΔH为“-”
D
【活学活用
】
2.反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0) ②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
D
3.已知H2(g)+1/2O2(g)=H2O(g),反应过程中能量变化如图所示,则:
(1)a、b、c分别代表什么意义?
a
;
b
;
c
。
(2)该反应是
反应(填“吸热”或“放热”),ΔH
0(填“>”或“<”)
旧化学键断裂吸收的能量
新化学键形成放出的能量
反应热
放热
>
二、热化学方程式:
1、概念:
可以表示反应热的化学方程式叫做热化学方程式。
【交流与讨论1】课本P2
1.为什么集聚状态不同(s、l、g、aq),热量值不同?
2.若反应物状态不同,而生成物状态相同,那么热量值相同吗?
3.为什么热化学方程式的化学计量数可以用分数表示?
【思考】
【交流与讨论2】课本P3
2、热化学方程式的书写方法及要求
(1)遵循一般化学方程式的书写规则(一般不写反应条件)。
(2)在右端注明热量的变化:吸热反应,ΔH
0;放热反应,ΔH
0。(
△H的
“+”与“-”一定要注明,
△H的单位总是
).
(3)要注明反应物和生成物的
。
(4)化学计量数只表示
,因此可以是
,也可以是
。
(5)化学计量数改变,
要相应改变;逆反应的ΔH数值与正反应的数值相等、符号
。
﹥
﹥
﹤
KJ/mol
聚集状态
物质的量
整数
分数
ΔH
相反
1、N2
(g)与H2
(g)反应生成17gNH3
(g)
,放出46.1
kJ热量。
2、1molC2H5OH
(l)完全燃烧生成CO2
(g)
和H2O
(l)
,放出1366.
8
kJ热量。
3、标准状况下,44.8
LC2H2
(g)在O2
(g)中完全燃烧生成CO2
(g)和H2O
(l)
,放出2598.
8
kJ热量
4、24g
C(石墨)与适量H2O
(g)反应生成CO
(g)和H2
(g)
,吸收262.6
kJ热量。
【问题与解决1】课本P4
1.写出下列反应的热化学方程式:
(1)1.7
g
NH3(g)发生催化氧化反应生成气态产物,放出22.67
kJ的热量:___________________________________。
(2)沼气是一种能源,它的主要成分是CH4.0.5molCH4完全燃烧生成CO2和液态H2O时,放出445KJ热量:
.
【备用练习】
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)
ΔH=-906.8
kJ/mol
CH4(g)+2O2(g)
→CO2(g)+2H2O(l)
ΔH=-890
kJ/mol
④2H2(g)+O2(g)=2H2O(l)
△H=
d
kJ/mol
②2H2(g)+O2(g)=2H2O(g)
△H=
b
kJ/mol
下列关系中正确的是(
)
A、a
C、2a=b<0
D、2c=d>0
C
【问题与解决2】书本P11
1.已知
2、在同温同压下,下列各组热化学方程式中Q2>Q1的是
(
)
A、H2(g)+Cl2(g)=2HCl(g)
△H=
-
Q1
1/2H2(g)+1/2Cl2(g)=HCl(g)
△H=
-
Q2
B、C(s)+1/2O2(g)=CO
(g)
△H=
-
Q1
C(s)+O2(g)=CO2
(g)
△H=
-
Q2
C、2H2(g)+O2(g)=2H2O(l)
△H=
-
Q1
2H2(g)+O2(g)=2H2O(g)
△H=
-
Q2
D、S(g)+O2(g)=SO2
(g)
△H=
-
Q1
S(s)+O2(g)=SO2
(g)
△H=
-
Q2
B
【问题与解决2】
1.CO(g)与H2O(g)反应过程的
能量变化如图所示,有关两者
反应的说法中正确的是( )
A.该反应为吸热反应
B.CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)所具有的总能量
C.反应的热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)
ΔH=+41
kJ·mol-1
D.1
mol
CO2(g)和1
mol
H2(g)反应生成1
mol
CO(g)和H2O(g)要放出41
kJ的热量
B
【达标检测
】
H2(g)+Cl2(g)=2HCl(g)
ΔH=-183
kJ/mol
2.已知几种化学键的键能:H-H:436KJ/mol
Cl-Cl:243KJ/mol
H-Cl:431KJ/mol
请写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式
。
【达标检测
】
3.已知H—H键键能(断裂时吸收或生成时释放的能量)为436
kJ·mol-1,H—N键键能为391
kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)
?
2NH3(g)
ΔH=-92.4kJ·mo-1。则N≡N键的键能是( )
A.431
kJ·mol-1
B.946
kJ·mol-1
C.649
kJ·mol-1
D.896
kJ·mol-1
B
【典型解悟
】
4.白磷的化学式为P4,分子的空间构型是正四面体(如图)。白磷在空气中燃烧生成十氧化四磷(P4O10),在十氧化四磷分子里只存在P—O和P=O两种共价键。
已知几种共价键的键能:P—O
360
kJ·mol-1;P=O
585
kJ·mol-1;P—P
198
kJ·mol-1;O=O
498
kJ·mol-1。
请问:在P4(s)+5O2(g)=P4O10(s
)中,ΔH=______________。
-2982KJ/mol
1.化学反应过程中既有物质变化,又有能量变化。
【课堂学习小结】
从键能角度看:ΔH
=反应物总键能
–
生成物总键能
从能量角度看:ΔH
=E(生成物)
-
E(反应物)
2.热化学方程式与普通化学方程式的区别
普通化学方程式
热化学方程式
化学计量数
是整数,既表示微粒个数又表示该物质的物质的量
可以是整数也可以是分数,只表示物质的物质的量
状态
不要求注明
必须在分子式后注明
ΔH正负号及单位
无
必须注明(正号常省略)
意义
表明了化学反应中的物质变化
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
遵循规律
原子守恒
原子守恒和能量守恒
