苏教版高二化学选修 化学反应原理专题3 第三单元盐 类 的 水 解(共22张PPT)
文档属性
| 名称 | 苏教版高二化学选修 化学反应原理专题3 第三单元盐 类 的 水 解(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-13 00:00:00 | ||
图片预览








文档简介
(共22张PPT)
专题3
溶液中的离子反应
3.3.1
盐类的水解反应
中性溶液:
c(H+)
=
c(OH-)
pH=7
酸性溶液:
碱性溶液:
c(H+)
>
c(OH-)
pH<7
c(H+)
<
c(OH-)
pH>7
溶液酸碱性:
知识回顾
活动与探究:盐溶液的酸碱性
1.取一小块试纸,放在点滴板上,用蘸有待测液的洁净干燥的玻璃棒点于试纸的中部,再与标准比色卡比较来确定溶液的pH,并把实验结果记录在课本表3-11中。
2.每次测量前应把玻璃棒洗净并用滤纸擦干。
3.实验时注意安全。
表3-11
部分盐的类型和溶液的酸碱性
=7
>7
<7
>7
<7
中性
碱性
酸性
酸性
碱性
实验结果:
盐溶液
NaCl
Na2CO3
NH4Cl
CH3COONa
AlCl3
pH(填大于、等于或小于7)
溶液的酸碱性
中性
碱性
酸性
酸性
碱性
表3-11
部分盐的类型和溶液的酸碱性
请根据形成该盐的酸和碱的强弱,将表中的盐分类。
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸弱碱盐
NaOH
+
HCl
=
NaCl
+
H2O
H2CO3
+
NaOH
=
Na2CO3
+
2H2O
NH3·H2O
+
HCl
=
NH4Cl
+
H2O
?
?
Cu(NO3)2、NaClO
、KBr
【即学即用】
小组讨论:请判断下列盐的类别
学法指导1:学会总结——
如果要正确判断盐的类别,你觉得最关键的是什么?
为什么盐的组成不同,溶液的酸碱性就不同呢?下面以CH3COONa、NH4Cl、NaCl为例展开分析讨论。
理论探究
学法指导2:自主学习——
阅读课本图3-17,解决下列问题
理论探究Ⅰ:
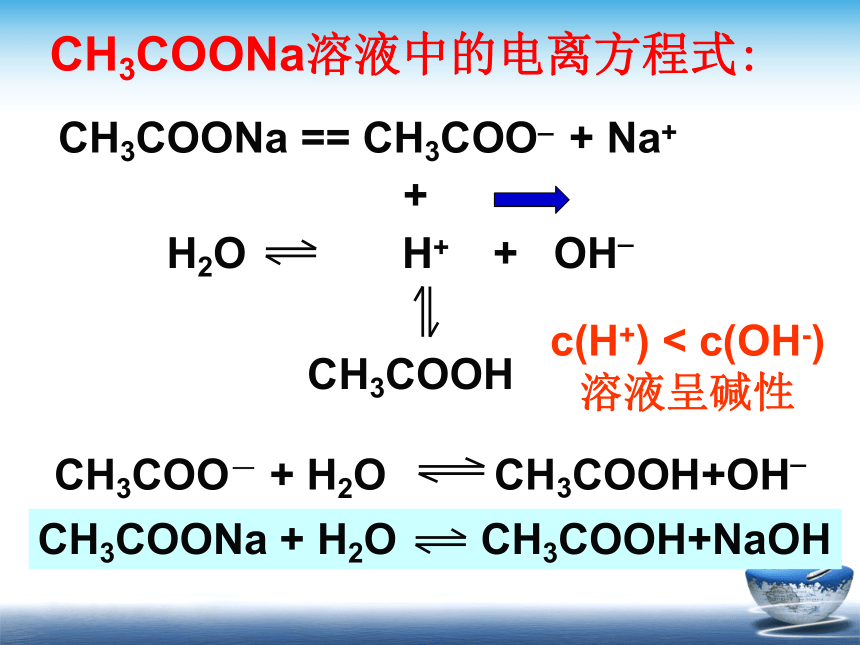
为什么CH3COONa溶液显碱性?
CH3COONa
==
CH3COO_
+
Na+
CH3COOH
CH3COONa溶液中的电离方程式:
+
c(H+)
<
c(OH-)
溶液呈碱性
由于CH3COO-
+
H+
CH3COOH(弱电解质)使水的电离向—————移动,导致——————————,使溶液呈————。
c(H+)
<
c(OH-)
碱性
正方向
理论探究Ⅰ:
结论:强碱弱酸盐水解显碱性。
学法指导3:学会类比——
借鉴CH3COONa的水溶液显碱性的原因分析方法,进行小组讨论
理论探究Ⅱ:
为什么NH4Cl溶液显酸性?
NH4Cl溶液中的电离方程式:
NH4Cl
==
NH4+
+
Cl-
+
NH3.H2O
c(H+)
>
c(OH-)
溶液呈酸性
由于
NH4+
+
OH-
NH3.
H2O(弱电解质)使水的电离向——————移动,导致———————————,使溶液呈————。
酸性
正方向
c(H+)
>
c(OH-)
类比
分析:
结论:强酸弱碱盐水解显酸性。
(谁强显谁性)
一、盐类的水解
溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
1.定义:
水解是中和反应的逆反应
盐+水 酸+碱
2.实质:
弱电解质的生成促进水的电离,使水的电离平衡向正方向移动。
思考:盐类水解过程对溶液中水的电离产生什么影响?
理论探究Ⅲ:
为什么NaCl
溶液显中性?
结论:强酸强碱盐水解显中性。
(都强显中性)
本节课你学到了什么?
1.
下列溶液pH小于7的是
A、
溴化钾
B、
硫酸铜
C、
硫化钠
D、
硝酸钡
2.
下列溶液能使酚酞指示剂显红色的是
A
、碳酸钾
B、
硫酸钠
C、
碳酸氢钠
D、
氯化铁
实战演练
4.在水中加入下列物质,可使水的电离平衡正向移动的是
A、NaCl
B、Na2CO3
C、NH4Cl
D、NaOH
3.下列离子在水溶液中不会发生水解的是
A
、
NH4+
B、
SO42_
C
、
Al3+
D
、
F_
4.
(2013年北京理综)氯化铵溶液中离子浓度从大到小排列正确的是
A
NH4+
、H
+
、OH-、Cl_
B
Cl
_
、
NH4+
、H
+
、OH
_
C
H
+、
Cl_
、
NH4+
、OH
_
D
Cl-、
NH4+
、
OH-
、H
+
直通高考
课后探究:家庭小实验
1.
用pH试纸测试家中食盐、味精、苏打、小苏打、肥皂等溶液的酸碱性。
2.农村俗语:“灰混粪,粪混灰,灰粪相混损肥分”你知道肥分损失的原因吗?探究草木灰的主要成分及其溶液的酸碱性。
谢谢!
专题3
溶液中的离子反应
3.3.1
盐类的水解反应
中性溶液:
c(H+)
=
c(OH-)
pH=7
酸性溶液:
碱性溶液:
c(H+)
>
c(OH-)
pH<7
c(H+)
<
c(OH-)
pH>7
溶液酸碱性:
知识回顾
活动与探究:盐溶液的酸碱性
1.取一小块试纸,放在点滴板上,用蘸有待测液的洁净干燥的玻璃棒点于试纸的中部,再与标准比色卡比较来确定溶液的pH,并把实验结果记录在课本表3-11中。
2.每次测量前应把玻璃棒洗净并用滤纸擦干。
3.实验时注意安全。
表3-11
部分盐的类型和溶液的酸碱性
=7
>7
<7
>7
<7
中性
碱性
酸性
酸性
碱性
实验结果:
盐溶液
NaCl
Na2CO3
NH4Cl
CH3COONa
AlCl3
pH(填大于、等于或小于7)
溶液的酸碱性
中性
碱性
酸性
酸性
碱性
表3-11
部分盐的类型和溶液的酸碱性
请根据形成该盐的酸和碱的强弱,将表中的盐分类。
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
强酸弱碱盐
NaOH
+
HCl
=
NaCl
+
H2O
H2CO3
+
NaOH
=
Na2CO3
+
2H2O
NH3·H2O
+
HCl
=
NH4Cl
+
H2O
?
?
Cu(NO3)2、NaClO
、KBr
【即学即用】
小组讨论:请判断下列盐的类别
学法指导1:学会总结——
如果要正确判断盐的类别,你觉得最关键的是什么?
为什么盐的组成不同,溶液的酸碱性就不同呢?下面以CH3COONa、NH4Cl、NaCl为例展开分析讨论。
理论探究
学法指导2:自主学习——
阅读课本图3-17,解决下列问题
理论探究Ⅰ:
为什么CH3COONa溶液显碱性?
CH3COONa
==
CH3COO_
+
Na+
CH3COOH
CH3COONa溶液中的电离方程式:
+
c(H+)
<
c(OH-)
溶液呈碱性
由于CH3COO-
+
H+
CH3COOH(弱电解质)使水的电离向—————移动,导致——————————,使溶液呈————。
c(H+)
<
c(OH-)
碱性
正方向
理论探究Ⅰ:
结论:强碱弱酸盐水解显碱性。
学法指导3:学会类比——
借鉴CH3COONa的水溶液显碱性的原因分析方法,进行小组讨论
理论探究Ⅱ:
为什么NH4Cl溶液显酸性?
NH4Cl溶液中的电离方程式:
NH4Cl
==
NH4+
+
Cl-
+
NH3.H2O
c(H+)
>
c(OH-)
溶液呈酸性
由于
NH4+
+
OH-
NH3.
H2O(弱电解质)使水的电离向——————移动,导致———————————,使溶液呈————。
酸性
正方向
c(H+)
>
c(OH-)
类比
分析:
结论:强酸弱碱盐水解显酸性。
(谁强显谁性)
一、盐类的水解
溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
1.定义:
水解是中和反应的逆反应
盐+水 酸+碱
2.实质:
弱电解质的生成促进水的电离,使水的电离平衡向正方向移动。
思考:盐类水解过程对溶液中水的电离产生什么影响?
理论探究Ⅲ:
为什么NaCl
溶液显中性?
结论:强酸强碱盐水解显中性。
(都强显中性)
本节课你学到了什么?
1.
下列溶液pH小于7的是
A、
溴化钾
B、
硫酸铜
C、
硫化钠
D、
硝酸钡
2.
下列溶液能使酚酞指示剂显红色的是
A
、碳酸钾
B、
硫酸钠
C、
碳酸氢钠
D、
氯化铁
实战演练
4.在水中加入下列物质,可使水的电离平衡正向移动的是
A、NaCl
B、Na2CO3
C、NH4Cl
D、NaOH
3.下列离子在水溶液中不会发生水解的是
A
、
NH4+
B、
SO42_
C
、
Al3+
D
、
F_
4.
(2013年北京理综)氯化铵溶液中离子浓度从大到小排列正确的是
A
NH4+
、H
+
、OH-、Cl_
B
Cl
_
、
NH4+
、H
+
、OH
_
C
H
+、
Cl_
、
NH4+
、OH
_
D
Cl-、
NH4+
、
OH-
、H
+
直通高考
课后探究:家庭小实验
1.
用pH试纸测试家中食盐、味精、苏打、小苏打、肥皂等溶液的酸碱性。
2.农村俗语:“灰混粪,粪混灰,灰粪相混损肥分”你知道肥分损失的原因吗?探究草木灰的主要成分及其溶液的酸碱性。
谢谢!
