苏教化学选修 化学反应原理专题2第一单元 化学反应速率(共49张PPT)
文档属性
| 名称 | 苏教化学选修 化学反应原理专题2第一单元 化学反应速率(共49张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-14 11:47:07 | ||
图片预览











文档简介
(共49张PPT)
专题2
化学反应速率与化学平衡
第一单元
化学反应速率
探究影响化学反应速率的因素
探究一:影响化学反应速率的主要因素是什么?
初三化学《金属和金属材料》
分别将等质量的固体Mg、Zn、Fe
、Cu和
3ml
3mol/L
HCl溶液反应,观察固体表面气泡产生的快慢。
结论一:决定化学反应速率的主要原因是反应物本身的性质。
某同学甲通过实验
①将5g
铁钉和
3ml
3mol/L
HCl溶液反应
②将5g
镁条和
3ml
6mol/L
HCl溶液反应
根据②反应现象更剧烈,得出结论:反应速率与浓度成正比。
你认为正确吗?
否,首先反应物本身的性质不同,其次反应物的浓度不同,
从而导致反应速率不同。
控制变量法:即控制其他因素不变,只改变其中
某一变量,观察该变量对实验结果的影响。
某学习小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究
“外界条件对化学反应速率的影响”。实验时,先分别量取
两种溶液,然后倒入试管中迅速振荡混合均匀,通过观察溶液褪色所需时间来判断反应的快慢。
已知:H2C2O4和酸性KMnO4反应的产物有MnSO4
、K2SO4、CO2、H2O,
写出反应的化学方程式。
探究二:反应物的浓度对化学反应速率的影响
2KMnO4
+
5H2C2O4
+
3H2SO4
=
2MnSO4
+
K2SO4
+
10CO2↑+
8H2O
离子方程式:2MnO4-
+
5H2C2O4
+
6H+
=
2Mn2+
+
10CO2↑+
8H2O
进行实验
编号
酸性KMnO4溶液
H2C2O4溶液
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
①
0.010
2.0
0.10
2.0
室温
②
0.010
2.0
0.20
2.0
室温
结论二:其他条件相同时,增大反应物的浓度,反应
速率增大,反之,减小反应物的浓度,反应速率减小。
问题1:其他条件相同时,增大反应物的浓度,反应速率增大。某同学乙用Fe和稀硫酸制取氢气时,改用98%浓硫酸加快产生氢气的速率,这种做法可取吗?
不可取,常温下浓硫酸使Fe钝化,表面形成致密的氧化膜,
不产生H2。
现象:草酸浓度大的混合液褪色较快。
问题2:H2SO4作为反应物之一,增大H+浓度可以提高化学反应速率;为了验证该结论,某同学丙往反应混合液中滴加几滴浓盐酸,发现溶液褪色更快,你同意他的观点吗?
不同意。滴加盐酸后,溶液中发生了以下反应
2MnO4-
+
10Cl-
+
16H+
=
2Mn2+
+
5Cl2↑+
8H2O,从而加快其褪色。
Mg
探究三:温度对化学反应速率的影响
2KMnO4
+
5H2C2O4
+
3H2SO4
=
2MnSO4
+
K2SO4
+
10CO2↑+
8H2O
离子方程式:2MnO4-
+
5H2C2O4
+
6H+
=
2Mn2+
+
10CO2↑+
8H2O
进行实验
编号
酸性KMnO4溶液
H2C2O4溶液
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
①
0.010
2.0
0.10
2.0
室温
②
0.010
2.0
0.10
2.0
冰水
③
0.010
2.0
0.10
2.0
热水
结论三:其他条件相同时,升高温度,化学反应速率
增大,降低温度,化学反应速率减小。
现象:热水浴中的溶液迅速褪色,冷水浴中的溶液无明显变化。
问题3:《化学反应原理》课后习题:P41
5.(1)除去氧化膜的镁条放入稀盐酸试管中,产生
H2的速率随时间变化关系如图,解释其变化的原因。
答:反应开始时,温度升高的影响超过了盐酸浓度下降的影响,
反应速率逐渐增大;后来,盐酸浓度下降的影响起主要作用,
反应速率逐渐减小。
学以致用
在H2C2O4溶液和酸性KMnO4溶液反应的实验中,发现刚开始
一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快,针对上述实验现象,丁同学认为酸性高锰酸钾与草酸溶液反应产生的某种物质加快了反应,你是否认同他的观点?能否设计实验证明哪种产物的作用?
猜想1:产物K2SO4的作用;
猜想2:产物MnSO4的作用;
猜想3:产物CO2的作用;
猜想与假设
探究四:反应产物对化学反应速率的影响
进行实验
编号
酸性KMnO4溶液
H2C2O4溶液
加入产物
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
少量粉末
或气体
①
0.010
2.0
0.10
2.0
室温
不加
②
0.010
2.0
0.10
2.0
室温
K2SO4
③
0.010
2.0
0.10
2.0
室温
MnSO4
④
0.010
2.0
0.10
2.0
室温
通CO2
结论四:其他条件相同时,产物中的某种物质对反应
有催化作用,从而加快了化学反应速率。
现象:②和④无明显变化;③迅速褪色。
问题:可否将上述MnSO4用MnCl2代替?
否,引入Cl-,
Cl-与酸性KMnO4会反应,干扰实验
探究五:催化剂对化学反应速率的影响
在5ml
5%
的H2O2中分别加入少量MnO2和2-3滴FeCl3
,比较二者分解速率
进行实验
编号
H2O2
催化剂
浓度/mol·L-1
体积/mL
①
5%
5.0
不加
②
5%
5.0
少量MnO2粉末
③
5%
5.0
2-3滴
FeCl3溶液
现象:②加入MnO2迅速产生大量气泡,
③滴加FeCl3溶液,缓慢产生气泡
结论五:其他条件相同时,加入催化剂,化学反应速率增大。催化剂是改变化学反应速率最有效的手段之一。
同一反应,不同的催化剂催化效果不同。
你知道吗?
月饼,糕点等往往在包装盒内装入小包脱氧保鲜剂,这样做
有什么用?
你知道吗?
衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶的洗衣粉,则较容易就能洗去。为什么?
影响化学反应速率的因素
2CO+2NO
N2+2CO2
催化剂
汽车尾气净化装置
本节课主要通过控制变量法探究影响化学反应速率的主要因素及外界条件浓度、温度、产物、催化剂对反应速率的影响。下面归纳下控制变量法探究实验的思路。
一、明确:探究问题
二、寻找:影响因素
三、控制:其他因素
四、改变:研究因素
六、固体反应物的接触面积对化学反应速率的影响
碳酸钙与稀盐酸的反应
编号
试管1
试管2
加入
试剂
2g块状CaCO3+
5ml
1mol/L稀盐酸
2g粉末状CaCO3+
5ml
1mol/L稀盐酸
结论六:其他条件相同时,增大固体反应物的接触
面积,反应速率加快,减小固体反应物的接触面积,反应速率减小。
现象:块状的缓慢产生气泡,粉末状的迅速产生气泡
七、压强对反应速率的影响
对反应物有气体参加的反应,压强对反应的影响本质上是浓度的影响。(压强的改变对固体或液体的浓度影响忽略不计。)
压强增大
气体的体积缩小
浓度增大
化学反应速率增大
SO2(g)
+
2H2S(g)
3S(s)
+
2H2O(l)
P1结论七:其他条件相同时,对于反应物有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体体积缩小,反应物的浓度增大,反应速率增大;减小压强,气体体积
增大,反应物浓度减小,反应速率减小。
P37
若反应物为固体、液体,或反应在溶液中进行时,由于改变压强对它们的体积影响很小,可以忽略。
其他影响因素:如光照、电磁波、超声波、
溶剂的性质等也会对化学反应的速率产生影响。
如何利用化学原理解释以上实验
规律呢?(微观分析)
用碰撞理论可以简单解释浓度、压强、温度对反应速率
的影响;什么是碰撞理论?
碰撞理论是一种较直观的反应速率理论。该理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间的碰撞次数成正比。
【交流与讨论】
①什么是有效碰撞?
③怎样的分子称为活化分子?
碰撞理论
②有效碰撞的条件是什么?
能发生化学反应的碰撞称为有效碰撞
1、发生碰撞的分子具有足够高的能量
2、分子在一定方向上发生碰撞
能量较高、有可能发生有效碰撞的分子。
⑤什么是活化能?
常态下,活化分子的平均能量与所有分子的平均能量之差。
④什么是活化分子百分数?
(活化分子数/反应物总分子数)×100%
没足够的能量
足够的能量
合适的取向
借鉴投篮——获得灵感
没合适的取向
浓度对反应速率的影响
增加
增加
增加
加快
影响
外因
单位体积内
有效碰撞
次数
化学反应速率
分子总数
活化分子数
增大浓度
压强对反应速率的影响
增加
增加
增加
加快
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
增大压强
N2
H2
Ar
讨论1:取一个恒温,容积固定的密闭容器,充入Ar后,对速率如何影响?
总气压增大,但体积不变
N2、H2浓度不变
速率不变
N2
H2
N2
讨论2:取一个恒温、容积固定的密闭容器,充入N2后,对速率如何影响?
总气压增大,但体积不变
H2浓度不变,但N2的浓度增大
速率增大
N2
H2
Ar
讨论3:向恒压,容积可变的容器中充入惰性Ar气体,
分析速率变化情况。
总气压不变,但体积增大
N2、H2浓度减小
速率减小
恒温、
恒容
(V不变)
充入惰性气体,体积不变,反应物浓度不变
充入反应物,体积不变,反应物浓度增大
速率v不变
恒温、
恒压
(P不变)
充入惰性气体,体积增大,反应物浓度减小
速率v减小
小结
速率v增大
温度对反应速率的影响
不变
增加
加快
增加
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
升高温度
过渡态理论(非碰撞理论)
无催化剂过渡态
Ea2
Ea1
有催化剂过渡态
催化剂对反应速率的影响能否用碰撞理论解释呢?
否
催化剂改变了化学反应的路径,从而改变到达另外一个过渡态的活化能,
且这个活化能比原先的小。
过渡态理论
不变
增加
加快
增加
过渡态理论
催化剂对反应速率的影响
影响
外因
单位体积内
有效碰撞
次数
化学反应
速率
分子总数
活化分子数
正催化剂
小结:影响化学反应速率的因素的微观分析
不变
不变
增加
加快
增加
增加
影响
外因
单位体积内
有效碰撞
次数
化学反应
速率
分子总数
活化分子数
活化分子百分数
增大反应物浓度
增大压强(恒容,充入反应物气体)
升高温度
正催化剂
例:密闭容器中通入1molH2和1molI2(气体),压强为P(Pa)在一定温度下使其发生以下反应:
H2(g)
+
I2(g)=
2HI(g)
①体积不变,加入1molH2,速率
。
②体积不变,加入1molN2,速率
。
③压强不变,加入1molN2,速率
。
④压强不变,加入1molH2
、1molI2速率
。
⑤升高温度,速率
。
增大
增大
减小
不变
不变
【练习与实践】
1.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先
出现浑浊的是( )
D
随堂训练
实验
反应温度/°C
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
(1)实验①测得KMnO4溶液的褪色时间为40
s,忽略混合前后溶液体积
的微小变化,这段时间内平均反应速率v(KMnO4)=_____mol·L-1·min-1。
2.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究
“外界条件对化学反应速率的影响”的实验。
0.0075
编号
酸性KMnO4溶液
H2C2O4溶液
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
①
0.010
2.0
0.10
2.0
25
②
0.010
2.0
0.20
2.0
25
(2)已知50
℃时c(MnO4-
)~反应时间t的变化曲线如图。若保持其他条件
不变,请在坐标图中,画出25
℃时c(MnO4-
)~t的变化曲线示意图。
3.H2O2+2H++2I—→2H2O+I2生成的I2立即与试剂X反应,
当试剂X刚好反应完后,
生成的I2遇淀粉变蓝指示终点。
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2
反应速率的影响。实验2中m=
,n=
。
20
20
编号
往烧杯中加入的试剂及其用量(mL)
催化剂
溶液开始变蓝时间(min)
KI溶液
H2O
0.01
mol·L-1
X
溶液
0.1
mol·L-1
双氧水
1
mol·L-1
稀盐酸
1
20.0
10.0
10.0
20.0
20.0
无
1.4
2
20.0
m
10.0
10.0
n
无
2.8
3
10.0
20.0
10.0
20.0
20.0
无
2.8
4
20.0
0
10.0
10.0
40.0
无
t
5
20.0
10.0
10.0
20.0
20.0
5滴Fe2(SO4)3
0.6
随堂训练:P41
5(2)过氧化氢在酶的催化作用下的分解反应速率随温度的变化关系,解释其变化的原因。
酶的催化作用有一定的温度范围,温度过高或过低都会降低酶的催化效率
1.如图表示容积固定的2L密闭容器中进行的某可逆反应:A(g)+2B(g)?2C?(g)
以B的物质的量浓度改变表示的反应速率与时间的关系,已知v的单位是mol/(L.s),
则图中阴影部分的面积可表示(
)
A.A的物质的量浓度的减少
B.B的物质的量浓度的减少
C.B的物质的量浓度的增加
D.B的物质的量的减少
B
2.对于可逆反应m?A(g)+n?B(g)?pC(g)+g?D(g),若其它条件都
不变,只是在反应前是否加入催化剂,可得到两种v-
t图象如图:
如下关系正确的为( )
①a1=a2?
②a1<a2?
③b1=b2?
④b1<b2?
⑤t1>t2?
⑥t1=t2?
⑦两图中阴影部分面积相等???⑧右图阴影部分面积更大.
A.②④⑤⑦
B.②④⑥⑧
C.②③⑤⑦
D.②③⑥⑧
A
专题2
化学反应速率与化学平衡
第一单元
化学反应速率
探究影响化学反应速率的因素
探究一:影响化学反应速率的主要因素是什么?
初三化学《金属和金属材料》
分别将等质量的固体Mg、Zn、Fe
、Cu和
3ml
3mol/L
HCl溶液反应,观察固体表面气泡产生的快慢。
结论一:决定化学反应速率的主要原因是反应物本身的性质。
某同学甲通过实验
①将5g
铁钉和
3ml
3mol/L
HCl溶液反应
②将5g
镁条和
3ml
6mol/L
HCl溶液反应
根据②反应现象更剧烈,得出结论:反应速率与浓度成正比。
你认为正确吗?
否,首先反应物本身的性质不同,其次反应物的浓度不同,
从而导致反应速率不同。
控制变量法:即控制其他因素不变,只改变其中
某一变量,观察该变量对实验结果的影响。
某学习小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究
“外界条件对化学反应速率的影响”。实验时,先分别量取
两种溶液,然后倒入试管中迅速振荡混合均匀,通过观察溶液褪色所需时间来判断反应的快慢。
已知:H2C2O4和酸性KMnO4反应的产物有MnSO4
、K2SO4、CO2、H2O,
写出反应的化学方程式。
探究二:反应物的浓度对化学反应速率的影响
2KMnO4
+
5H2C2O4
+
3H2SO4
=
2MnSO4
+
K2SO4
+
10CO2↑+
8H2O
离子方程式:2MnO4-
+
5H2C2O4
+
6H+
=
2Mn2+
+
10CO2↑+
8H2O
进行实验
编号
酸性KMnO4溶液
H2C2O4溶液
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
①
0.010
2.0
0.10
2.0
室温
②
0.010
2.0
0.20
2.0
室温
结论二:其他条件相同时,增大反应物的浓度,反应
速率增大,反之,减小反应物的浓度,反应速率减小。
问题1:其他条件相同时,增大反应物的浓度,反应速率增大。某同学乙用Fe和稀硫酸制取氢气时,改用98%浓硫酸加快产生氢气的速率,这种做法可取吗?
不可取,常温下浓硫酸使Fe钝化,表面形成致密的氧化膜,
不产生H2。
现象:草酸浓度大的混合液褪色较快。
问题2:H2SO4作为反应物之一,增大H+浓度可以提高化学反应速率;为了验证该结论,某同学丙往反应混合液中滴加几滴浓盐酸,发现溶液褪色更快,你同意他的观点吗?
不同意。滴加盐酸后,溶液中发生了以下反应
2MnO4-
+
10Cl-
+
16H+
=
2Mn2+
+
5Cl2↑+
8H2O,从而加快其褪色。
Mg
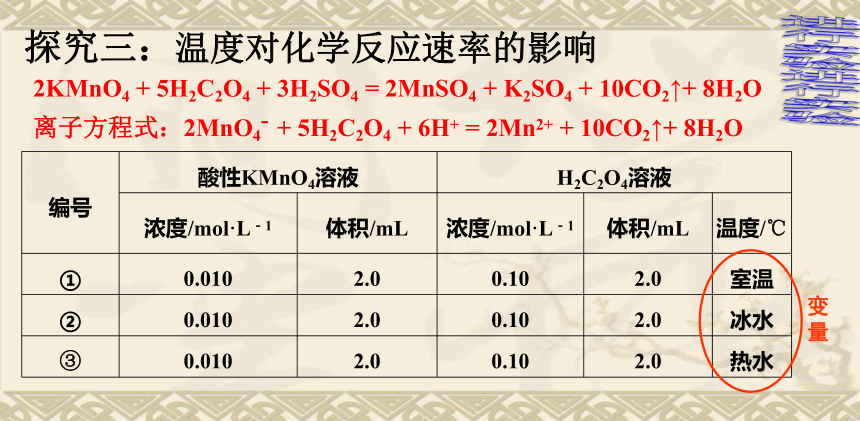
探究三:温度对化学反应速率的影响
2KMnO4
+
5H2C2O4
+
3H2SO4
=
2MnSO4
+
K2SO4
+
10CO2↑+
8H2O
离子方程式:2MnO4-
+
5H2C2O4
+
6H+
=
2Mn2+
+
10CO2↑+
8H2O
进行实验
编号
酸性KMnO4溶液
H2C2O4溶液
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
①
0.010
2.0
0.10
2.0
室温
②
0.010
2.0
0.10
2.0
冰水
③
0.010
2.0
0.10
2.0
热水
结论三:其他条件相同时,升高温度,化学反应速率
增大,降低温度,化学反应速率减小。
现象:热水浴中的溶液迅速褪色,冷水浴中的溶液无明显变化。
问题3:《化学反应原理》课后习题:P41
5.(1)除去氧化膜的镁条放入稀盐酸试管中,产生
H2的速率随时间变化关系如图,解释其变化的原因。
答:反应开始时,温度升高的影响超过了盐酸浓度下降的影响,
反应速率逐渐增大;后来,盐酸浓度下降的影响起主要作用,
反应速率逐渐减小。
学以致用
在H2C2O4溶液和酸性KMnO4溶液反应的实验中,发现刚开始
一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快,针对上述实验现象,丁同学认为酸性高锰酸钾与草酸溶液反应产生的某种物质加快了反应,你是否认同他的观点?能否设计实验证明哪种产物的作用?
猜想1:产物K2SO4的作用;
猜想2:产物MnSO4的作用;
猜想3:产物CO2的作用;
猜想与假设
探究四:反应产物对化学反应速率的影响
进行实验
编号
酸性KMnO4溶液
H2C2O4溶液
加入产物
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
少量粉末
或气体
①
0.010
2.0
0.10
2.0
室温
不加
②
0.010
2.0
0.10
2.0
室温
K2SO4
③
0.010
2.0
0.10
2.0
室温
MnSO4
④
0.010
2.0
0.10
2.0
室温
通CO2
结论四:其他条件相同时,产物中的某种物质对反应
有催化作用,从而加快了化学反应速率。
现象:②和④无明显变化;③迅速褪色。
问题:可否将上述MnSO4用MnCl2代替?
否,引入Cl-,
Cl-与酸性KMnO4会反应,干扰实验
探究五:催化剂对化学反应速率的影响
在5ml
5%
的H2O2中分别加入少量MnO2和2-3滴FeCl3
,比较二者分解速率
进行实验
编号
H2O2
催化剂
浓度/mol·L-1
体积/mL
①
5%
5.0
不加
②
5%
5.0
少量MnO2粉末
③
5%
5.0
2-3滴
FeCl3溶液
现象:②加入MnO2迅速产生大量气泡,
③滴加FeCl3溶液,缓慢产生气泡
结论五:其他条件相同时,加入催化剂,化学反应速率增大。催化剂是改变化学反应速率最有效的手段之一。
同一反应,不同的催化剂催化效果不同。
你知道吗?
月饼,糕点等往往在包装盒内装入小包脱氧保鲜剂,这样做
有什么用?
你知道吗?
衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶的洗衣粉,则较容易就能洗去。为什么?
影响化学反应速率的因素
2CO+2NO
N2+2CO2
催化剂
汽车尾气净化装置
本节课主要通过控制变量法探究影响化学反应速率的主要因素及外界条件浓度、温度、产物、催化剂对反应速率的影响。下面归纳下控制变量法探究实验的思路。
一、明确:探究问题
二、寻找:影响因素
三、控制:其他因素
四、改变:研究因素
六、固体反应物的接触面积对化学反应速率的影响
碳酸钙与稀盐酸的反应
编号
试管1
试管2
加入
试剂
2g块状CaCO3+
5ml
1mol/L稀盐酸
2g粉末状CaCO3+
5ml
1mol/L稀盐酸
结论六:其他条件相同时,增大固体反应物的接触
面积,反应速率加快,减小固体反应物的接触面积,反应速率减小。
现象:块状的缓慢产生气泡,粉末状的迅速产生气泡
七、压强对反应速率的影响
对反应物有气体参加的反应,压强对反应的影响本质上是浓度的影响。(压强的改变对固体或液体的浓度影响忽略不计。)
压强增大
气体的体积缩小
浓度增大
化学反应速率增大
SO2(g)
+
2H2S(g)
3S(s)
+
2H2O(l)
P1
增大,反应物浓度减小,反应速率减小。
P37
若反应物为固体、液体,或反应在溶液中进行时,由于改变压强对它们的体积影响很小,可以忽略。
其他影响因素:如光照、电磁波、超声波、
溶剂的性质等也会对化学反应的速率产生影响。
如何利用化学原理解释以上实验
规律呢?(微观分析)
用碰撞理论可以简单解释浓度、压强、温度对反应速率
的影响;什么是碰撞理论?
碰撞理论是一种较直观的反应速率理论。该理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间的碰撞次数成正比。
【交流与讨论】
①什么是有效碰撞?
③怎样的分子称为活化分子?
碰撞理论
②有效碰撞的条件是什么?
能发生化学反应的碰撞称为有效碰撞
1、发生碰撞的分子具有足够高的能量
2、分子在一定方向上发生碰撞
能量较高、有可能发生有效碰撞的分子。
⑤什么是活化能?
常态下,活化分子的平均能量与所有分子的平均能量之差。
④什么是活化分子百分数?
(活化分子数/反应物总分子数)×100%
没足够的能量
足够的能量
合适的取向
借鉴投篮——获得灵感
没合适的取向
浓度对反应速率的影响
增加
增加
增加
加快
影响
外因
单位体积内
有效碰撞
次数
化学反应速率
分子总数
活化分子数
增大浓度
压强对反应速率的影响
增加
增加
增加
加快
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
增大压强
N2
H2
Ar
讨论1:取一个恒温,容积固定的密闭容器,充入Ar后,对速率如何影响?
总气压增大,但体积不变
N2、H2浓度不变
速率不变
N2
H2
N2
讨论2:取一个恒温、容积固定的密闭容器,充入N2后,对速率如何影响?
总气压增大,但体积不变
H2浓度不变,但N2的浓度增大
速率增大
N2
H2
Ar
讨论3:向恒压,容积可变的容器中充入惰性Ar气体,
分析速率变化情况。
总气压不变,但体积增大
N2、H2浓度减小
速率减小
恒温、
恒容
(V不变)
充入惰性气体,体积不变,反应物浓度不变
充入反应物,体积不变,反应物浓度增大
速率v不变
恒温、
恒压
(P不变)
充入惰性气体,体积增大,反应物浓度减小
速率v减小
小结
速率v增大
温度对反应速率的影响
不变
增加
加快
增加
影响
外因
单位体积内
有效碰撞次数
化学反应速率
分子总数
活化分子数
升高温度
过渡态理论(非碰撞理论)
无催化剂过渡态
Ea2
Ea1
有催化剂过渡态
催化剂对反应速率的影响能否用碰撞理论解释呢?
否
催化剂改变了化学反应的路径,从而改变到达另外一个过渡态的活化能,
且这个活化能比原先的小。
过渡态理论
不变
增加
加快
增加
过渡态理论
催化剂对反应速率的影响
影响
外因
单位体积内
有效碰撞
次数
化学反应
速率
分子总数
活化分子数
正催化剂
小结:影响化学反应速率的因素的微观分析
不变
不变
增加
加快
增加
增加
影响
外因
单位体积内
有效碰撞
次数
化学反应
速率
分子总数
活化分子数
活化分子百分数
增大反应物浓度
增大压强(恒容,充入反应物气体)
升高温度
正催化剂
例:密闭容器中通入1molH2和1molI2(气体),压强为P(Pa)在一定温度下使其发生以下反应:
H2(g)
+
I2(g)=
2HI(g)
①体积不变,加入1molH2,速率
。
②体积不变,加入1molN2,速率
。
③压强不变,加入1molN2,速率
。
④压强不变,加入1molH2
、1molI2速率
。
⑤升高温度,速率
。
增大
增大
减小
不变
不变
【练习与实践】
1.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先
出现浑浊的是( )
D
随堂训练
实验
反应温度/°C
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
(1)实验①测得KMnO4溶液的褪色时间为40
s,忽略混合前后溶液体积
的微小变化,这段时间内平均反应速率v(KMnO4)=_____mol·L-1·min-1。
2.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究
“外界条件对化学反应速率的影响”的实验。
0.0075
编号
酸性KMnO4溶液
H2C2O4溶液
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
温度/℃
①
0.010
2.0
0.10
2.0
25
②
0.010
2.0
0.20
2.0
25
(2)已知50
℃时c(MnO4-
)~反应时间t的变化曲线如图。若保持其他条件
不变,请在坐标图中,画出25
℃时c(MnO4-
)~t的变化曲线示意图。
3.H2O2+2H++2I—→2H2O+I2生成的I2立即与试剂X反应,
当试剂X刚好反应完后,
生成的I2遇淀粉变蓝指示终点。
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2
反应速率的影响。实验2中m=
,n=
。
20
20
编号
往烧杯中加入的试剂及其用量(mL)
催化剂
溶液开始变蓝时间(min)
KI溶液
H2O
0.01
mol·L-1
X
溶液
0.1
mol·L-1
双氧水
1
mol·L-1
稀盐酸
1
20.0
10.0
10.0
20.0
20.0
无
1.4
2
20.0
m
10.0
10.0
n
无
2.8
3
10.0
20.0
10.0
20.0
20.0
无
2.8
4
20.0
0
10.0
10.0
40.0
无
t
5
20.0
10.0
10.0
20.0
20.0
5滴Fe2(SO4)3
0.6
随堂训练:P41
5(2)过氧化氢在酶的催化作用下的分解反应速率随温度的变化关系,解释其变化的原因。
酶的催化作用有一定的温度范围,温度过高或过低都会降低酶的催化效率
1.如图表示容积固定的2L密闭容器中进行的某可逆反应:A(g)+2B(g)?2C?(g)
以B的物质的量浓度改变表示的反应速率与时间的关系,已知v的单位是mol/(L.s),
则图中阴影部分的面积可表示(
)
A.A的物质的量浓度的减少
B.B的物质的量浓度的减少
C.B的物质的量浓度的增加
D.B的物质的量的减少
B
2.对于可逆反应m?A(g)+n?B(g)?pC(g)+g?D(g),若其它条件都
不变,只是在反应前是否加入催化剂,可得到两种v-
t图象如图:
如下关系正确的为( )
①a1=a2?
②a1<a2?
③b1=b2?
④b1<b2?
⑤t1>t2?
⑥t1=t2?
⑦两图中阴影部分面积相等???⑧右图阴影部分面积更大.
A.②④⑤⑦
B.②④⑥⑧
C.②③⑤⑦
D.②③⑥⑧
A
