人教化学选修4第四章第3节 电解池(共18张PPT)
文档属性
| 名称 | 人教化学选修4第四章第3节 电解池(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-14 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
电解池原理及其应用
一、电解的基础知识
1、电解
使电流通过电解质溶液(或熔化的电解质)而在阴阳两极发生氧化—还原反应的过程
2、电解池
(1)概念:把电能转化为化学能的装置
(2)形成条件
(1)
有外加电源
(3)
与电解质溶液(或熔化的电解质)形成闭合回路
(2)有阴阳两个电极
阳极
阴极
AgNO3溶液
(3)反应原理
阳离子
阴离子
阴极
阳极
电极反应:
4OH--4e=2H2O+O2
电极反应:Ag++e=Ag
氧化反应
还原反应
电解总反应:4AgNO3+2H2O
4Ag+O2↑+4HNO3
3、电解池中正负极的判断
如何判断电解池的正负极?
(2)根据电子流动的方向判断
(3)根据发生的反应判断
与电源负极相连的为阴极,与电源正极相连的为阳极;
电子流出的一极为阳极,电子流进的一极为阴极;
发生氧化反应的一极为阳极;发生还原反应一极的为阴极
(1)根据电源正负极判断
4、电极反应式和电解总反应式的书写
如何书写电解池的电极反应式?
(1)阳极:注意是否是惰性电极(C
.Pt.Au)
(2)阴极:
失电子的一极,发生氧化反应,需判断什么物质发生了氧化反应,生成了什么物质。
得电子的一极,发生还原反应,需判断什么物质发生了还原反应,生成了什么物质。
注意:总反应式
=
阳极反应式
+
阴极反应式
阳极的电极反应:4OH--4e=2H2O+O2
阴极的电极反应:Ag++e=Ag
怎么判断阴阳离子的放电顺序(即失或得电子的顺序)?
(1)阳离子放电由难到易(离子浓度接近时)
(3)活泼电极作阳极时先放电变成阳离子
常见阴阳离子放电顺序
K+
Ca2+
Na+
Mg2+
Al3+
(H+)
Zn2+
Fe2+
Pb2+
H+
Cu2+
Fe3+
Hg2+
Ag+
(2)阴离子放电由难到易
F-
<
ROmn-
<
OH-
<
Cl-
<
Br-
<
I-
<
S2-
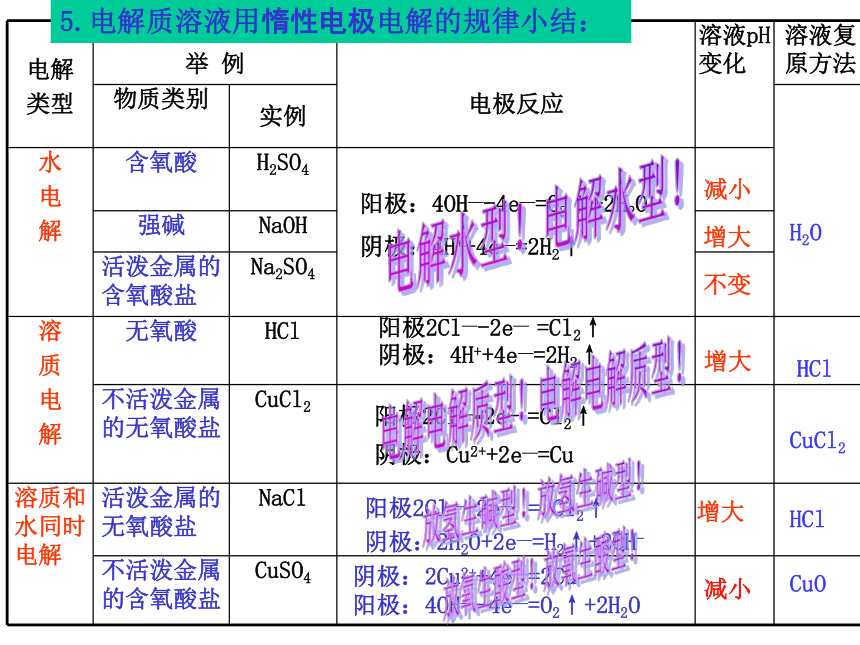
5.电解质溶液用惰性电极电解的规律小结:
阳极:4OH—-4e—=O2↑+2H2O
阴极:4H++4e—=2H2↑
阳极2Cl—-2e—
=Cl2↑
阴极:4H++4e—=2H2↑
阳极2Cl—-2e-
=Cl2↑
阴极:Cu2++2e—=Cu
阳极2Cl—-2e—
=
Cl2↑
阴极:2H2O+2e—=H2↑+2OH-
阳极:4OH—-4e—=O2↑+2H2O
阴极:2Cu2++4e—=2Cu
减小
增大
不变
增大
增大
减小
H2O
HCl
CuCl2
HCl
CuO
电解水型!
电解电解质型!
放氧生酸型!
放氢生碱型!
电解
类型
举
例
电极反应
溶液pH变化
溶液复原方法
物质类别
实例
水
电
解
含氧酸
H2SO4
强碱
NaOH
活泼金属的含氧酸盐
Na2SO4
溶
质
电
解
无氧酸
HCl
不活泼金属的无氧酸盐
CuCl2
溶质和水同时电解
活泼金属的无氧酸盐
NaCl
不活泼金属的含氧酸盐
CuSO4
6、原电池与电解池的比较
铜锌原电池
①②③
正极、负极
负极氧化反应正极还原反应
由负极沿导线流向正极
将化学能转变成电能的装置
电解氯化铜
将电能转变成化学能的装置
阴极、阳极
阳极氧化反应阴极还原反应
由电源负极流入阴极,
由阳极流向电源正极
①②③
构成原电池的条件
①两种活动性不同的电极
②与电解质溶液形成闭合回路
③有能自发发生的氧化还原反应
构成电解池的条件
①有外加电源
②有阴阳两个电极
③与电解质溶液(或熔化的电解质)形成闭合回路
1、以石墨为电极,电解下列物质的水溶液,写
出有关电极反应式和电解总反应式。
①Na2SO4
②NaOH
③H2SO4
④HCl
⑤
CuSO4
⑥
NaCl
2、用下图电解Na2SO4
1、两极的现象:
两极的反应:
2、一段时间后,反接电源
两极的现象:
两极的反应:
3、指出一种用途:
阳极无明显现象
阴极有气泡
阳极Fe-2e-=Fe2+
阴极2H2O+2e-=2OH-+H2
都有大量气泡
阳极2H2O-4e-=2H++O2
阴极4H2O+4e-=2H2+4OH-
制Fe(OH)2
1、判断原电池与电解池
二、原电池原理的运用
2、电镀与精炼铜
a、两极的现象:
两极的反应:
b、CuSO4的浓度是否改变?为什么?
镀层金属作阳极
镀件金属作阴极
阳极铜板逐渐溶解,阴极铁板上有一层铜
阳极:Cu-2e-=Cu2+
阴极:Cu2+
+2e-=Cu
CuSO4的浓度不变,
Cu失2e-电子的同时Cu2+得到2e-
电子,处于平衡状态。
含待镀金属离子的CuSO4作电解质
(1)电镀
(1)概念:
应用电解原理在某些金属表面镀上其它金属或合金的过程
(2)电镀池的形成条件
A、镀件作阴极
B、镀层金属作阳极
C、含镀层金属离子的盐作电解溶液
(2)铜的电解精炼
a、两极的现象:
两极的反应:
b、CuSO4
的浓度是否改变?
电解质溶液为CuSO4溶液
粗铜逐渐溶解,阴极析出紫红色的铜。
阴极:Cu2++2e-=Cu
,
阳极:Cu-2e-=Cu2+
Fe-2e-=
Fe2+
阳极泥(银)
基本不变
3、氯碱工业
阳极—有气泡产生,能使湿润KI淀粉试纸变蓝
阴极—产生气泡,滴入的酚酞变红
问题:
①两电极的反应式?电解的总反应方程式?
②为什么NaOH
在阴极区产生?
③若产生1molH2,则产生Cl2、
NaOH质量各
多少?
转移几摩电子?
(2)电解饱和食盐水反应原理
2H+
+
2e-
=
H2↑
2Cl-
-2e-
=
Cl2↑
还原反应
氧化反应
总反应:
总反应离子方程式:
练习:.关于电解NaCl水溶液,下列叙述正确的是
A.
电解时在阳极得到氯气,在阴极得到金属钠
B.
若在阳极附近的溶液中滴人KI溶液,溶液呈棕色
C,若在阴极附近的溶液中滴人酚酞试液,溶液呈无色
D.
电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
问题:电解NaCl溶液的一般装置的缺点?
①H2和Cl2
混合不安全。
②Cl2会和NaOH反应,会使得到的NaOH不纯
(3)、离子交换膜法制烧碱
问题:离子交换膜电解槽的简单构造如何?作用是什么?
B
电解池原理及其应用
一、电解的基础知识
1、电解
使电流通过电解质溶液(或熔化的电解质)而在阴阳两极发生氧化—还原反应的过程
2、电解池
(1)概念:把电能转化为化学能的装置
(2)形成条件
(1)
有外加电源
(3)
与电解质溶液(或熔化的电解质)形成闭合回路
(2)有阴阳两个电极
阳极
阴极
AgNO3溶液
(3)反应原理
阳离子
阴离子
阴极
阳极
电极反应:
4OH--4e=2H2O+O2
电极反应:Ag++e=Ag
氧化反应
还原反应
电解总反应:4AgNO3+2H2O
4Ag+O2↑+4HNO3
3、电解池中正负极的判断
如何判断电解池的正负极?
(2)根据电子流动的方向判断
(3)根据发生的反应判断
与电源负极相连的为阴极,与电源正极相连的为阳极;
电子流出的一极为阳极,电子流进的一极为阴极;
发生氧化反应的一极为阳极;发生还原反应一极的为阴极
(1)根据电源正负极判断
4、电极反应式和电解总反应式的书写
如何书写电解池的电极反应式?
(1)阳极:注意是否是惰性电极(C
.Pt.Au)
(2)阴极:
失电子的一极,发生氧化反应,需判断什么物质发生了氧化反应,生成了什么物质。
得电子的一极,发生还原反应,需判断什么物质发生了还原反应,生成了什么物质。
注意:总反应式
=
阳极反应式
+
阴极反应式
阳极的电极反应:4OH--4e=2H2O+O2
阴极的电极反应:Ag++e=Ag
怎么判断阴阳离子的放电顺序(即失或得电子的顺序)?
(1)阳离子放电由难到易(离子浓度接近时)
(3)活泼电极作阳极时先放电变成阳离子
常见阴阳离子放电顺序
K+
Ca2+
Na+
Mg2+
Al3+
(H+)
Zn2+
Fe2+
Pb2+
H+
Cu2+
Fe3+
Hg2+
Ag+
(2)阴离子放电由难到易
F-
<
ROmn-
<
OH-
<
Cl-
<
Br-
<
I-
<
S2-
5.电解质溶液用惰性电极电解的规律小结:
阳极:4OH—-4e—=O2↑+2H2O
阴极:4H++4e—=2H2↑
阳极2Cl—-2e—
=Cl2↑
阴极:4H++4e—=2H2↑
阳极2Cl—-2e-
=Cl2↑
阴极:Cu2++2e—=Cu
阳极2Cl—-2e—
=
Cl2↑
阴极:2H2O+2e—=H2↑+2OH-
阳极:4OH—-4e—=O2↑+2H2O
阴极:2Cu2++4e—=2Cu
减小
增大
不变
增大
增大
减小
H2O
HCl
CuCl2
HCl
CuO
电解水型!
电解电解质型!
放氧生酸型!
放氢生碱型!
电解
类型
举
例
电极反应
溶液pH变化
溶液复原方法
物质类别
实例
水
电
解
含氧酸
H2SO4
强碱
NaOH
活泼金属的含氧酸盐
Na2SO4
溶
质
电
解
无氧酸
HCl
不活泼金属的无氧酸盐
CuCl2
溶质和水同时电解
活泼金属的无氧酸盐
NaCl
不活泼金属的含氧酸盐
CuSO4
6、原电池与电解池的比较
铜锌原电池
①②③
正极、负极
负极氧化反应正极还原反应
由负极沿导线流向正极
将化学能转变成电能的装置
电解氯化铜
将电能转变成化学能的装置
阴极、阳极
阳极氧化反应阴极还原反应
由电源负极流入阴极,
由阳极流向电源正极
①②③
构成原电池的条件
①两种活动性不同的电极
②与电解质溶液形成闭合回路
③有能自发发生的氧化还原反应
构成电解池的条件
①有外加电源
②有阴阳两个电极
③与电解质溶液(或熔化的电解质)形成闭合回路
1、以石墨为电极,电解下列物质的水溶液,写
出有关电极反应式和电解总反应式。
①Na2SO4
②NaOH
③H2SO4
④HCl
⑤
CuSO4
⑥
NaCl
2、用下图电解Na2SO4
1、两极的现象:
两极的反应:
2、一段时间后,反接电源
两极的现象:
两极的反应:
3、指出一种用途:
阳极无明显现象
阴极有气泡
阳极Fe-2e-=Fe2+
阴极2H2O+2e-=2OH-+H2
都有大量气泡
阳极2H2O-4e-=2H++O2
阴极4H2O+4e-=2H2+4OH-
制Fe(OH)2
1、判断原电池与电解池
二、原电池原理的运用
2、电镀与精炼铜
a、两极的现象:
两极的反应:
b、CuSO4的浓度是否改变?为什么?
镀层金属作阳极
镀件金属作阴极
阳极铜板逐渐溶解,阴极铁板上有一层铜
阳极:Cu-2e-=Cu2+
阴极:Cu2+
+2e-=Cu
CuSO4的浓度不变,
Cu失2e-电子的同时Cu2+得到2e-
电子,处于平衡状态。
含待镀金属离子的CuSO4作电解质
(1)电镀
(1)概念:
应用电解原理在某些金属表面镀上其它金属或合金的过程
(2)电镀池的形成条件
A、镀件作阴极
B、镀层金属作阳极
C、含镀层金属离子的盐作电解溶液
(2)铜的电解精炼
a、两极的现象:
两极的反应:
b、CuSO4
的浓度是否改变?
电解质溶液为CuSO4溶液
粗铜逐渐溶解,阴极析出紫红色的铜。
阴极:Cu2++2e-=Cu
,
阳极:Cu-2e-=Cu2+
Fe-2e-=
Fe2+
阳极泥(银)
基本不变
3、氯碱工业
阳极—有气泡产生,能使湿润KI淀粉试纸变蓝
阴极—产生气泡,滴入的酚酞变红
问题:
①两电极的反应式?电解的总反应方程式?
②为什么NaOH
在阴极区产生?
③若产生1molH2,则产生Cl2、
NaOH质量各
多少?
转移几摩电子?
(2)电解饱和食盐水反应原理
2H+
+
2e-
=
H2↑
2Cl-
-2e-
=
Cl2↑
还原反应
氧化反应
总反应:
总反应离子方程式:
练习:.关于电解NaCl水溶液,下列叙述正确的是
A.
电解时在阳极得到氯气,在阴极得到金属钠
B.
若在阳极附近的溶液中滴人KI溶液,溶液呈棕色
C,若在阴极附近的溶液中滴人酚酞试液,溶液呈无色
D.
电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
问题:电解NaCl溶液的一般装置的缺点?
①H2和Cl2
混合不安全。
②Cl2会和NaOH反应,会使得到的NaOH不纯
(3)、离子交换膜法制烧碱
问题:离子交换膜电解槽的简单构造如何?作用是什么?
B
