苏教版(必修1)高中化学专题3 第3单元从铝土矿中提取铝 铝的氧化物与氢氧化物(共19张PPT)
文档属性
| 名称 | 苏教版(必修1)高中化学专题3 第3单元从铝土矿中提取铝 铝的氧化物与氢氧化物(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-14 17:06:32 | ||
图片预览






文档简介
(共19张PPT)
苏教版(必修1)
高中化学
高一年级上学期
专题3
从铝土矿中提取铝
第二课时
铝的氧化物与氢氧化物
第十五届梧州宝石节主题
百年商埠,东融共赢
铝的氧化物与氢氧化物
专题3
第一单元从铝土矿到铝合金
1.了解两性氧化物、两性氢氧化物的概念
2.理解氧化铝、氢氧化铝的主要性质及其应用
3.设计制备氢氧化铝的实验方案
学习目标
重点:Al2O3及Al(OH)3的化学性质
难点:制备Al(OH)3实验方案的设计及评价
苍梧中学
杨福荣
走进生活
认识
Al2O3
耐火坩埚
刚玉耐磨球
耐火砖
知识介绍
氧化铝的天然存在形式
铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成
刚玉(P67:资料卡)
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
一、氧化铝(
Al2O3
)
物理性质:
白色固体,难溶于水,熔点高(常用于制造耐火材料),硬度大。
α–Al2O3
β–Al2O3
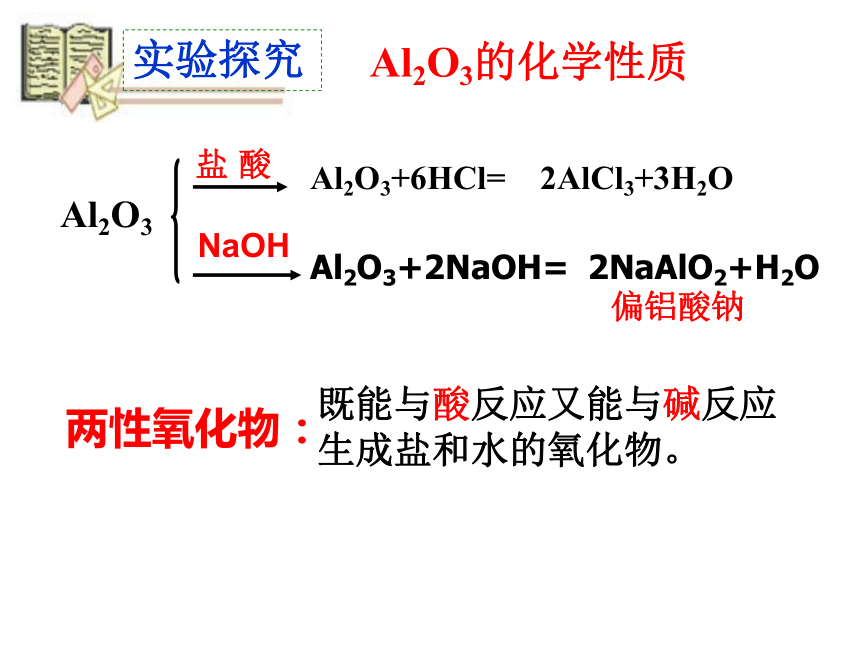
实验探究
Al2O3的化学性质
Al2O3
盐
酸
NaOH
Al2O3+6HCl=
Al2O3+2NaOH=
两性氧化物:
既能与酸反应又能与碱反应
生成盐和水的氧化物。
偏铝酸钠
2AlCl3+3H2O
2NaAlO2+H2O
走进生活
认识
Al(OH)3
阻燃剂:塑料行业
造纸业:防火纸
走进生活
认识
Al(OH)3
牙膏摩擦剂
胃药
二、氢氧化铝(Al(OH)3)
白色胶状物,难溶于水,具有吸附性,
能吸附悬浮物和色素,可以用来净水
物理性质
:
化学工程师:制备Al(OH)3
药品:
AlCl3溶液、
NaOH
溶液、氨水、NaAlO2溶液、盐酸、二氧化碳
实验方案设计
Al
(OH)3
?
AlCl3溶液
NaAlO2溶液
制取Al(OH)3实验方案
实验方案
2.氨水
3.盐酸
NaAlO2
4.CO2
Al
(OH)3
Al
(OH)3
实验注意事项:
1.
A组做AlCl3分别和NaOH、氨水的反应
B组做NaAlO2分别和盐酸、CO2的反应
(吹气时注意只吹不吸哦,且要缓慢吹气)
2.一部分人做实验,一部分人负责观察记录实验现象;实验时先取约两胶头滴管溶液滴入试管中,再滴加其他试剂且要缓慢,同时边滴加边振荡。
1.NaOH
AlCl3
沉淀
AlCl3+3NaOH=
AlCl3
+
3NH3·H2O
=
1.
少量NaOH
AlCl3
2.
AlCl3
NH3·H2O
Al(OH)3+NaOH=
先沉淀后沉淀不溶解
NaOH过量
实验结果分析
3NaCl+Al(OH)3↓
NaAlO2+2H2O
Al(OH)3
↓
+
3NH4Cl
溶解
Al(OH)3
+
3HCl
=
NaAlO2
+
HCl
+
H2O=
少量盐酸
NaAlO2
3.
4.
NaAlO2
CO2
先沉淀后不溶解
2NaAlO2
+
CO
2
(少量)
+
3H2O=
沉淀
盐酸过量
实验结果分析
Al(OH)3↓+
NaCl
AlCl3
+
3H2O
2Al(OH)3↓
+
Na2CO3
Al(OH)3↓+NaHCO3
溶解
NaAlO2
+CO2(足量)
+2H2O=
实验结果
Al(OH)3
+
NaOH
=
NaAlO2+
2H2O
Al(OH)3
+
3HCl
=
AlCl3
+
3H2O
两性氢氧化物:
既能与酸反应又能与碱反应
生成盐和水的氢氧化物。
1.
氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的:
(
)
A
.
碱性
B
.
酸性
C.
两性
D.氧化性
A
2.下列物质中属于两性氢氧化物的是:(
)
A.NaOH
B.Al(OH)3
C.Mg(OH)2
D.Ba(OH)2
B
3.要使AlCl3中的Al3+完全转化成Al(OH)3沉淀,选用的最佳试剂为:(
)
A.NaOH
B.稀盐酸
C.氨水
D.
AgNO3
C
——抢答题
体验高考
(2017年江苏卷,节选)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____________________
Al2O3+2OH-
=2AlO2-+H2O
课堂小结
第2课时铝的氧化物与氢氧化物
1.Al2O3
:两性氧化物
2.Al(OH)3:两性氢氧化物
3.
Al(OH)3
的制备
课后作业
1.完成P70“练习与实践”:第7题。
2.胃舒平是一种常用的胃药,用于治疗胃酸过多,它的主要成分是Al(OH)3,请设计实验方案检验胃舒平中Al(OH)3的存在。
苏教版(必修1)
高中化学
高一年级上学期
专题3
从铝土矿中提取铝
第二课时
铝的氧化物与氢氧化物
第十五届梧州宝石节主题
百年商埠,东融共赢
铝的氧化物与氢氧化物
专题3
第一单元从铝土矿到铝合金
1.了解两性氧化物、两性氢氧化物的概念
2.理解氧化铝、氢氧化铝的主要性质及其应用
3.设计制备氢氧化铝的实验方案
学习目标
重点:Al2O3及Al(OH)3的化学性质
难点:制备Al(OH)3实验方案的设计及评价
苍梧中学
杨福荣
走进生活
认识
Al2O3
耐火坩埚
刚玉耐磨球
耐火砖
知识介绍
氧化铝的天然存在形式
铝土矿
由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成
刚玉(P67:资料卡)
氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂(SiC)(蓝宝石、红宝石是刚玉的一种)
一、氧化铝(
Al2O3
)
物理性质:
白色固体,难溶于水,熔点高(常用于制造耐火材料),硬度大。
α–Al2O3
β–Al2O3
实验探究
Al2O3的化学性质
Al2O3
盐
酸
NaOH
Al2O3+6HCl=
Al2O3+2NaOH=
两性氧化物:
既能与酸反应又能与碱反应
生成盐和水的氧化物。
偏铝酸钠
2AlCl3+3H2O
2NaAlO2+H2O
走进生活
认识
Al(OH)3
阻燃剂:塑料行业
造纸业:防火纸
走进生活
认识
Al(OH)3
牙膏摩擦剂
胃药
二、氢氧化铝(Al(OH)3)
白色胶状物,难溶于水,具有吸附性,
能吸附悬浮物和色素,可以用来净水
物理性质
:
化学工程师:制备Al(OH)3
药品:
AlCl3溶液、
NaOH
溶液、氨水、NaAlO2溶液、盐酸、二氧化碳
实验方案设计
Al
(OH)3
?
AlCl3溶液
NaAlO2溶液
制取Al(OH)3实验方案
实验方案
2.氨水
3.盐酸
NaAlO2
4.CO2
Al
(OH)3
Al
(OH)3
实验注意事项:
1.
A组做AlCl3分别和NaOH、氨水的反应
B组做NaAlO2分别和盐酸、CO2的反应
(吹气时注意只吹不吸哦,且要缓慢吹气)
2.一部分人做实验,一部分人负责观察记录实验现象;实验时先取约两胶头滴管溶液滴入试管中,再滴加其他试剂且要缓慢,同时边滴加边振荡。
1.NaOH
AlCl3
沉淀
AlCl3+3NaOH=
AlCl3
+
3NH3·H2O
=
1.
少量NaOH
AlCl3
2.
AlCl3
NH3·H2O
Al(OH)3+NaOH=
先沉淀后沉淀不溶解
NaOH过量
实验结果分析
3NaCl+Al(OH)3↓
NaAlO2+2H2O
Al(OH)3
↓
+
3NH4Cl
溶解
Al(OH)3
+
3HCl
=
NaAlO2
+
HCl
+
H2O=
少量盐酸
NaAlO2
3.
4.
NaAlO2
CO2
先沉淀后不溶解
2NaAlO2
+
CO
2
(少量)
+
3H2O=
沉淀
盐酸过量
实验结果分析
Al(OH)3↓+
NaCl
AlCl3
+
3H2O
2Al(OH)3↓
+
Na2CO3
Al(OH)3↓+NaHCO3
溶解
NaAlO2
+CO2(足量)
+2H2O=
实验结果
Al(OH)3
+
NaOH
=
NaAlO2+
2H2O
Al(OH)3
+
3HCl
=
AlCl3
+
3H2O
两性氢氧化物:
既能与酸反应又能与碱反应
生成盐和水的氢氧化物。
1.
氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的:
(
)
A
.
碱性
B
.
酸性
C.
两性
D.氧化性
A
2.下列物质中属于两性氢氧化物的是:(
)
A.NaOH
B.Al(OH)3
C.Mg(OH)2
D.Ba(OH)2
B
3.要使AlCl3中的Al3+完全转化成Al(OH)3沉淀,选用的最佳试剂为:(
)
A.NaOH
B.稀盐酸
C.氨水
D.
AgNO3
C
——抢答题
体验高考
(2017年江苏卷,节选)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____________________
Al2O3+2OH-
=2AlO2-+H2O
课堂小结
第2课时铝的氧化物与氢氧化物
1.Al2O3
:两性氧化物
2.Al(OH)3:两性氢氧化物
3.
Al(OH)3
的制备
课后作业
1.完成P70“练习与实践”:第7题。
2.胃舒平是一种常用的胃药,用于治疗胃酸过多,它的主要成分是Al(OH)3,请设计实验方案检验胃舒平中Al(OH)3的存在。
