羧酸和酯(课件)
图片预览






文档简介
(共22张PPT)
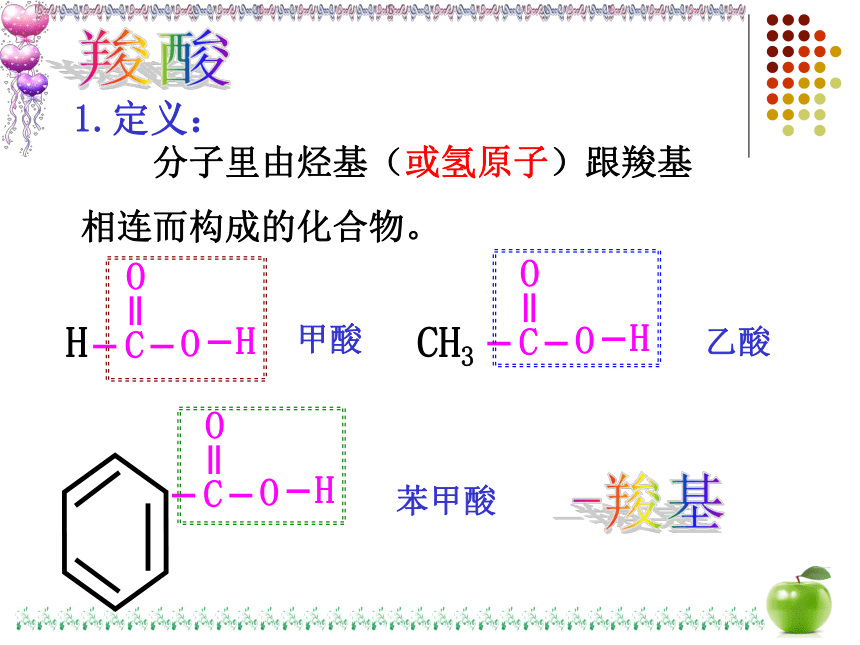
1.定义:
分子里由烃基(或氢原子)跟羧基
相连而构成的化合物。
甲酸
乙酸
C
O
H
H
O
C
O
H
CH3
O
C
O
H
O
苯甲酸
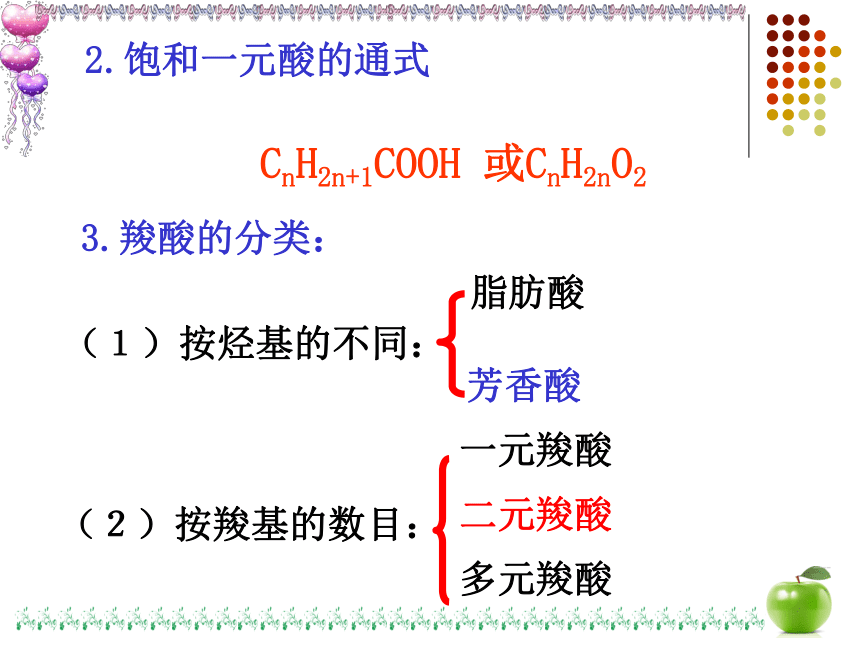
CnH2n+1COOH 或CnH2nO2
2.饱和一元酸的通式
3.羧酸的分类:
(1)按烃基的不同:
(2)按羧基的数目:
多元羧酸
二元羧酸
一元羧酸
脂肪酸
芳香酸
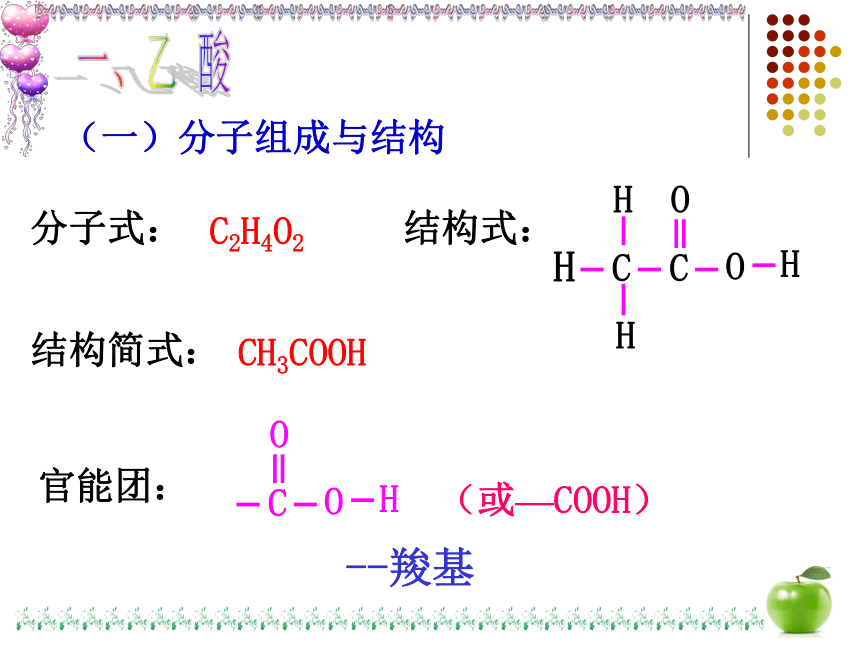
(一)分子组成与结构
C2H4O2
CH3COOH
结构简式:
分子式:
结构式:
官能团:
(或—COOH)
--羧基
C
O
H
O
C
O
H
O
C
H
H
H
无色、有刺激性气味的液体
与水、有机溶剂互溶
(二)乙酸的物理性质
低于16.6℃就凝结成冰状晶体,
无水乙酸又称冰醋酸。
沸点117.9 ℃,熔点16.6℃,
C
O
H
O
C
H
H
H
酸性、取代
取代
氧化反应
实验设计:
药 品:
根据下列药品设计实验
方案证明乙酸的确有酸性
镁粉、NaOH溶液、Na2CO3粉未、
乙酸溶液、酚酞、石蕊、CuSO4 溶液。
可行方案有:
方案一:往乙酸溶液中加石蕊
方案二:往镁粉中加入乙酸溶液
方案三:往Na2CO3粉未中加入乙酸溶液
方案四:NaOH溶液与乙酸溶液混和
酸性:CH3COOH H2CO3 C6H5OH
判断酸性强弱顺序:
实验探究
>
>
(三)化学性质
1、弱酸性
CH3COOH CH3COO- + H+
酸性强弱
酸性:CH3COOH H2CO3 C6H5OH
>
>
2、酯化反应
(三)化学性质
反应后饱和Na2CO3溶液上层有什么现象
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓硫酸
----酯化反应
探究酯化反应可能的脱水方式
浓H2SO4
b、 O O
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
a、
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
酯化反应实质:
酸脱羟基醇脱氢。
CH3 C OH + H 18O C2H5
浓H2SO4
=
O
CH3 C 18O C2H5 + H2O
=
O
有机羧酸和无机含氧酸(如 H2SO4、HNO3等)
酸和醇的酯化反应
C2H5O—NO2 + H2O
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
C2H5OH + HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
混合液添加的顺序
加热时需小心均匀 防止暴沸
乙酸-浓硫酸-乙醇
加入碎瓷片
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓硫酸
浓硫酸的作用
催化剂、吸水剂
加热的目的
提高乙酸乙酯的产率
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓硫酸
导管的作用
冷凝
a.溶解乙醇
b.吸收乙酸
饱和Na2CO3溶液的作用
c.降低乙酸乙酯的溶
解度,便于酯的析出。
导管不能插入饱和Na2CO3溶液中
防止倒吸
1.关于乙酸的下列说法中不正确的是( ).
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有刺激性气味
的液体
D.乙酸分子里有四个氢原子,所以不是一元酸
D
2. 若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
C
A 1种 B 2种 C 3 种 D 4种
生成物中水的相对分子质量为 。
20
3、 酯化反应属于( ).
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应
D
O
CH3—C—O—H
酸性
酯化反应
小结:
课后作业:
1、复习酯化反应
2、预习酯的水解
1.定义:
分子里由烃基(或氢原子)跟羧基
相连而构成的化合物。
甲酸
乙酸
C
O
H
H
O
C
O
H
CH3
O
C
O
H
O
苯甲酸
CnH2n+1COOH 或CnH2nO2
2.饱和一元酸的通式
3.羧酸的分类:
(1)按烃基的不同:
(2)按羧基的数目:
多元羧酸
二元羧酸
一元羧酸
脂肪酸
芳香酸
(一)分子组成与结构
C2H4O2
CH3COOH
结构简式:
分子式:
结构式:
官能团:
(或—COOH)
--羧基
C
O
H
O
C
O
H
O
C
H
H
H
无色、有刺激性气味的液体
与水、有机溶剂互溶
(二)乙酸的物理性质
低于16.6℃就凝结成冰状晶体,
无水乙酸又称冰醋酸。
沸点117.9 ℃,熔点16.6℃,
C
O
H
O
C
H
H
H
酸性、取代
取代
氧化反应
实验设计:
药 品:
根据下列药品设计实验
方案证明乙酸的确有酸性
镁粉、NaOH溶液、Na2CO3粉未、
乙酸溶液、酚酞、石蕊、CuSO4 溶液。
可行方案有:
方案一:往乙酸溶液中加石蕊
方案二:往镁粉中加入乙酸溶液
方案三:往Na2CO3粉未中加入乙酸溶液
方案四:NaOH溶液与乙酸溶液混和
酸性:CH3COOH H2CO3 C6H5OH
判断酸性强弱顺序:
实验探究
>
>
(三)化学性质
1、弱酸性
CH3COOH CH3COO- + H+
酸性强弱
酸性:CH3COOH H2CO3 C6H5OH
>
>
2、酯化反应
(三)化学性质
反应后饱和Na2CO3溶液上层有什么现象
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓硫酸
----酯化反应
探究酯化反应可能的脱水方式
浓H2SO4
b、 O O
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
a、
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
酯化反应实质:
酸脱羟基醇脱氢。
CH3 C OH + H 18O C2H5
浓H2SO4
=
O
CH3 C 18O C2H5 + H2O
=
O
有机羧酸和无机含氧酸(如 H2SO4、HNO3等)
酸和醇的酯化反应
C2H5O—NO2 + H2O
CH3COOCH3 + H2O
CH3COOH + HOCH3
浓H2SO4
C2H5OH + HO—NO2
浓H2SO4
硝酸乙酯
乙酸甲酯
混合液添加的顺序
加热时需小心均匀 防止暴沸
乙酸-浓硫酸-乙醇
加入碎瓷片
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓硫酸
浓硫酸的作用
催化剂、吸水剂
加热的目的
提高乙酸乙酯的产率
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓硫酸
导管的作用
冷凝
a.溶解乙醇
b.吸收乙酸
饱和Na2CO3溶液的作用
c.降低乙酸乙酯的溶
解度,便于酯的析出。
导管不能插入饱和Na2CO3溶液中
防止倒吸
1.关于乙酸的下列说法中不正确的是( ).
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有刺激性气味
的液体
D.乙酸分子里有四个氢原子,所以不是一元酸
D
2. 若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有( )
C
A 1种 B 2种 C 3 种 D 4种
生成物中水的相对分子质量为 。
20
3、 酯化反应属于( ).
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应
D
O
CH3—C—O—H
酸性
酯化反应
小结:
课后作业:
1、复习酯化反应
2、预习酯的水解
