苏教化学选修 化学反应原理专题2第一单元 化学反应速率 (共23张PPT)
文档属性
| 名称 | 苏教化学选修 化学反应原理专题2第一单元 化学反应速率 (共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 432.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-15 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
复习《化学2》:
影响化学反应速率的因素
其他条件相同时,
①浓度越大,反应越快;
②温度越高,反应越快;
③气体压强越大,反应越快;
④催化剂,加快反应。
学习内容:
碰撞理论、活化分子、活化能、过渡态理论
影响化学反应速率的因素
一、碰撞理论
阅读课本P36
1、有效碰撞:能发生化学反应的碰撞。
2、活化分子:能发生有效碰撞的分子(该分子能量高)
3、活化能:发生反应所需要的能量。
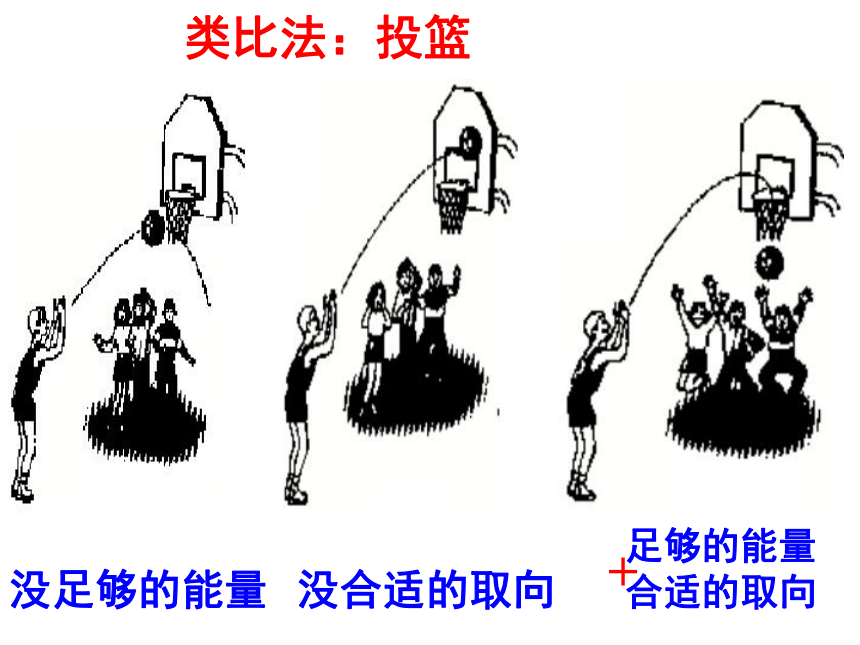
有效碰撞
没合适的取向
没足够的能量
足够的能量
合适的取向
类比法:投篮
+
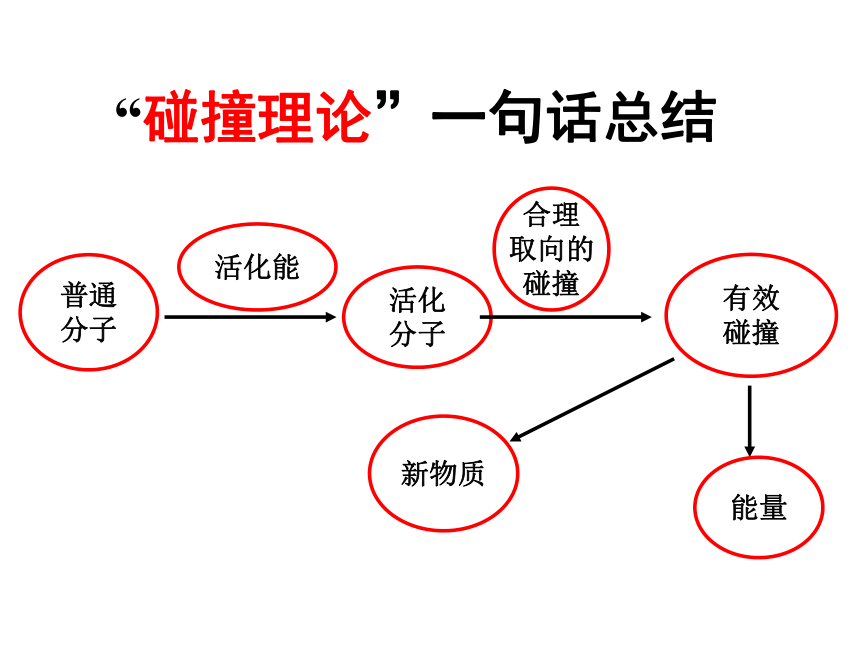
普通
分子
活化能
活化
分子
合理
取向的
碰撞
有效
碰撞
“碰撞理论”一句话总结
能量
反应过程
E1
E2
反应物
生成物
活化分子
反应热
阅读:教材P38图2-7
思考:E1、E2含义?
活化能
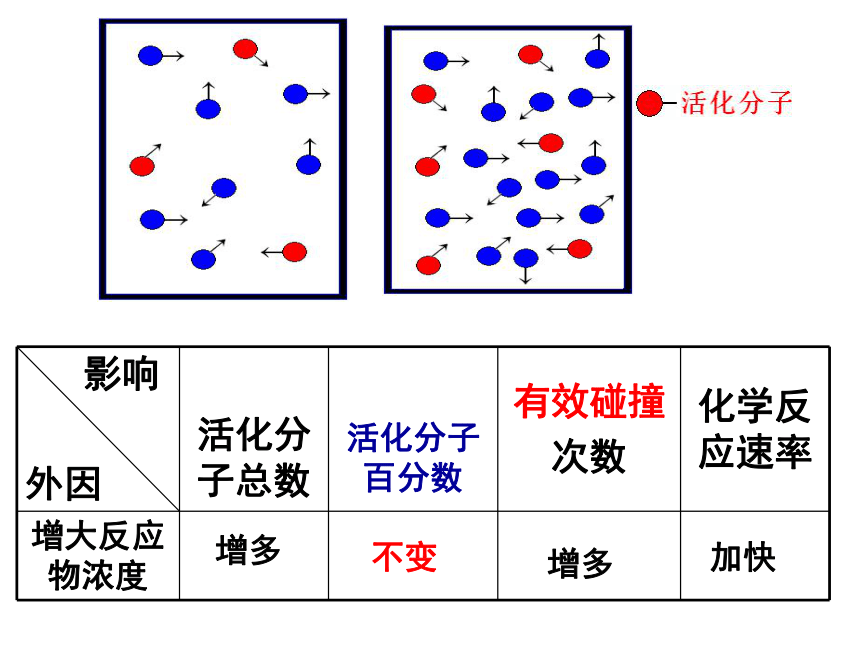
1、浓度对速率的影响:
二、用“碰撞理论”解释浓度、温度、压强对速率的影响:
⑴结论:浓度越大,反应越快
⑵注意两种情况:
A、固体
B、浓H2SO4
⑶用
“碰撞理论”
解释浓度的影响:
增多
不变
增多
加快
影响
外因
有效碰撞
次数
化学反应速率
活化分子总数
活化分子百分数
增大反应物浓度
2、压强对速率的影响:
⑴结论:气体压强越大,反应越快
⑵注意:
压强只与气体有关;
加压,即气体浓度增大。
⑶用
“碰撞理论”
解释压强的影响:
不变
不变
增多
加快
影响
外因
有效碰撞
次数
化学反应速率
活化分子总数
活化分子百分数
加压
(气体体积减小)
⑷两种易错情况:
①恒容:
②恒压:
讨论1:恒容(容积固定),充入稀有气体后,体系压强增大,对化学反应速率有何影响?
N2
H2
Ar
总气压增大
但
N2、H2浓度不变
速率不变
Ar
讨论2:恒压(容积可变),充入稀有气体,分析化学反应速率变化情况。
小结:
⑴、压强变化,实质上就是反应气体浓度变化。若浓度不变,则速率不变。
⑵、加压或增大浓度:活化分子总数变多,但活化分子百分数不变。
3、温度对速率的影响:
⑴结论:温度越高,反应越快
⑵注意:
对所有的反应:升温加快,降温减慢。
⑶用
“碰撞理论”
解释温度的影响:
增多
变大
增多
加快
影响
外因
有效碰撞次数
化学反应速率
活化分子总数
活化分子百分数
升温
三、用“过渡态理论”和“碰撞理论”解释催化剂对速率的影响:
1、结论:对需要催化剂的反应,使用催化剂,加快反应。
2、用“过渡态理论”解释催化剂对速率的影响:
教材P38倒数第二段。
图2-8
过渡态理论
无催化剂过渡态
Ea2
Ea1
有催化剂过渡态
催化剂对化学反应速率的影响
①活化能越低,反应速率越_____
②催化剂是通过_______反应的活化能来增大反应速率
快
降低
过渡态理论
使用催化剂,大大降低反应所需要的能量(即活化能),使更多的普通分子成为活化分子,有效碰撞次数增多,速率增大。
3、用“过渡态理论”和“碰撞理论”解释催化剂对速率的影响:
增多
变大
增多
影响
外因
有效碰撞次数
化学反应速率
活化分子总数
活化分子百分数
催化剂
练习1:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是(
)
A、增大浓度
B、增大压强
C、升高温度
D、使用催化剂
练习2:在密闭容器里,通入
x
molH2和y
molN2,改变下列条件,反应速率将如何改变?
(1)升高温度
;
(2)加入催化剂
;
(3)充入更多的H2
;
(4)扩大容器的体积
;
(5)容器容积不变,通入氖气
。
复习《化学2》:
影响化学反应速率的因素
其他条件相同时,
①浓度越大,反应越快;
②温度越高,反应越快;
③气体压强越大,反应越快;
④催化剂,加快反应。
学习内容:
碰撞理论、活化分子、活化能、过渡态理论
影响化学反应速率的因素
一、碰撞理论
阅读课本P36
1、有效碰撞:能发生化学反应的碰撞。
2、活化分子:能发生有效碰撞的分子(该分子能量高)
3、活化能:发生反应所需要的能量。
有效碰撞
没合适的取向
没足够的能量
足够的能量
合适的取向
类比法:投篮
+
普通
分子
活化能
活化
分子
合理
取向的
碰撞
有效
碰撞
“碰撞理论”一句话总结
能量
反应过程
E1
E2
反应物
生成物
活化分子
反应热
阅读:教材P38图2-7
思考:E1、E2含义?
活化能
1、浓度对速率的影响:
二、用“碰撞理论”解释浓度、温度、压强对速率的影响:
⑴结论:浓度越大,反应越快
⑵注意两种情况:
A、固体
B、浓H2SO4
⑶用
“碰撞理论”
解释浓度的影响:
增多
不变
增多
加快
影响
外因
有效碰撞
次数
化学反应速率
活化分子总数
活化分子百分数
增大反应物浓度
2、压强对速率的影响:
⑴结论:气体压强越大,反应越快
⑵注意:
压强只与气体有关;
加压,即气体浓度增大。
⑶用
“碰撞理论”
解释压强的影响:
不变
不变
增多
加快
影响
外因
有效碰撞
次数
化学反应速率
活化分子总数
活化分子百分数
加压
(气体体积减小)
⑷两种易错情况:
①恒容:
②恒压:
讨论1:恒容(容积固定),充入稀有气体后,体系压强增大,对化学反应速率有何影响?
N2
H2
Ar
总气压增大
但
N2、H2浓度不变
速率不变
Ar
讨论2:恒压(容积可变),充入稀有气体,分析化学反应速率变化情况。
小结:
⑴、压强变化,实质上就是反应气体浓度变化。若浓度不变,则速率不变。
⑵、加压或增大浓度:活化分子总数变多,但活化分子百分数不变。
3、温度对速率的影响:
⑴结论:温度越高,反应越快
⑵注意:
对所有的反应:升温加快,降温减慢。
⑶用
“碰撞理论”
解释温度的影响:
增多
变大
增多
加快
影响
外因
有效碰撞次数
化学反应速率
活化分子总数
活化分子百分数
升温
三、用“过渡态理论”和“碰撞理论”解释催化剂对速率的影响:
1、结论:对需要催化剂的反应,使用催化剂,加快反应。
2、用“过渡态理论”解释催化剂对速率的影响:
教材P38倒数第二段。
图2-8
过渡态理论
无催化剂过渡态
Ea2
Ea1
有催化剂过渡态
催化剂对化学反应速率的影响
①活化能越低,反应速率越_____
②催化剂是通过_______反应的活化能来增大反应速率
快
降低
过渡态理论
使用催化剂,大大降低反应所需要的能量(即活化能),使更多的普通分子成为活化分子,有效碰撞次数增多,速率增大。
3、用“过渡态理论”和“碰撞理论”解释催化剂对速率的影响:
增多
变大
增多
影响
外因
有效碰撞次数
化学反应速率
活化分子总数
活化分子百分数
催化剂
练习1:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是(
)
A、增大浓度
B、增大压强
C、升高温度
D、使用催化剂
练习2:在密闭容器里,通入
x
molH2和y
molN2,改变下列条件,反应速率将如何改变?
(1)升高温度
;
(2)加入催化剂
;
(3)充入更多的H2
;
(4)扩大容器的体积
;
(5)容器容积不变,通入氖气
。
