化学能与电能(原电池)
图片预览


文档简介
第二节 化学能与电能(原电池)
【课标要求】
知识与技能:
1.获得化学能与电能转化的化学实验的基础知识和基本技能,并完成化学能与电能转化的化学实验。
2.形成原电池的概念,探究构成原电池的条件。
过程与方法:
1.经历对化学能与电能转化的化学实验探究的过程,进一步理解探究的意义,学习科学探究的基本方法,提高科学探究的能力。
2.能对自己的探究原电池概念及形成条件的学习过程进行计划、反思、评价、和调控,提高自主学习化学的能力。
情感态度价值观:
发展学习化学的兴趣,乐于探究化学能转化成电能的奥秘。
【教学重点】
初步认识原电池概念、原理、构成及应用
【教学难点】
通过对原电池实验的探究,引导学生从电子转移角度理解化学能向电能转化的本质以及这种转化的综合利用价值。
【教学过程设计】
第一课时
【资料卡片】
热电厂生产的过程
利用煤、石油、天然气等自然界蕴藏量极其丰富的化石燃料发电称为火力发电。燃料在锅炉中燃烧产生蒸汽,用蒸汽冲动汽轮机,再由汽轮机带动发电机发电。中国煤炭的44%用来发电。中国煤炭特点是高硫、高灰分且难洗选煤的比重较大,从1980年到1996年,烟尘排放量基本持平,SO2排放量呈上升的趋势,氮氧化物排放总量得到一定的控制。火电厂冲灰水、灰渣排放量现已彻底解决。
【问题探究】
火电站中,从开始到结束能量是怎样转化的?火力发电利与弊?能否将化学能直接转化为电能?
【归纳小结】
1、火力发电的优点:
①我国煤炭资源丰富,廉价方便.
②电能清洁安全,又快捷方便.
2、火力发电的缺点:
①排出大量的温室效应气体; ②有废气可能导致酸雨;
③废料废水; ④储量有限; ⑤能量转换效率低。
3、火力发电过程中的能量转化:
化学能→热能→机械能→电能
【问题探究】
能否设计一个装置,直接将化学能转化为电能呢?
可以设计一个装置使一个自发进行的氧化还原反应的氧化反应和还原反应分别发生。
【板书设计】
一、化学能直接转化为电能的原理与装置:
【实验探究】
探究 Cu-Zn原电池原理实验:
实 验 现 象
①Cu、Zn分别插入稀硫酸中
②Cu、Zn同时插入稀硫酸中,但不接触
③将Cu、Zn用导线连接起来
④在Cu、Zn导线之间接电流表
⑤将Cu、Zn导线互换再接电流表
【实验结论】
将Cu、Zn用导线连接起来同时插入稀硫酸中,Cu极上会产生气泡,电路中有电流通过。
【归纳小结】
⑴原电池的定义:将化学能转化为电能的装置。
⑵Cu-Zn原电池电极反应式的书写(以铜、锌和稀硫酸组成的原电池为例):
负极(锌片):Zn-2e-==Zn2+(发生 反应)
正极(铜片):2H++2e-==H2↑(发生 反应)
总的离子反应:
⑶原电池原理:
较活泼的金属 ,发生 反应, 从较活泼的金属通过外电路流向 。
【实验探究】
探究原电池构成条件
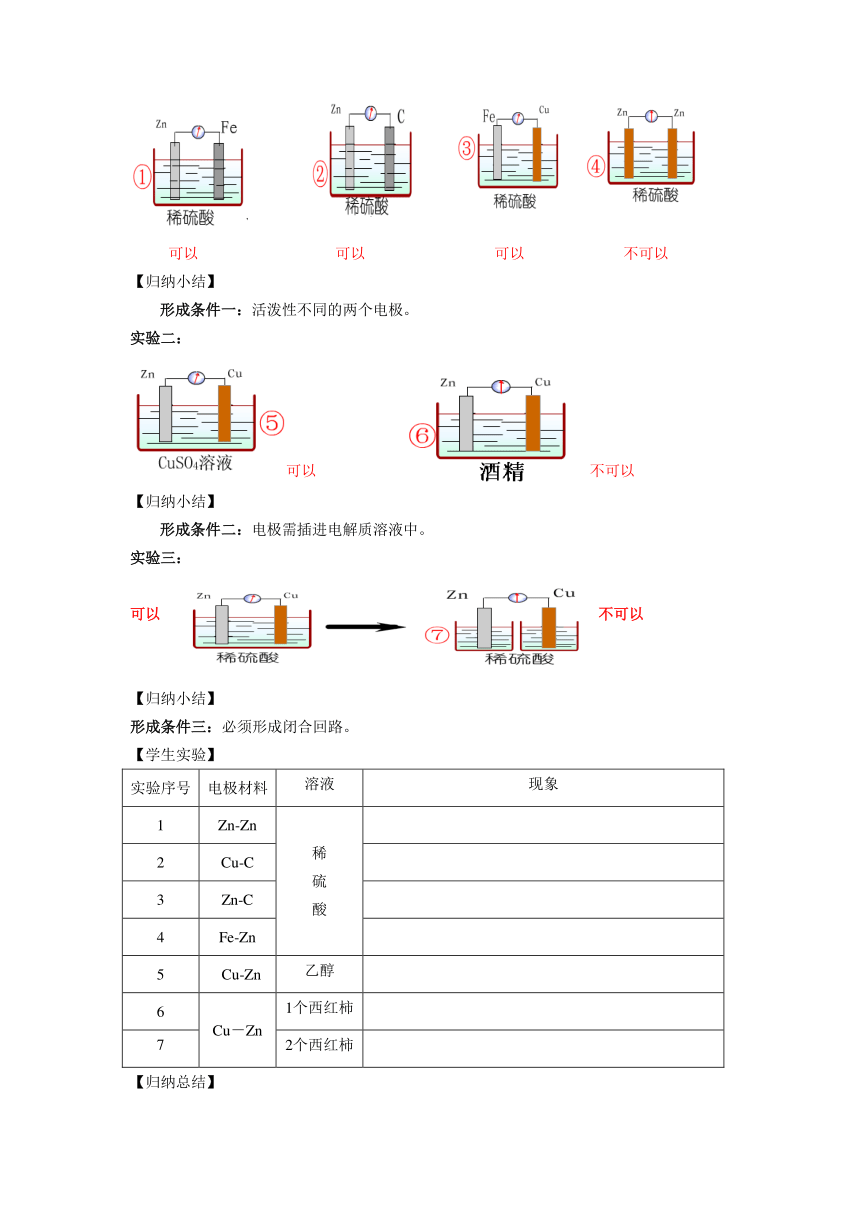
实验一:
可以 可以 可以 不可以
【归纳小结】
形成条件一:活泼性不同的两个电极。
实验二:
可以 不可以
【归纳小结】
形成条件二:电极需插进电解质溶液中。
实验三:
可以不可以
【归纳小结】
形成条件三:必须形成闭合回路。
【学生实验】
实验序号 电极材料 溶液 现象
1 Zn-Zn 稀硫酸
2 Cu-C
3 Zn-C
4 Fe-Zn
5 Cu-Zn 乙醇
6 Cu-Zn 1个西红柿
7 2个西红柿
【归纳总结】
1、原电池构成的条件
①有一个自发进行的氧化还原反应;
②_______________________________________________ ;
③_______________________________________________ ;
④_______________________________________________ 。
2、判断原电池正、负极的方法:
①由组成原电池的两极材料判断:
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断:
电流是由正极流向负极;电子流动方向是由负极流向正极。
③根据原电池两极发生的变化来判断:
④根据原电池里电解质溶液中离子的定向流动方向判断:
原电池里电解质溶液中,阳离子向正极移动,阴离子向负极移动;
⑤根据现象判断:
溶解的一极为负极,增重或有气泡产生的一极为正极。
【一课一练】
1.下列说法中正确的是 ( )
A、原电池是把电能转为化学能的装置
B、原电池中电子流出的一极是正极,发生氧化反应
C、原电池两极均发生氧化还原反应
D、原电池中的阳离子向正极移动
2.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为 ( )
A.铝 B.铜 C.锡 D.硅
3.实验室中制取氢气,最好的方法是 ( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铜、银)与稀硫酸反应
4.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,该金属可能为( )
A.铝 B.铜 C.锡 D.硅
5.将锌片和铜片用导线连接于同一稀硫酸溶液中。下列叙述正确的是 ( )
A.正极附近硫酸根离子的浓度逐渐增大 B.负极附近硫酸根离子的浓度逐渐增大
C.正极、负极硫酸根离子的浓度基本不变 D.正极附近硫酸根离子的浓度逐渐减少
6.铁在下列情况下腐蚀最快的是 ( )
A、铁放入海水中
B、将铁和锌连接后放入到海水中
C、将铁和锌连接后放入到淡水中
D、将铁和锡连接后放入到海水中
7.表明金属甲的活动性比金属乙的活动性强的叙述正确的是 ( )
A.在氧化还原反应中,甲失电子比乙失电子多 B.甲比乙同价态的阳离子的氧化性强
C.甲能与稀盐酸反应生成氢气而乙不能 D.将甲与乙组成原电池时,甲为正极
8.X,Y,Z都是金属,把X浸A Z的硝酸溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。X,Y,Z三种金属的活动性顺序为 ( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
9.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是 ( )
①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出l g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④ C.②和③ D.②和④
10.将锌片和铜片用导线连接于同一稀硫酸溶液中。下列叙述正确的是 ( )
A. 正极附近硫酸根离子的浓度逐渐增大
B. 负极附近硫酸根离子的浓度逐渐增大
C. 正极、负极硫酸根离子的浓度基本不变
D. 正极附近硫酸根离子的浓度逐渐减少
11.有A,B,C,D四种金属。将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,将A,D分别投入等浓度的盐酸中,D比A反应剧烈,将铜浸入B的盐溶液中,无明显变化,若将铜浸入C的盐溶液中,有金属C析出。据此判断这四种金属的活动性由强到弱的顺序是 ( )
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
12.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢(06上海高考题)
13.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中
的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O == 4A1(OH)3,
下列说法不正确的是 (06年江苏高考题) ( )
A.正极反应式为:O2+2H2O+4e ==40H -
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
14.1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久。这种能源起搏器中安装寿命最长、可靠性最高的锂一碳电池,这种电池容量大,电压稳定,能在-56.7~71.1℃温度范围内正常工作。现已在火箭、移动电话、笔记本电脑中广泛使用。它采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液。电池总反应为:8 Li+3SOCl2=6LiCl+Li2SO3+2S。
(1)此电池中 作负极,电极反应为 , 作正极;
(2)该电池用于心脏起搏器时,在生理上的作用是 。
15、根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
16.如图所示装置:
⑴若烧杯中溶液为稀硫酸,则观察到的现象为 。两极反应式为:正极 ;负极 。
该装置将 能转化为 能。
⑵若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
17.有A、B两种金属分别与盐酸反应,产生氢气的速率相近。怎样设计一个实验证明A、B两种金属的活动性?(画出实验装置图)
18、(1)下列装置能否组成原电池?并判断正负极。
19、在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
① 产生这些气体消耗的锌的质量是多少?
② 通过导线的电子的物质的量是多少?
③ 原稀硫酸的物质的量浓度是多少?
【一课一练】参考答案
1、 D 2、C 3.D 4.C 5.C 6、D 7.C 8.C 9.A 10、BD 11.B 12C 13B
14.(1)Li Li-e-=Li+ 石墨
(2)起搏器遵循天然心脏的工作原理通过向心脏发送电脉冲以控制心脏的跳动
15、Z>X>Y>W
16.(1)镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
正极:2H++2e—=H2↑ 负极:Mg-2e—=Mg2+
化学能、电能
(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
17.将A、B金属用导线连接插入盐酸中组成原电池,有气泡冒出的是较不活泼金属,另一极为活泼金属。(图略)
18、答:I能,Fe为负极,Cu为正极;II不能;III能,Fe为负极,C为正极;IV能,Fe为负极,C为正极;V不能。
19、① 9.75 g;② 0.3 mol;③ 0.75 mol/L
【课标要求】
知识与技能:
1.获得化学能与电能转化的化学实验的基础知识和基本技能,并完成化学能与电能转化的化学实验。
2.形成原电池的概念,探究构成原电池的条件。
过程与方法:
1.经历对化学能与电能转化的化学实验探究的过程,进一步理解探究的意义,学习科学探究的基本方法,提高科学探究的能力。
2.能对自己的探究原电池概念及形成条件的学习过程进行计划、反思、评价、和调控,提高自主学习化学的能力。
情感态度价值观:
发展学习化学的兴趣,乐于探究化学能转化成电能的奥秘。
【教学重点】
初步认识原电池概念、原理、构成及应用
【教学难点】
通过对原电池实验的探究,引导学生从电子转移角度理解化学能向电能转化的本质以及这种转化的综合利用价值。
【教学过程设计】
第一课时
【资料卡片】
热电厂生产的过程
利用煤、石油、天然气等自然界蕴藏量极其丰富的化石燃料发电称为火力发电。燃料在锅炉中燃烧产生蒸汽,用蒸汽冲动汽轮机,再由汽轮机带动发电机发电。中国煤炭的44%用来发电。中国煤炭特点是高硫、高灰分且难洗选煤的比重较大,从1980年到1996年,烟尘排放量基本持平,SO2排放量呈上升的趋势,氮氧化物排放总量得到一定的控制。火电厂冲灰水、灰渣排放量现已彻底解决。
【问题探究】
火电站中,从开始到结束能量是怎样转化的?火力发电利与弊?能否将化学能直接转化为电能?
【归纳小结】
1、火力发电的优点:
①我国煤炭资源丰富,廉价方便.
②电能清洁安全,又快捷方便.
2、火力发电的缺点:
①排出大量的温室效应气体; ②有废气可能导致酸雨;
③废料废水; ④储量有限; ⑤能量转换效率低。
3、火力发电过程中的能量转化:
化学能→热能→机械能→电能
【问题探究】
能否设计一个装置,直接将化学能转化为电能呢?
可以设计一个装置使一个自发进行的氧化还原反应的氧化反应和还原反应分别发生。
【板书设计】
一、化学能直接转化为电能的原理与装置:
【实验探究】
探究 Cu-Zn原电池原理实验:
实 验 现 象
①Cu、Zn分别插入稀硫酸中
②Cu、Zn同时插入稀硫酸中,但不接触
③将Cu、Zn用导线连接起来
④在Cu、Zn导线之间接电流表
⑤将Cu、Zn导线互换再接电流表
【实验结论】
将Cu、Zn用导线连接起来同时插入稀硫酸中,Cu极上会产生气泡,电路中有电流通过。
【归纳小结】
⑴原电池的定义:将化学能转化为电能的装置。
⑵Cu-Zn原电池电极反应式的书写(以铜、锌和稀硫酸组成的原电池为例):
负极(锌片):Zn-2e-==Zn2+(发生 反应)
正极(铜片):2H++2e-==H2↑(发生 反应)
总的离子反应:
⑶原电池原理:
较活泼的金属 ,发生 反应, 从较活泼的金属通过外电路流向 。
【实验探究】
探究原电池构成条件
实验一:
可以 可以 可以 不可以
【归纳小结】
形成条件一:活泼性不同的两个电极。
实验二:
可以 不可以
【归纳小结】
形成条件二:电极需插进电解质溶液中。
实验三:
可以不可以
【归纳小结】
形成条件三:必须形成闭合回路。
【学生实验】
实验序号 电极材料 溶液 现象
1 Zn-Zn 稀硫酸
2 Cu-C
3 Zn-C
4 Fe-Zn
5 Cu-Zn 乙醇
6 Cu-Zn 1个西红柿
7 2个西红柿
【归纳总结】
1、原电池构成的条件
①有一个自发进行的氧化还原反应;
②_______________________________________________ ;
③_______________________________________________ ;
④_______________________________________________ 。
2、判断原电池正、负极的方法:
①由组成原电池的两极材料判断:
一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断:
电流是由正极流向负极;电子流动方向是由负极流向正极。
③根据原电池两极发生的变化来判断:
④根据原电池里电解质溶液中离子的定向流动方向判断:
原电池里电解质溶液中,阳离子向正极移动,阴离子向负极移动;
⑤根据现象判断:
溶解的一极为负极,增重或有气泡产生的一极为正极。
【一课一练】
1.下列说法中正确的是 ( )
A、原电池是把电能转为化学能的装置
B、原电池中电子流出的一极是正极,发生氧化反应
C、原电池两极均发生氧化还原反应
D、原电池中的阳离子向正极移动
2.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为 ( )
A.铝 B.铜 C.锡 D.硅
3.实验室中制取氢气,最好的方法是 ( )
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铜、银)与稀硫酸反应
4.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,该金属可能为( )
A.铝 B.铜 C.锡 D.硅
5.将锌片和铜片用导线连接于同一稀硫酸溶液中。下列叙述正确的是 ( )
A.正极附近硫酸根离子的浓度逐渐增大 B.负极附近硫酸根离子的浓度逐渐增大
C.正极、负极硫酸根离子的浓度基本不变 D.正极附近硫酸根离子的浓度逐渐减少
6.铁在下列情况下腐蚀最快的是 ( )
A、铁放入海水中
B、将铁和锌连接后放入到海水中
C、将铁和锌连接后放入到淡水中
D、将铁和锡连接后放入到海水中
7.表明金属甲的活动性比金属乙的活动性强的叙述正确的是 ( )
A.在氧化还原反应中,甲失电子比乙失电子多 B.甲比乙同价态的阳离子的氧化性强
C.甲能与稀盐酸反应生成氢气而乙不能 D.将甲与乙组成原电池时,甲为正极
8.X,Y,Z都是金属,把X浸A Z的硝酸溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。X,Y,Z三种金属的活动性顺序为 ( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
9.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是 ( )
①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出l g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④ C.②和③ D.②和④
10.将锌片和铜片用导线连接于同一稀硫酸溶液中。下列叙述正确的是 ( )
A. 正极附近硫酸根离子的浓度逐渐增大
B. 负极附近硫酸根离子的浓度逐渐增大
C. 正极、负极硫酸根离子的浓度基本不变
D. 正极附近硫酸根离子的浓度逐渐减少
11.有A,B,C,D四种金属。将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,将A,D分别投入等浓度的盐酸中,D比A反应剧烈,将铜浸入B的盐溶液中,无明显变化,若将铜浸入C的盐溶液中,有金属C析出。据此判断这四种金属的活动性由强到弱的顺序是 ( )
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
12.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢(06上海高考题)
13.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中
的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O == 4A1(OH)3,
下列说法不正确的是 (06年江苏高考题) ( )
A.正极反应式为:O2+2H2O+4e ==40H -
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
14.1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久。这种能源起搏器中安装寿命最长、可靠性最高的锂一碳电池,这种电池容量大,电压稳定,能在-56.7~71.1℃温度范围内正常工作。现已在火箭、移动电话、笔记本电脑中广泛使用。它采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液。电池总反应为:8 Li+3SOCl2=6LiCl+Li2SO3+2S。
(1)此电池中 作负极,电极反应为 , 作正极;
(2)该电池用于心脏起搏器时,在生理上的作用是 。
15、根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
16.如图所示装置:
⑴若烧杯中溶液为稀硫酸,则观察到的现象为 。两极反应式为:正极 ;负极 。
该装置将 能转化为 能。
⑵若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
17.有A、B两种金属分别与盐酸反应,产生氢气的速率相近。怎样设计一个实验证明A、B两种金属的活动性?(画出实验装置图)
18、(1)下列装置能否组成原电池?并判断正负极。
19、在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
① 产生这些气体消耗的锌的质量是多少?
② 通过导线的电子的物质的量是多少?
③ 原稀硫酸的物质的量浓度是多少?
【一课一练】参考答案
1、 D 2、C 3.D 4.C 5.C 6、D 7.C 8.C 9.A 10、BD 11.B 12C 13B
14.(1)Li Li-e-=Li+ 石墨
(2)起搏器遵循天然心脏的工作原理通过向心脏发送电脉冲以控制心脏的跳动
15、Z>X>Y>W
16.(1)镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
正极:2H++2e—=H2↑ 负极:Mg-2e—=Mg2+
化学能、电能
(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
17.将A、B金属用导线连接插入盐酸中组成原电池,有气泡冒出的是较不活泼金属,另一极为活泼金属。(图略)
18、答:I能,Fe为负极,Cu为正极;II不能;III能,Fe为负极,C为正极;IV能,Fe为负极,C为正极;V不能。
19、① 9.75 g;② 0.3 mol;③ 0.75 mol/L
