第14专项 物质的结构、组成及化学用语和化学量
文档属性
| 名称 | 第14专项 物质的结构、组成及化学用语和化学量 |

|
|
| 格式 | rar | ||
| 文件大小 | 266.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2011-06-06 00:00:00 | ||
图片预览




文档简介
登陆21世纪教育 助您教考全无忧
第14专项 物质的结构、组成及化学用语和化学量
点击重难点
一、构成物质的微粒
1分子
(1)概念:在由分子构成的物质中,分子是保持物质化学性质的最小粒子。
(2)分子的基本特征:①分子的质量、体积都很小;②分子之间有间隔;③分子在不断地做无规则运动;④同种物质的分子,化学性质相同,不同种物质的分子,化学性质不同;⑤在化学变化中,分子可以再分。
2原子
(1)原子的概念:原子是化学变化中的最小粒子。(用化学方法不能再分)
(2)原子的性质:原子的体积和质量都很小;原子间有间隔;原子也是在不停地做无规则运动;在化学变化中,原子不能再分。
(3)同种原子可以形成性质和结构不同的物质。如:金刚石、石墨、足球烯。
(4)原子结构模型的发展过程。
原子内部结构模型的建立是一个不断完善、不断修正的过程。
道尔顿原子模型(1803年)——实心球模型
汤姆生原子模型(1904年)——西瓜模型(汤姆生发现原子中有电子,带负电)
卢瑟福原子模型(1911年)——行星绕太阳模型(α粒子散射实验:原子核的存在)
波尔原子模型(1913年)——分层模型
电子云模型(1927年~l935年)——电子云模型
(5)原子的构成。
质子(每个质子
原子核(带正电) 带1个单位正电荷
原子(电中性) 中子(不带电)
核外电子(每个电子带1个单位负电荷)
(6)原子中粒子间量的关系:
①核电荷数=质子数=核外电子数
②相对原子质量≈质子数+中子数(原子的质量主要集中在原子核上)
易错点:(1)原子核内质子数不一定等于中子数。(2)普通氢原子核内无中子。
3离子
(1)离子是带电的原子或原子集团。
(2)离子的种类:带正电的离子叫阳离子、带负电的离子叫阴离子。
(3)离子形成的原因:原子得失电子。即失去电子形成阳离子,得到电子形成阴离子。
4体验建立模型的思想
使用模型能简单明了地表示事物,建立模型可以帮助人们认识和理解一些不能直接观察到的事物。
二、物质的组成
1元素的概念
元素是具有相同质子数(即核电荷数)的同一类原子的总称。人类已知的元素有110多种。
关键点:判断是否是同一元素的依据是核电荷数(质子数)是否相同。
2元素的分布
(1)在人体内大约有30多种元素,其中含量较多的元素有氧、碳、氧、氮等11种。
(2)地壳中含量最多的元素是氧,其次是硅,含量最多的金属元素是铝,含量最多的非金属元素是氧。
(3)植物生长过程中需要量较多的是含氮、磷、钾元素的无机盐。植物生长缺乏氮元素时,植株矮小,叶色发黄;缺乏磷元素时,植株暗绿带红;缺乏钾元素时,植株矮小,叶片上带许多褐斑。
易错点:元素符号周围数字的意义。
数字位置 数字意义 举例
元素符号(或化学式)前面 原子个数(或分子个数) 2N:两个氮原子
元素符号右下角 每个分子(原子团)中某原子的个数 N2:一个氮分子中含两个氮原子
元素符号右上角 离子所带的电荷数 Ca2+:一个钙离子带两个单位正电荷
元素符号正上方 元素的化合价 :钙元素显示+2价
三、化学式化学量
1相对原子质量与相对分子质量
(1)相对原子质量:以一种碳原子的质量的1/12作为标准,其他原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。
易错点:相对原子质量是一个比值,没有单位。
(2)相对分子质量:相对分子质量就是一个分子中所有原子的相对原子质量的总和。
2元素的化合价
(1)化合价的含义。
①化合价有正价与负价,如氧元素通常显-2价,氢元素通常显+1价;金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价;一些元素在不同物质中可显不同的化合价。
②在化合物里,正负化合价的代数和为零。
③在单质分子里,元素的化合价为零。
(2)应用化合价推求实际存在的化合物的化学式及利用化学式计算化合价的原则:在化合物里,正负化合价的代数和为零。
3化学式
(1)化学式表示的意义。
化学式意义 以H2O为例
宏观 表示某物质 表示水这种物质
表示该物质由哪些元素组成 表示水是由氢元素和氧元素组成
微观 由分子构成的物质,其化学式可表示该物质的一个分子 表示一个水分子
表示该物质的一个分子的构成 表示一个水分子是由两个氢原子和一个氧原子构成的
分子 原子 离子
不同点 分子是保持物质化学性质的一种微粒 原子是化学变化中最小的微粒 离子是带电的原子或原子团
在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子 在化学反应中不可再分且不能变成其他原子 在化学变化中,可以通过得失电子转变为原子,或组合成新的分子
相同点 质量、体积都非常小,彼此问有间隔,总是在不停地运动。同种分子(或原子、离子)的化学性质相同,不同种分子(或原子、离子)的性质不同,都具有种类和数量的含义
相互关系 分子是由原子构成的,分子可以分解为构成它的原子。离子是带电的原子或原子集团,部分离子可以通过得失电子转变为原子
(2)根据化学式进行简单的计算。
①计算相对分子质量,相对分子质量是1个分子中各原子相对原子质量的总和。
②计算化合物中元素的质量比。
③计算化合物中某元素的质量分数。
评析中考点
考点1 下列对分子、原子、离子的认识,正确的是( )
A分子是保持物质的最小粒子
B原子是最小的粒子,不可再分
C原子得到或失去电子后形成离子
D CO2和CO性质的差异主要是由于分子间的间隔不同
※思路点拨※
分子是保持物质化学性质的最小粒子,不能保持物质的物理性质,故A错。原子是化学变化中最小的粒子,它由原子核和电子构成,所以B错。原子得到电子带负电,失去电子带正电,形成离子,所以C正确。CO2和CO性质的差异是因为分子结构不同,所
以D错。
※解答辨析※
C
※考点点评※
分子、原子、离子的区别与联系。
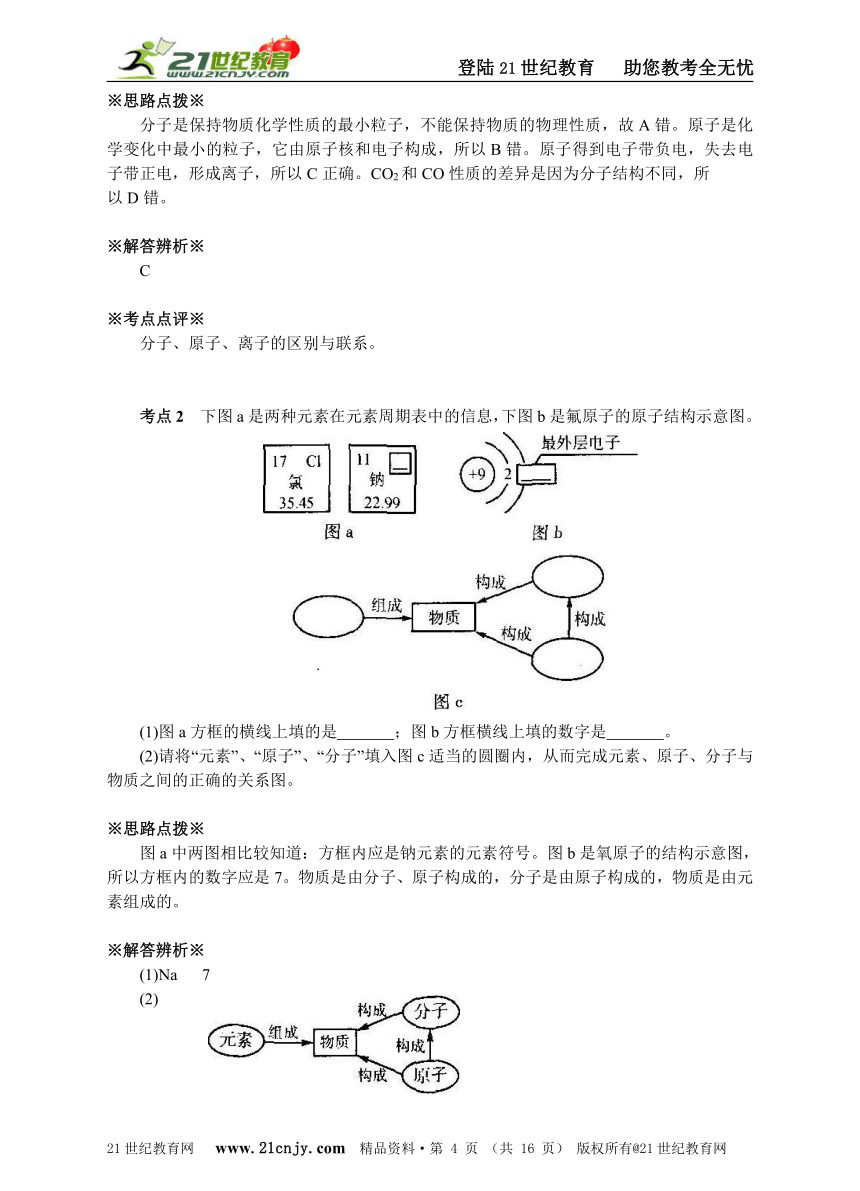
考点2 下图a是两种元素在元素周期表中的信息,下图b是氟原子的原子结构示意图。
(1)图a方框的横线上填的是 ;图b方框横线上填的数字是 。
(2)请将“元素”、“原子”、“分子”填入图c适当的圆圈内,从而完成元素、原子、分子与物质之间的正确的关系图。
※思路点拨※
图a中两图相比较知道:方框内应是钠元素的元素符号。图b是氧原子的结构示意图,所以方框内的数字应是7。物质是由分子、原子构成的,分子是由原子构成的,物质是由元素组成的。
※解答辨析※
(1)Na 7
(2)
※考点点评※
两种元素在元素周期表中的信息是:方框的左上角是元素序数(即原子的质子数),右上角是元素符号,中间是元素名称,下方是相对原子质量;原子结构示意图中,圆圈内的数字是厚子的质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数;任何物质都是由分子、原子或离子构成的,分子是由原子构成的,原子得失电子变为离子,物质是由元素组成的。
考点3 下列物质:Si、N2、O2、CH4、H2O2、MgCl2、C2H5OH、C、Ar、Ns2S、Cu、Ca、Ne等,哪些物质是由分子构成的 哪些物质是由原子构成的 哪些物质是由离子构成的
※思路点拨※
分子、原子、离子均可直接构成物质。对于单质由分子或原子直接构成,而化合物要么由分子构成,要么由离子构成。
※解答辨析※
由原子构成的有:Si、C、Ar、Cu、Ca、Ne
由分子构成的有:N2、O2、 CH4、H2O2、C2H5OH
由离子构成的有:MgCl2、Na2S
※考点点评※
(1)在单质中化学式右下角加数字的都是由分子构成的,其他单质化学式直接用元素符号表示的都是由原子构成的。(2)在化合物中化学式出现金属元素符号的一般是由离子构成的,化合物的化学式中全部是非金属元素符号的是出分子构成的(铵盐除外)。
考点4 (1)用化学用语填空。
①碘元素 ②两个银原子
③3个氮分子 ④碱中的阴离子
⑤氧化亚铁中铁元素显+2价
(2)写出下列符号所表示的意义。
①K 5O2
③K+ ④3SO42-
⑤SO4
※思路点拨※
本题考查元素符号及化学式周围不同位置上数字所表示的意义。一般说来,数字在元素符号周围位置不同其意义是不同的。
※解答辨析※
(1)①Ⅰ ②2Ag ③3N2 ④OH- ⑤ (2)(D表示钾元素;l个钾原子;单质钾 ②表示5个氧分子③表示1个钾离子带1个单位正电荷;表示钾离子 ④表示3个硫酸根离子 ⑤表示硫酸钙中钙元素的化合价为+2价
※考点点评※
化学符号(M)周围的数字(n)表示的意义如下: (1)左边:nM:①M为元素符号,一般表示n个M原子;②M为化学式,一般表示n个M分子;③M为离子符号,一般表示n个离子。(2)右上角:①Mn+表示一个M n+带n个单位的正电荷;②Mn-表示一个Mn-带n个单位的负电荷。(3)正上方:①表示M元素在化合物中显+n价;②表示M元素在化合物中显一n价。(4)右下角:Mn表示分子中M原子的个数。此外。单独的一个元素符号或者化学式,既有宏观意义(表示某元素或某物质),又具有微观意义(表示元素的一个原子或物质的一个分子);如果在其前加了一个数字,那就只有微观意义了,不具有宏观意义。
考点5 在氮与氧形成的氧化物中,氮与氧的质量比为7:20,则此氧化物中氮元素的化合价是( )
A +4 B +3
C +5 D +l
※思路点拨※
我们已经知道了氧元素在化合物中的化合价一般为一2价,则氮元素在此化合物中一定显正价,又知在化合物中氮与氧的质量比为7:20,所以只要写出化学式即可求出化合价。设该氧化物的化学式为NxOy,则有l4x:16y=7:20,所以x:y=2:5,即化学式为N2O5,根据化合物中元素正负化合价代数和为零的原则,N显+5价,故选C。
※解答辨析※
C
※考点点评※
当告诉我们化合物中两元素的质量比,无论是让我们求化学式还是求某元素的化合价,都应先设出该化合物的化学式,由元素的质量比列出等式,从而求出元素的原子个数比,便可写出化学式,也就能根据化学式中元素正负化合价的代数和为零推出未知元素的化合价。
聚焦失分点
易错1 下列说法正确的是( )
A质子数相同的粒子,一定是同种元素
B最外层电子数相同的粒子,一定是同一种原子
C不同元素的原子。核内中子数一定不同
D同种元素的原子,质子数一定相同
※对症下药※
用元素的概念和原子结构的相关知识,逐一分析各选项,找出正确的选项。A项:关键词是“粒子”,分子、原子、离子、质子、电子等都可以叫粒子。这样,像CH4、NH3、H2O、HF、Ne这些物质的每个分子里质子数都是l0个,而它们却是不同的物质。只有质子数相同的原子才能属于同一种元素,因此本题容易把“粒子”谩认为是原子,导致判断错误。B项:首先最外层电子数相同的粒子不一定是原子。例如Na+、Mg2+、Al3+、F一、O2-等,最外层电子数相同,但它们是离子,不是同一种原子。再者K和Na及F和Cl等它们的最外层电子数也相同,也不是同种原子。C项:不同元素的原子核内的中子数可能不同也可能相同,区别不同元素的原子,只能根据原子的核电荷数,即核内质子数进行判断,与中子数无关,如常见的钠原子和镁原子,它们的核内中子数都是l2个。D项:同种元素的原子,质子数一定相同。元素的概念是具有相同核电荷数(即质子数)的同一类原子的总称,故同种元素的原子核内质子数一定相同。应抓住概念的实质,去分析各种说法,判断其正误。解概念型的题时,要认真审题,推敲每一句话中的字、词的意思,然后与概念及相关知识点一一对照。故答案选D。
※提分练习※
1 在宏观物质、微观粒子和化学符号之间建立联系,是化学科学特有的思维方式。已知氢、碳、氧、钠、氯五种元素的核电荷数分别为:l、6、8、11、17。试按下列要求,写出微观粒子的化学符号,以及由这种粒子构成的或含有这种粒子的一种物质的名称(微观粒子和物质所涉及的元素限定在上述五种元素内)。
需满足的条件 粒子的化学符号 对应物质的名称
(1)质子数为11的同种元素的原子和离子
(2)质子数均为l0的两种不同的分子
(3)质子数为1的阳离子和质子数为9的阴离子
易错2 达菲是治疗甲型HlNl流感的有效药品之一,其主要制作原料是八角茴香中的莽草酸(C7H10O5)。下列关于莽草酸的说法中,正确的是( )
A莽草酸由碳、氢、氧三个元素组成
B莽草酸由7个碳原子、l0个氢原子、5个氧原子构成
C莽草酸的相对分子质量为174克
D莽草酸中碳、氢、氧元素的质量比为42:5:40
※对症下药※
本题考查化学式的意义。错误主要表现在不能正确表达化学式意义及进行计算。由莽草酸(C7H10O5)化学式可知它由碳、氢、氧三种元素组成,注意元素不能以个数论,因此A选项是错误的;莽草酸是由莽草酸分子构成的;化学式量是一个比值,是没有单位的,因此C选项也是错误的。本题正解为D:莽草酸中碳、氢、氧元素的质量比=(12×7):(1×10):(16×
5)=42:5:40。
※提分练习※
2 陶瓷是传统的无机非金属材料,黏土[主要成分Al2Si2O5(OH)4]是制备陶瓷的原料之一。下列关于Al2Si2O5(OH)4的说法中,正确的是( )
A它由4种元素组成
B其中铝元素的化合价为+3价
C其中氢、氧元素的质量比是4:9
D其中硅元素的质量分数为56%
专项集训
※能力提升※
1 下面是甲、乙两种物质的结构示意图,图中小圆圈均代表碳原子。这两种物质在氧气中完全燃烧后的产物都是二氧化碳,但它们的物理性质却明显不同,如导电性、硬度等。据此,下列说法错误的是( )
A甲、乙两种物质中的碳原子大小相同
B甲、乙两种物质都是碳单质
C甲、乙两种物质中原子的空间排列方式不同
D将甲、乙两种物质混合后得到的是纯净物
2 2010年4月5 日,科学家成功合成了第117号新元素,填补了第116号和ll8号元素之间的空缺。推测该元素为ll7号元素的依据是( )
A中子数 B质子数
C电子数 D中子数和质子数
3 冰岛火山灰曾严重影响欧洲飞机的正常飞行。火山灰是细微的火山碎屑物,它质地坚硬、不溶于水,含有硫、钙、硅、氧及重金属等成分。这里所说的成分是指( )
A元素 B 原子
C 分子 D单质
4 用“ ”表示氢原子、“●”表示氧原子。下列方框中,符合“2H2O”所表示意义的是( )
5 下列物质的名称、化学式和所属的类别都正确的是( )
A甲烷、CH4、有机物
B锰、MN、金属单质
C氯酸钾、KClO3、金属氧化物
D氧化汞、HgO、非金属氧化物
6 铌酸锂(LiNbO3)晶体是目前用途最广泛的新型无机材料之一。下列关于铌酸锂说法正确的是( )
A铌酸锂是一种氧化物
B铌酸锂是由五个原子构成的
C铌酸锂是由铌、锂、氧三种元素组成的
D铌酸锂中铌、锂、氧元素的质量比为93:7:16
7 如图为某物质的分子模型示意图,其中“ ”代表氢原
子,“●”代表氧原子。下列叙述正确的是( )
A此物质属于混合物
B此物质的化学式中氧元素的化合价为一2价
C此物质的一个分子由4个原子构成
D此物质中氢元素与氧元素的质量比是l:1
8 随着分子、原子研究技术的提高,科学家可以利用原子来“组装”分子。若用这种技术组装成脱氧核糖分子(C5H10O4),则该分子中不含有的原子是( )
A氯原子 B碳原子
C氧原子 D氢原子
9 中科院的全超导的“人造太阳”——托克马克核聚变试验装置的调试运行成功,使我国在该领域的研究处于世界前列。氘和氚是核聚变的原料(氘、氚原子核内都只有l个质子,但含不同数目的中子),聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )
A核聚变是化学变化
B氘原子和氚原子属于不同元素
C氘原子和氚原子是氢的两种同位素
D氘原子和氚原子的相对原子质量相同
10 右图是元素周期表中的一格,依据图中的信息得到的下列认
识错误的是( )
A该元素原子的质子数为l4
B该元素属于非金属元索
C该元素一个原子的原子核外有14个电子
D该元素的相对原子质量为28.09克
11 参考下列物质的微观结构图示,其中由阴、阳离子构成的物质是( )
12 物质的结构决定物质的性质,下列关于物质结构与性质的说法不正确的是( )
A生铁和钢的性质不同,是由于含碳量不同
B金属钠和镁的性质不同,是由于钠和镁的原子结构不同
C金刚石和石墨的物理性质不同,是由于碳原子的排列方式不同
D CO和CO2的性质不同,是由于CO2比CO中的氧原子多
13 下列图示的各物质(或元素)相对含量错误的是( )
14 不少小学生喜食油炸薯条。但是,油炸薯条易产生一种叫丙烯酰胺的致癌物,长期摄入易引发多种疾病,其结构为:
。据此,不能推断出丙烯酰胺的( )
A组成元素 B密度、状态
C化学式 D相对分子质量
15 下图为元素周期表第三周期的局部。据此判断下列说法中正确的是( )
11 Na23.00 12 Mg24.31 13 A126.98 14 Si28.09
A它们都属于金属元素
B 1个铝原子的质量是26.98g
C硅元素的原子序数为l4
D镁元素的相对原子质量为l2
16 食醋是厨房中的一种谪昧品,其中含有少量醋酸。下列有关醋酸的说法不正确的是( )
A醋酸分子是由碳、氢、氧三种原子构成的
B醋酸中碳元素的质量分数为40%
C醋酸分子是由碳、氢、氧三种元素组成的
D每个醋酸分子中有8个原子核
17 自2010年4月1日开始,我国对酒后驾驶进行了专项整治。交警用装有重铬酸钾(K2Cr2O7)的检测仪,来检测司机是否洒后驾车。其原理是红色的重铬酸钾遇酒精后生成蓝绿色的物质。下列说法不正确的是( )
A重铬酸钾是由三种元素组成的
B该变化是化学变化
C重铬酸钾的相对分子质世是294
D组成重铬酸钾的各元素个数比为2:2:7
18 化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A从性质上看:丁烷具有可燃性
B 从变化上看:丁烷完全燃烧只生成水
C从组成上看:丁烷由碳、氢两种元素组成
D从结构上看:一个丁烷分子由4个碳原子、10个氯原子构成
19 建立一个适当的模型来反映和代替客观现象。可以更简单明了地表示事物。
(1)甲图是人体中元素质量分数模型,则A代表的一种元素是 。
(2)小明模仿甲图构建了NH4NO3中各元素质量分数的模型(如乙图),则乙图中表示氯元素的是 。
20 从H、C、O、Na、S、Cl、Ca、N八种元素中,选择适当的元素组合填空,写出符合下列要求的化学式(每空各写一个):
(1)最简单的有机物是 。
(2)含有四种元素的化合物是 。
(3)溶于水后溶液呈碱性的气体是 。
(4)可用作氮肥的是 。
21 现有H,C、O、S、Cu五种元素,请选用其中的元素写出符合下列要求的物质各一个(用化学式表示):
(1)用于制造电线电缆的是 。
(2)天然气的主要成分是 。
(3)会形成酸雨的气体是 。
(4)中学化学实验室中最常用的溶剂是 。
(5)能溶于水形成蓝色溶液的盐是 。
22 铝土矿的主要成分是氧化铝(A12O3),在氧化铝中铝元素与氧元素的质量之比是 。170吨含氧化铝80%的铝土矿,理论上可炼出金属铝 吨。
23 过氧乙酸(化学式为C2H4O3)常用作消毒剂。计算(本题只要求写出计算结果):
(1)过氧乙酸中碳、氢、氧三种元素的质量比。
(2)过氧乙酸中氧元素的质量分数。
24 下列各组物质中,带点的同种元素的化合价相同的是( )
A Cl2、NaCl B NH4Cl、HNO3
C MnO2、K2MnO4 D P2O5、Ca3(PO4)2
25 科学家发现.从红豆杉中提取的紫杉醇(C,H47H51NO14)是一种抗癌新药;l994年之后,科学家在实验室里人工合成了紫杉醇。似如人工合成的紫杉醇与天然紫杉醇的成分和结构完全相同,你认为使用天然紫杉醇的疗效是否比人工合成的紫杉醇更好 (填“是”或“不是”)。据此计算紫杉醇中的碳、氢、氮、氧元素的质量比是 。
26 按要求用相应的化学符号填空。
(1)酒精 。
(2)两个氢离子 。
(3)地壳中含量最多的元素 。
(4)写出五氧化二磷的化学式.并标出其中磷元素的化合价 。
27 自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:(“ ”表示氧原子,“ ”表示氢原于,“ ”表示氯原子)
(1)上述图中所出现的物质中,共有 种含有氧元素的化合物。
(2)从图中我们可知,在化学反应中,反应前后 个数不变。
(3)上述两个化学反应是否都属于四种基本反应类型 。(填“是”或“否”)
※冲击高分※
1 兰州某大型洗衣店的废水经沉淀后直接排放到黄河中,在人河口水中藻类等浮游生物大量繁殖,水呈绿色。
(1)造成这种现象的原因可能是洗衣店排放的废水中含较多的 元素。
(2)资料显示河水中的藻类的化学式为CxHyO110N16P。计算藻类中氮、氧元素的质量比为
。
(3)已知该藻类相对分子质量为3 550,碳元素的质量分数为35.8%。计算其中x的近似值。(请写出计算过程)
2 微粒模型观察与比较。如下图所示,在钠与氯气的反应中,每个钠原子失去l个电子,成为l个钠离子;每个氯原子得到l个电子,成为l个氯离子;钠离子与氯离子结合形成氯化钠。因为1个电子的质量大约为l个质子或中子质量的1/1836,故原子的质量几乎都集中在原子核上。
若用r、m分别表示微粒的半径和质量,用“<”、“>”或“≈”填空。
(1)m(Na) m(Na+)。
(2)r(Cl) r(C1-)。
(3)r(Na) r(Cl)。
(4)r(Na+) r(C1-)。
3 下表是国家对“饮酒驾车”和“醉酒驾车”的界定标准:
饮酒驾车 20毫克/100毫升≤ 血液中的酒精含量<80毫克/100毫升
醉酒驾车 血液中的酒精含量≥80毫克/100毫升
白酒、红酒和啤酒中均含有乙醇(俗称酒精,化学式为C2H5OH),饮酒后酒精可进入人体血液中。请回答下列问题:
(1)乙醇(C2H5OH)中碳、氢、氧元素的质量比是C:H:O= 。
(2)饮酒会使人的 系统过度兴奋或麻痹抑制,容易引发交通事故。某人饮酒后驾车,被交警发现,经测定其每100毫升血液中酒精含量为93毫克,属于 驾车。
(3)在治理酒后驾车中,酒精检测仪发挥了重要作用。如图甲是酒精检测仪,图乙是检测仪的简化电路图,R0为定值电阻,R为气敏电阻,该电阻阻值与酒精气体含量的关系如图丙,如果图乙中电流表示数越大,说明司机吹出的气体中酒精含量就 。
4 某甲醛溶液中氢元素的质量分数为10%,则碳元素的质量分数为多少 (甲醛的化学式为HCHO)
答案
提分练习
1
粒子的化学符号 对应物质的名称
Na 金属钠
Na+ 氯化钠(氢氧化钠等)
H2O 水
CH4(HF、NH3) 甲烷(氟化氢、氨气等)
H+ 盐酸(硫酸)
OH-(F-) 氢氧化钠(氟化氢)
2 AB
专项集训
能力提升
1 D 2 B 3 A 4 D 5 A 6 C 7 C 8 A 9 C 10 D 11C l2 D 13 A 14B l5 C 16 C 17 D 18 B
19 (1)氧 (2)B
20 (1)CH4 (2)NaHCO3[或Ca(HCO3)2]等合理即可 (3)NH3
(4)NH4HCO3、CO(NH2)2、NH4Cl、NH4NO3、(NH4)2SO4均可
21 (1)Cu (2)CH4 (3)SO2 (4)H2O (5)CuSO4
22 9:8 72
23 (1)6:1:12 (2)63.2% 24 D 25不是 564:51:14:224
26 (1)C2H5OH(或CH2CH2OH或C2H6O) (2)2H+ (3)O (4)
27 (1)两 (2)原子 (3)否
冲击高分
1 (1)P (2)N:O=7:55 (3)3.550×35.8%÷12≈106
2 (1) ≈ (2)< (3)> (4)<
3 (1)12:3:8 (2)中枢神经(或神经)醉酒 (3)越大
4 HCHO可写作C(H2O),可虚拟由HCHO和H2O构成的溶液的化学式为Cm(H2O)n
H%=l0% 则H2O%=H%× =90%
所以C%=1-H2O%=1-90%=10%
答:碳元素的质量分数为10%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 16 页 (共 16 页) 版权所有@21世纪教育网
第14专项 物质的结构、组成及化学用语和化学量
点击重难点
一、构成物质的微粒
1分子
(1)概念:在由分子构成的物质中,分子是保持物质化学性质的最小粒子。
(2)分子的基本特征:①分子的质量、体积都很小;②分子之间有间隔;③分子在不断地做无规则运动;④同种物质的分子,化学性质相同,不同种物质的分子,化学性质不同;⑤在化学变化中,分子可以再分。
2原子
(1)原子的概念:原子是化学变化中的最小粒子。(用化学方法不能再分)
(2)原子的性质:原子的体积和质量都很小;原子间有间隔;原子也是在不停地做无规则运动;在化学变化中,原子不能再分。
(3)同种原子可以形成性质和结构不同的物质。如:金刚石、石墨、足球烯。
(4)原子结构模型的发展过程。
原子内部结构模型的建立是一个不断完善、不断修正的过程。
道尔顿原子模型(1803年)——实心球模型
汤姆生原子模型(1904年)——西瓜模型(汤姆生发现原子中有电子,带负电)
卢瑟福原子模型(1911年)——行星绕太阳模型(α粒子散射实验:原子核的存在)
波尔原子模型(1913年)——分层模型
电子云模型(1927年~l935年)——电子云模型
(5)原子的构成。
质子(每个质子
原子核(带正电) 带1个单位正电荷
原子(电中性) 中子(不带电)
核外电子(每个电子带1个单位负电荷)
(6)原子中粒子间量的关系:
①核电荷数=质子数=核外电子数
②相对原子质量≈质子数+中子数(原子的质量主要集中在原子核上)
易错点:(1)原子核内质子数不一定等于中子数。(2)普通氢原子核内无中子。
3离子
(1)离子是带电的原子或原子集团。
(2)离子的种类:带正电的离子叫阳离子、带负电的离子叫阴离子。
(3)离子形成的原因:原子得失电子。即失去电子形成阳离子,得到电子形成阴离子。
4体验建立模型的思想
使用模型能简单明了地表示事物,建立模型可以帮助人们认识和理解一些不能直接观察到的事物。
二、物质的组成
1元素的概念
元素是具有相同质子数(即核电荷数)的同一类原子的总称。人类已知的元素有110多种。
关键点:判断是否是同一元素的依据是核电荷数(质子数)是否相同。
2元素的分布
(1)在人体内大约有30多种元素,其中含量较多的元素有氧、碳、氧、氮等11种。
(2)地壳中含量最多的元素是氧,其次是硅,含量最多的金属元素是铝,含量最多的非金属元素是氧。
(3)植物生长过程中需要量较多的是含氮、磷、钾元素的无机盐。植物生长缺乏氮元素时,植株矮小,叶色发黄;缺乏磷元素时,植株暗绿带红;缺乏钾元素时,植株矮小,叶片上带许多褐斑。
易错点:元素符号周围数字的意义。
数字位置 数字意义 举例
元素符号(或化学式)前面 原子个数(或分子个数) 2N:两个氮原子
元素符号右下角 每个分子(原子团)中某原子的个数 N2:一个氮分子中含两个氮原子
元素符号右上角 离子所带的电荷数 Ca2+:一个钙离子带两个单位正电荷
元素符号正上方 元素的化合价 :钙元素显示+2价
三、化学式化学量
1相对原子质量与相对分子质量
(1)相对原子质量:以一种碳原子的质量的1/12作为标准,其他原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。
易错点:相对原子质量是一个比值,没有单位。
(2)相对分子质量:相对分子质量就是一个分子中所有原子的相对原子质量的总和。
2元素的化合价
(1)化合价的含义。
①化合价有正价与负价,如氧元素通常显-2价,氢元素通常显+1价;金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价;一些元素在不同物质中可显不同的化合价。
②在化合物里,正负化合价的代数和为零。
③在单质分子里,元素的化合价为零。
(2)应用化合价推求实际存在的化合物的化学式及利用化学式计算化合价的原则:在化合物里,正负化合价的代数和为零。
3化学式
(1)化学式表示的意义。
化学式意义 以H2O为例
宏观 表示某物质 表示水这种物质
表示该物质由哪些元素组成 表示水是由氢元素和氧元素组成
微观 由分子构成的物质,其化学式可表示该物质的一个分子 表示一个水分子
表示该物质的一个分子的构成 表示一个水分子是由两个氢原子和一个氧原子构成的
分子 原子 离子
不同点 分子是保持物质化学性质的一种微粒 原子是化学变化中最小的微粒 离子是带电的原子或原子团
在化学反应中,分子可以分解为原子,原子又可以重新组合成新物质的分子 在化学反应中不可再分且不能变成其他原子 在化学变化中,可以通过得失电子转变为原子,或组合成新的分子
相同点 质量、体积都非常小,彼此问有间隔,总是在不停地运动。同种分子(或原子、离子)的化学性质相同,不同种分子(或原子、离子)的性质不同,都具有种类和数量的含义
相互关系 分子是由原子构成的,分子可以分解为构成它的原子。离子是带电的原子或原子集团,部分离子可以通过得失电子转变为原子
(2)根据化学式进行简单的计算。
①计算相对分子质量,相对分子质量是1个分子中各原子相对原子质量的总和。
②计算化合物中元素的质量比。
③计算化合物中某元素的质量分数。
评析中考点
考点1 下列对分子、原子、离子的认识,正确的是( )
A分子是保持物质的最小粒子
B原子是最小的粒子,不可再分
C原子得到或失去电子后形成离子
D CO2和CO性质的差异主要是由于分子间的间隔不同
※思路点拨※
分子是保持物质化学性质的最小粒子,不能保持物质的物理性质,故A错。原子是化学变化中最小的粒子,它由原子核和电子构成,所以B错。原子得到电子带负电,失去电子带正电,形成离子,所以C正确。CO2和CO性质的差异是因为分子结构不同,所
以D错。
※解答辨析※
C
※考点点评※
分子、原子、离子的区别与联系。
考点2 下图a是两种元素在元素周期表中的信息,下图b是氟原子的原子结构示意图。
(1)图a方框的横线上填的是 ;图b方框横线上填的数字是 。
(2)请将“元素”、“原子”、“分子”填入图c适当的圆圈内,从而完成元素、原子、分子与物质之间的正确的关系图。
※思路点拨※
图a中两图相比较知道:方框内应是钠元素的元素符号。图b是氧原子的结构示意图,所以方框内的数字应是7。物质是由分子、原子构成的,分子是由原子构成的,物质是由元素组成的。
※解答辨析※
(1)Na 7
(2)
※考点点评※
两种元素在元素周期表中的信息是:方框的左上角是元素序数(即原子的质子数),右上角是元素符号,中间是元素名称,下方是相对原子质量;原子结构示意图中,圆圈内的数字是厚子的质子数,弧线表示电子层,弧线上的数字表示该电子层上的电子数;任何物质都是由分子、原子或离子构成的,分子是由原子构成的,原子得失电子变为离子,物质是由元素组成的。
考点3 下列物质:Si、N2、O2、CH4、H2O2、MgCl2、C2H5OH、C、Ar、Ns2S、Cu、Ca、Ne等,哪些物质是由分子构成的 哪些物质是由原子构成的 哪些物质是由离子构成的
※思路点拨※
分子、原子、离子均可直接构成物质。对于单质由分子或原子直接构成,而化合物要么由分子构成,要么由离子构成。
※解答辨析※
由原子构成的有:Si、C、Ar、Cu、Ca、Ne
由分子构成的有:N2、O2、 CH4、H2O2、C2H5OH
由离子构成的有:MgCl2、Na2S
※考点点评※
(1)在单质中化学式右下角加数字的都是由分子构成的,其他单质化学式直接用元素符号表示的都是由原子构成的。(2)在化合物中化学式出现金属元素符号的一般是由离子构成的,化合物的化学式中全部是非金属元素符号的是出分子构成的(铵盐除外)。
考点4 (1)用化学用语填空。
①碘元素 ②两个银原子
③3个氮分子 ④碱中的阴离子
⑤氧化亚铁中铁元素显+2价
(2)写出下列符号所表示的意义。
①K 5O2
③K+ ④3SO42-
⑤SO4
※思路点拨※
本题考查元素符号及化学式周围不同位置上数字所表示的意义。一般说来,数字在元素符号周围位置不同其意义是不同的。
※解答辨析※
(1)①Ⅰ ②2Ag ③3N2 ④OH- ⑤ (2)(D表示钾元素;l个钾原子;单质钾 ②表示5个氧分子③表示1个钾离子带1个单位正电荷;表示钾离子 ④表示3个硫酸根离子 ⑤表示硫酸钙中钙元素的化合价为+2价
※考点点评※
化学符号(M)周围的数字(n)表示的意义如下: (1)左边:nM:①M为元素符号,一般表示n个M原子;②M为化学式,一般表示n个M分子;③M为离子符号,一般表示n个离子。(2)右上角:①Mn+表示一个M n+带n个单位的正电荷;②Mn-表示一个Mn-带n个单位的负电荷。(3)正上方:①表示M元素在化合物中显+n价;②表示M元素在化合物中显一n价。(4)右下角:Mn表示分子中M原子的个数。此外。单独的一个元素符号或者化学式,既有宏观意义(表示某元素或某物质),又具有微观意义(表示元素的一个原子或物质的一个分子);如果在其前加了一个数字,那就只有微观意义了,不具有宏观意义。
考点5 在氮与氧形成的氧化物中,氮与氧的质量比为7:20,则此氧化物中氮元素的化合价是( )
A +4 B +3
C +5 D +l
※思路点拨※
我们已经知道了氧元素在化合物中的化合价一般为一2价,则氮元素在此化合物中一定显正价,又知在化合物中氮与氧的质量比为7:20,所以只要写出化学式即可求出化合价。设该氧化物的化学式为NxOy,则有l4x:16y=7:20,所以x:y=2:5,即化学式为N2O5,根据化合物中元素正负化合价代数和为零的原则,N显+5价,故选C。
※解答辨析※
C
※考点点评※
当告诉我们化合物中两元素的质量比,无论是让我们求化学式还是求某元素的化合价,都应先设出该化合物的化学式,由元素的质量比列出等式,从而求出元素的原子个数比,便可写出化学式,也就能根据化学式中元素正负化合价的代数和为零推出未知元素的化合价。
聚焦失分点
易错1 下列说法正确的是( )
A质子数相同的粒子,一定是同种元素
B最外层电子数相同的粒子,一定是同一种原子
C不同元素的原子。核内中子数一定不同
D同种元素的原子,质子数一定相同
※对症下药※
用元素的概念和原子结构的相关知识,逐一分析各选项,找出正确的选项。A项:关键词是“粒子”,分子、原子、离子、质子、电子等都可以叫粒子。这样,像CH4、NH3、H2O、HF、Ne这些物质的每个分子里质子数都是l0个,而它们却是不同的物质。只有质子数相同的原子才能属于同一种元素,因此本题容易把“粒子”谩认为是原子,导致判断错误。B项:首先最外层电子数相同的粒子不一定是原子。例如Na+、Mg2+、Al3+、F一、O2-等,最外层电子数相同,但它们是离子,不是同一种原子。再者K和Na及F和Cl等它们的最外层电子数也相同,也不是同种原子。C项:不同元素的原子核内的中子数可能不同也可能相同,区别不同元素的原子,只能根据原子的核电荷数,即核内质子数进行判断,与中子数无关,如常见的钠原子和镁原子,它们的核内中子数都是l2个。D项:同种元素的原子,质子数一定相同。元素的概念是具有相同核电荷数(即质子数)的同一类原子的总称,故同种元素的原子核内质子数一定相同。应抓住概念的实质,去分析各种说法,判断其正误。解概念型的题时,要认真审题,推敲每一句话中的字、词的意思,然后与概念及相关知识点一一对照。故答案选D。
※提分练习※
1 在宏观物质、微观粒子和化学符号之间建立联系,是化学科学特有的思维方式。已知氢、碳、氧、钠、氯五种元素的核电荷数分别为:l、6、8、11、17。试按下列要求,写出微观粒子的化学符号,以及由这种粒子构成的或含有这种粒子的一种物质的名称(微观粒子和物质所涉及的元素限定在上述五种元素内)。
需满足的条件 粒子的化学符号 对应物质的名称
(1)质子数为11的同种元素的原子和离子
(2)质子数均为l0的两种不同的分子
(3)质子数为1的阳离子和质子数为9的阴离子
易错2 达菲是治疗甲型HlNl流感的有效药品之一,其主要制作原料是八角茴香中的莽草酸(C7H10O5)。下列关于莽草酸的说法中,正确的是( )
A莽草酸由碳、氢、氧三个元素组成
B莽草酸由7个碳原子、l0个氢原子、5个氧原子构成
C莽草酸的相对分子质量为174克
D莽草酸中碳、氢、氧元素的质量比为42:5:40
※对症下药※
本题考查化学式的意义。错误主要表现在不能正确表达化学式意义及进行计算。由莽草酸(C7H10O5)化学式可知它由碳、氢、氧三种元素组成,注意元素不能以个数论,因此A选项是错误的;莽草酸是由莽草酸分子构成的;化学式量是一个比值,是没有单位的,因此C选项也是错误的。本题正解为D:莽草酸中碳、氢、氧元素的质量比=(12×7):(1×10):(16×
5)=42:5:40。
※提分练习※
2 陶瓷是传统的无机非金属材料,黏土[主要成分Al2Si2O5(OH)4]是制备陶瓷的原料之一。下列关于Al2Si2O5(OH)4的说法中,正确的是( )
A它由4种元素组成
B其中铝元素的化合价为+3价
C其中氢、氧元素的质量比是4:9
D其中硅元素的质量分数为56%
专项集训
※能力提升※
1 下面是甲、乙两种物质的结构示意图,图中小圆圈均代表碳原子。这两种物质在氧气中完全燃烧后的产物都是二氧化碳,但它们的物理性质却明显不同,如导电性、硬度等。据此,下列说法错误的是( )
A甲、乙两种物质中的碳原子大小相同
B甲、乙两种物质都是碳单质
C甲、乙两种物质中原子的空间排列方式不同
D将甲、乙两种物质混合后得到的是纯净物
2 2010年4月5 日,科学家成功合成了第117号新元素,填补了第116号和ll8号元素之间的空缺。推测该元素为ll7号元素的依据是( )
A中子数 B质子数
C电子数 D中子数和质子数
3 冰岛火山灰曾严重影响欧洲飞机的正常飞行。火山灰是细微的火山碎屑物,它质地坚硬、不溶于水,含有硫、钙、硅、氧及重金属等成分。这里所说的成分是指( )
A元素 B 原子
C 分子 D单质
4 用“ ”表示氢原子、“●”表示氧原子。下列方框中,符合“2H2O”所表示意义的是( )
5 下列物质的名称、化学式和所属的类别都正确的是( )
A甲烷、CH4、有机物
B锰、MN、金属单质
C氯酸钾、KClO3、金属氧化物
D氧化汞、HgO、非金属氧化物
6 铌酸锂(LiNbO3)晶体是目前用途最广泛的新型无机材料之一。下列关于铌酸锂说法正确的是( )
A铌酸锂是一种氧化物
B铌酸锂是由五个原子构成的
C铌酸锂是由铌、锂、氧三种元素组成的
D铌酸锂中铌、锂、氧元素的质量比为93:7:16
7 如图为某物质的分子模型示意图,其中“ ”代表氢原
子,“●”代表氧原子。下列叙述正确的是( )
A此物质属于混合物
B此物质的化学式中氧元素的化合价为一2价
C此物质的一个分子由4个原子构成
D此物质中氢元素与氧元素的质量比是l:1
8 随着分子、原子研究技术的提高,科学家可以利用原子来“组装”分子。若用这种技术组装成脱氧核糖分子(C5H10O4),则该分子中不含有的原子是( )
A氯原子 B碳原子
C氧原子 D氢原子
9 中科院的全超导的“人造太阳”——托克马克核聚变试验装置的调试运行成功,使我国在该领域的研究处于世界前列。氘和氚是核聚变的原料(氘、氚原子核内都只有l个质子,但含不同数目的中子),聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是( )
A核聚变是化学变化
B氘原子和氚原子属于不同元素
C氘原子和氚原子是氢的两种同位素
D氘原子和氚原子的相对原子质量相同
10 右图是元素周期表中的一格,依据图中的信息得到的下列认
识错误的是( )
A该元素原子的质子数为l4
B该元素属于非金属元索
C该元素一个原子的原子核外有14个电子
D该元素的相对原子质量为28.09克
11 参考下列物质的微观结构图示,其中由阴、阳离子构成的物质是( )
12 物质的结构决定物质的性质,下列关于物质结构与性质的说法不正确的是( )
A生铁和钢的性质不同,是由于含碳量不同
B金属钠和镁的性质不同,是由于钠和镁的原子结构不同
C金刚石和石墨的物理性质不同,是由于碳原子的排列方式不同
D CO和CO2的性质不同,是由于CO2比CO中的氧原子多
13 下列图示的各物质(或元素)相对含量错误的是( )
14 不少小学生喜食油炸薯条。但是,油炸薯条易产生一种叫丙烯酰胺的致癌物,长期摄入易引发多种疾病,其结构为:
。据此,不能推断出丙烯酰胺的( )
A组成元素 B密度、状态
C化学式 D相对分子质量
15 下图为元素周期表第三周期的局部。据此判断下列说法中正确的是( )
11 Na23.00 12 Mg24.31 13 A126.98 14 Si28.09
A它们都属于金属元素
B 1个铝原子的质量是26.98g
C硅元素的原子序数为l4
D镁元素的相对原子质量为l2
16 食醋是厨房中的一种谪昧品,其中含有少量醋酸。下列有关醋酸的说法不正确的是( )
A醋酸分子是由碳、氢、氧三种原子构成的
B醋酸中碳元素的质量分数为40%
C醋酸分子是由碳、氢、氧三种元素组成的
D每个醋酸分子中有8个原子核
17 自2010年4月1日开始,我国对酒后驾驶进行了专项整治。交警用装有重铬酸钾(K2Cr2O7)的检测仪,来检测司机是否洒后驾车。其原理是红色的重铬酸钾遇酒精后生成蓝绿色的物质。下列说法不正确的是( )
A重铬酸钾是由三种元素组成的
B该变化是化学变化
C重铬酸钾的相对分子质世是294
D组成重铬酸钾的各元素个数比为2:2:7
18 化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A从性质上看:丁烷具有可燃性
B 从变化上看:丁烷完全燃烧只生成水
C从组成上看:丁烷由碳、氢两种元素组成
D从结构上看:一个丁烷分子由4个碳原子、10个氯原子构成
19 建立一个适当的模型来反映和代替客观现象。可以更简单明了地表示事物。
(1)甲图是人体中元素质量分数模型,则A代表的一种元素是 。
(2)小明模仿甲图构建了NH4NO3中各元素质量分数的模型(如乙图),则乙图中表示氯元素的是 。
20 从H、C、O、Na、S、Cl、Ca、N八种元素中,选择适当的元素组合填空,写出符合下列要求的化学式(每空各写一个):
(1)最简单的有机物是 。
(2)含有四种元素的化合物是 。
(3)溶于水后溶液呈碱性的气体是 。
(4)可用作氮肥的是 。
21 现有H,C、O、S、Cu五种元素,请选用其中的元素写出符合下列要求的物质各一个(用化学式表示):
(1)用于制造电线电缆的是 。
(2)天然气的主要成分是 。
(3)会形成酸雨的气体是 。
(4)中学化学实验室中最常用的溶剂是 。
(5)能溶于水形成蓝色溶液的盐是 。
22 铝土矿的主要成分是氧化铝(A12O3),在氧化铝中铝元素与氧元素的质量之比是 。170吨含氧化铝80%的铝土矿,理论上可炼出金属铝 吨。
23 过氧乙酸(化学式为C2H4O3)常用作消毒剂。计算(本题只要求写出计算结果):
(1)过氧乙酸中碳、氢、氧三种元素的质量比。
(2)过氧乙酸中氧元素的质量分数。
24 下列各组物质中,带点的同种元素的化合价相同的是( )
A Cl2、NaCl B NH4Cl、HNO3
C MnO2、K2MnO4 D P2O5、Ca3(PO4)2
25 科学家发现.从红豆杉中提取的紫杉醇(C,H47H51NO14)是一种抗癌新药;l994年之后,科学家在实验室里人工合成了紫杉醇。似如人工合成的紫杉醇与天然紫杉醇的成分和结构完全相同,你认为使用天然紫杉醇的疗效是否比人工合成的紫杉醇更好 (填“是”或“不是”)。据此计算紫杉醇中的碳、氢、氮、氧元素的质量比是 。
26 按要求用相应的化学符号填空。
(1)酒精 。
(2)两个氢离子 。
(3)地壳中含量最多的元素 。
(4)写出五氧化二磷的化学式.并标出其中磷元素的化合价 。
27 自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用下图表示:(“ ”表示氧原子,“ ”表示氢原于,“ ”表示氯原子)
(1)上述图中所出现的物质中,共有 种含有氧元素的化合物。
(2)从图中我们可知,在化学反应中,反应前后 个数不变。
(3)上述两个化学反应是否都属于四种基本反应类型 。(填“是”或“否”)
※冲击高分※
1 兰州某大型洗衣店的废水经沉淀后直接排放到黄河中,在人河口水中藻类等浮游生物大量繁殖,水呈绿色。
(1)造成这种现象的原因可能是洗衣店排放的废水中含较多的 元素。
(2)资料显示河水中的藻类的化学式为CxHyO110N16P。计算藻类中氮、氧元素的质量比为
。
(3)已知该藻类相对分子质量为3 550,碳元素的质量分数为35.8%。计算其中x的近似值。(请写出计算过程)
2 微粒模型观察与比较。如下图所示,在钠与氯气的反应中,每个钠原子失去l个电子,成为l个钠离子;每个氯原子得到l个电子,成为l个氯离子;钠离子与氯离子结合形成氯化钠。因为1个电子的质量大约为l个质子或中子质量的1/1836,故原子的质量几乎都集中在原子核上。
若用r、m分别表示微粒的半径和质量,用“<”、“>”或“≈”填空。
(1)m(Na) m(Na+)。
(2)r(Cl) r(C1-)。
(3)r(Na) r(Cl)。
(4)r(Na+) r(C1-)。
3 下表是国家对“饮酒驾车”和“醉酒驾车”的界定标准:
饮酒驾车 20毫克/100毫升≤ 血液中的酒精含量<80毫克/100毫升
醉酒驾车 血液中的酒精含量≥80毫克/100毫升
白酒、红酒和啤酒中均含有乙醇(俗称酒精,化学式为C2H5OH),饮酒后酒精可进入人体血液中。请回答下列问题:
(1)乙醇(C2H5OH)中碳、氢、氧元素的质量比是C:H:O= 。
(2)饮酒会使人的 系统过度兴奋或麻痹抑制,容易引发交通事故。某人饮酒后驾车,被交警发现,经测定其每100毫升血液中酒精含量为93毫克,属于 驾车。
(3)在治理酒后驾车中,酒精检测仪发挥了重要作用。如图甲是酒精检测仪,图乙是检测仪的简化电路图,R0为定值电阻,R为气敏电阻,该电阻阻值与酒精气体含量的关系如图丙,如果图乙中电流表示数越大,说明司机吹出的气体中酒精含量就 。
4 某甲醛溶液中氢元素的质量分数为10%,则碳元素的质量分数为多少 (甲醛的化学式为HCHO)
答案
提分练习
1
粒子的化学符号 对应物质的名称
Na 金属钠
Na+ 氯化钠(氢氧化钠等)
H2O 水
CH4(HF、NH3) 甲烷(氟化氢、氨气等)
H+ 盐酸(硫酸)
OH-(F-) 氢氧化钠(氟化氢)
2 AB
专项集训
能力提升
1 D 2 B 3 A 4 D 5 A 6 C 7 C 8 A 9 C 10 D 11C l2 D 13 A 14B l5 C 16 C 17 D 18 B
19 (1)氧 (2)B
20 (1)CH4 (2)NaHCO3[或Ca(HCO3)2]等合理即可 (3)NH3
(4)NH4HCO3、CO(NH2)2、NH4Cl、NH4NO3、(NH4)2SO4均可
21 (1)Cu (2)CH4 (3)SO2 (4)H2O (5)CuSO4
22 9:8 72
23 (1)6:1:12 (2)63.2% 24 D 25不是 564:51:14:224
26 (1)C2H5OH(或CH2CH2OH或C2H6O) (2)2H+ (3)O (4)
27 (1)两 (2)原子 (3)否
冲击高分
1 (1)P (2)N:O=7:55 (3)3.550×35.8%÷12≈106
2 (1) ≈ (2)< (3)> (4)<
3 (1)12:3:8 (2)中枢神经(或神经)醉酒 (3)越大
4 HCHO可写作C(H2O),可虚拟由HCHO和H2O构成的溶液的化学式为Cm(H2O)n
H%=l0% 则H2O%=H%× =90%
所以C%=1-H2O%=1-90%=10%
答:碳元素的质量分数为10%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网 www.21cnjy.com 精品资料·第 16 页 (共 16 页) 版权所有@21世纪教育网
同课章节目录
