『备考2021』 三年高考真题分类精编解析06 元素及其化合物性质、制备及应用(含解析)
文档属性
| 名称 | 『备考2021』 三年高考真题分类精编解析06 元素及其化合物性质、制备及应用(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 660.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-16 14:51:42 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
专题06 元素及其化合物性质、制备及应用
1. [2020·新课标Ⅰ]铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是
A. CH3COI是反应中间体
B. 甲醇羰基化反应为CH3OH+CO=CH3CO2H
C. 反应过程中Rh成键数目保持不变
D. 存在反应CH3OH+HI=CH3I+H2O
【答案】C
【解析】
A.通过分析可知,CH3COI属于甲醇羰基化反应的反应中间体;其可与水作用,生成最终产物乙酸的同时,也可以生成使甲醇转化为CH3I的HI,A项正确;
B.通过分析可知,甲醇羰基化反应,反应物为甲醇以及CO,产物为乙酸,方程式可写成:,B项正确;
C.通过分析可知,铑配合物在整个反应历程中,成键数目,配体种类等均发生了变化,C项不正确;
D.通过分析可知,反应中间体CH3COI与水作用生成的HI可以使甲醇转化为CH3I,方程式可写成:,D项正确;
答案选C。
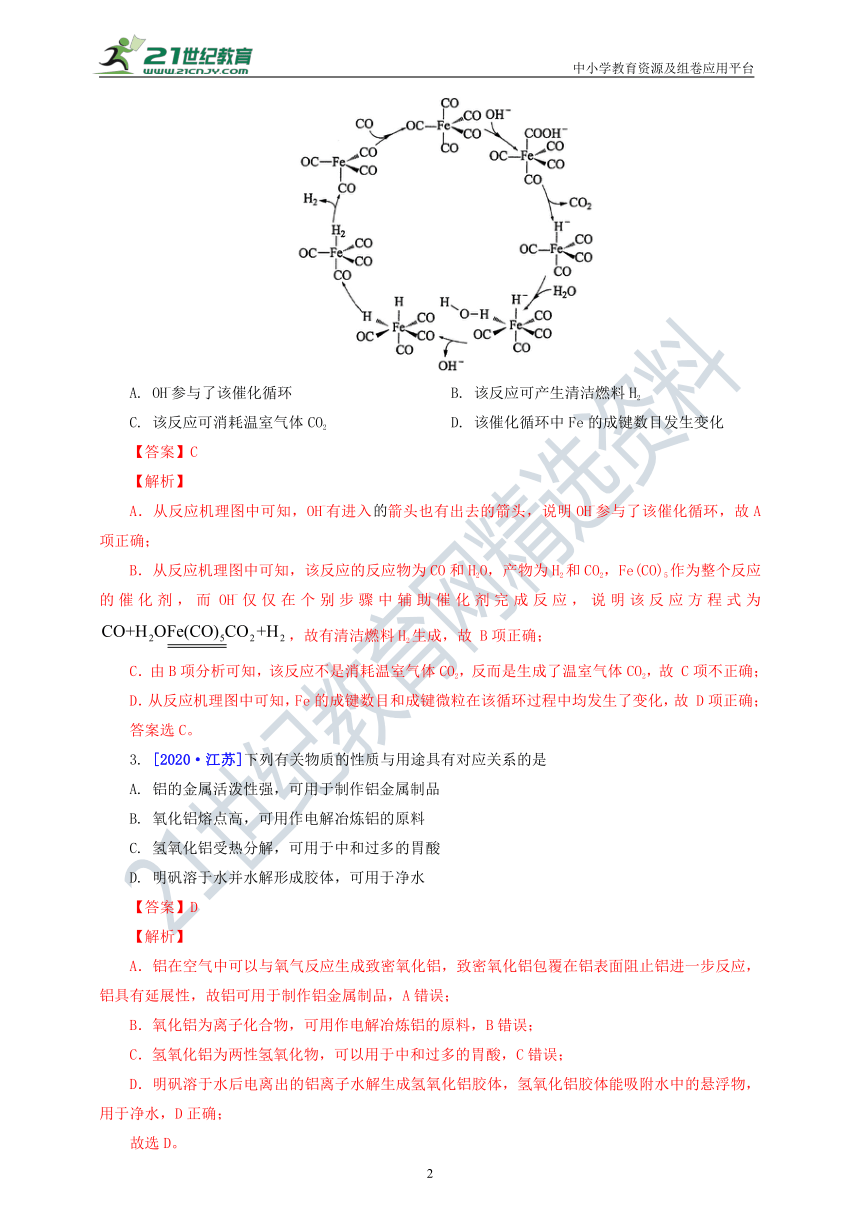
2. [2020·新课标Ⅱ]据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是
A. OH-参与了该催化循环 B. 该反应可产生清洁燃料H2
C. 该反应可消耗温室气体CO2 D. 该催化循环中Fe的成键数目发生变化
【答案】C
【解析】
A.从反应机理图中可知,OH-有进入箭头也有出去的箭头,说明OH-参与了该催化循环,故A项正确;
B.从反应机理图中可知,该反应的反应物为CO和H2O,产物为H2和CO2,Fe(CO)5作为整个反应的催化剂,而OH-仅仅在个别步骤中辅助催化剂完成反应,说明该反应方程式为,故有清洁燃料H2生成,故 B项正确;
C.由B项分析可知,该反应不是消耗温室气体CO2,反而是生成了温室气体CO2,故 C项不正确;
D.从反应机理图中可知,Fe的成键数目和成键微粒在该循环过程中均发生了变化,故 D项正确;
答案选C。
3. [2020·江苏]下列有关物质的性质与用途具有对应关系的是
A. 铝的金属活泼性强,可用于制作铝金属制品
B. 氧化铝熔点高,可用作电解冶炼铝的原料
C. 氢氧化铝受热分解,可用于中和过多的胃酸
D. 明矾溶于水并水解形成胶体,可用于净水
【答案】D
【解析】
A.铝在空气中可以与氧气反应生成致密氧化铝,致密氧化铝包覆在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A错误;
B.氧化铝为离子化合物,可用作电解冶炼铝的原料,B错误;
C.氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C错误;
D.明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,用于净水,D正确;
故选D。
4. [2020·江苏]下列有关化学反应叙述正确的是
A. 室温下,Na在空气中反应生成Na2O2
B. 室温下,Al与4.0 mol﹒L-1NaOH溶液反应生成NaAlO2
C. 室温下,Cu与浓HNO3反应放出NO气体
D. 室温下,Fe与浓H2SO4反应生成FeSO4
【答案】B
【解析】
A.室温下,钠与空气中氧气反应生成氧化钠,故A错误;
B.室温下,铝与NaOH溶液反应生成偏铝酸钠和氢气,故B正确;
C.室温下,铜与浓硝酸反应生成二氧化氮气体,故C错误;
D.室温下,铁在浓硫酸中发生钝化,故D错误。
综上所述,答案为B。
5. [2020·江苏]下列选项所示的物质间转化均能实现的是
A. (aq)(g)漂白粉(s)
B. (aq)(s)(s)
C. (aq)(aq)(aq)
D. (s)(aq)(s)
【答案】C
【解析】
A.石灰水中Ca(OH)2浓度太小,一般用氯气和石灰乳反应制取漂白粉,故A错误;
B.碳酸的酸性弱于盐酸,所以二氧化碳与氯化钠溶液不反应,故B错误;
C.氧化性Cl2>Br2>I2,所以氯气可以氧化NaBr得到溴单质,溴单质可以氧化碘化钠得到碘单质,故C正确;
D.电解氯化镁溶液无法得到镁单质,阳极氯离子放电生成氯气,阴极水电离出的氢离子放电产生氢气,同时产生大量氢氧根,与镁离子产生沉淀,故D错误。
综上所述,答案为C。
6.[2020·浙江7月选考,9]下列说法不正确的是( )
A. 高压钠灯可用于道路照明
B. 可用来制造光导纤维
C. 工业上可采用高温冶炼黄铜矿的方法获得粗铜
D. 不溶于水,可用作医疗上检查肠胃的钡餐
【答案】D
【解析】
A.高压钠灯发出的黄光射程远、透雾能力强,所以高压钠灯用于道路照明,故A正确;
B.二氧化硅传导光的能力非常强,用来制造光导纤维,故B正确;
C.黄铜矿高温煅烧生成粗铜、氧化亚铁和二氧化硫,故C正确;
D.碳酸钡不溶于水,但溶于酸,碳酸钡在胃酸中溶解生成的钡离子为重金属离子,有毒,不能用于钡餐,钡餐用硫酸钡,故D错误;答案选D。
7.[2020·浙江7月选考,12]下列说法正确的是( )
A. 在空气中加热可得固体
B. 加入到过量溶液中可得
C. 在沸腾炉中与反应主要生成
D. 溶液中加入少量粉末生成和
【答案】A
【解析】
A.无水状态下Na2O2比Na2O更稳定,Na2O在空气中加热可以生成更稳定的Na2O2,A正确;
B.Mg加入到FeCl3溶液中,Mg具有较强的还原性,先与Fe3+反应,生成Mg2+和Fe2+,若Mg过量,Mg与Fe2+继续反应生成Mg2+和Fe,但由于反应中FeCl3过量,Mg已消耗完,所以无Mg和Fe2+反应,所以不会生成Fe,B错误;
C.FeS2在沸腾炉中与O2发生的反应为:4 FeS2+11O22Fe2O3+8SO2,产物主要是SO2而不是SO3,C错误;
D.H2O2溶液中加入少量MnO2粉末生成H2O和O2,化学方程式为:2H2O22H2O+O2↑,D错误。
故仅A选项符合题意。
8. [2020·浙江7月选考,24]是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
A. 可发生反应:
B. 具有吸水性,需要密封保存
C. 能与,反应生成新盐
D. 与足量盐酸作用,所得固体产物主要为
【答案】D
【解析】
A.Ca3SiO5与NH4Cl反应的方程式为:Ca3SiO5+4NH4Cl CaSiO3+2CaCl2+4NH3↑+2H2O,A正确;
B.CaO能与水反应,所以需要密封保存,B正确;
C.亚硫酸的酸性比硅酸强,当二氧化硫通入到Ca3SiO5溶液时,发生反应:3SO2+H2O+ Ca3SiO5=3 CaSO3+H2SiO3,C正确;
D.盐酸的酸性比硅酸强,当盐酸与Ca3SiO5反应时,发生反应:6HCl+ Ca3SiO5=3CaCl2+H2SiO3+2H2O,D不正确;故仅D选项符合题意。
9. [2020·浙江1月选考,8]下列说法不正确的是( )
A.二氧化硅导电能力强,可用于制造光导纤维
B.石灰石在高温下可用于消除燃煤烟气中的SO2
C.钠着火不能用泡沫灭火器灭火
D.利用催化剂可减少汽车尾气中有害气体的排放
【答案】A
【解析】A.二氧化硅为绝缘体,不导电,故A项错误;B.石灰石在高温下分解为生石灰,生石灰与煤燃烧生成的SO2结合生成亚硫酸钙,CaSO3再与O2反应转化为CaSO4,从而实现了燃煤脱硫,故B项正确;C.钠着火时生成过氧化钠,过氧化钠与二氧化碳反应产生氧气,因此不能用泡沫灭火器灭火,故C项正确;D.在汽车尾气处理系统中利用催化剂,可降低尾气中CO、NOx等有害气体的排放,故D项正确。答案选A。
10. [2020·浙江1月选考,9]下列说法不正确的是
A. [Cu(NH3)4]SO4可通过CuSO4溶液与过量氨水作用得到
B. 铁锈的主要成分可表示为Fe2O3·nH2O
C. 钙单质可以从TiCl4中置换出Ti
D. 可用H2还原MgO制备单质Mg
【答案】D
【解析】A项、CuSO4溶液与少量氨水反应生成氢氧化铜沉淀,与过量氨水反应生成络合物[Cu(NH3)4]SO4,故A正确;B项、铁在潮湿空气中发生吸氧腐蚀生成红棕色的铁锈,铁锈的主要成分可表示为Fe2O3·nH2O,故B正确;C项、钙的化学性质活泼,在稀有气体的保护下,与熔融的四氯化钛反应可置换出Ti,故C正确;D项、制备单质Mg应该用电解熔融MgCl2的方法,故D错误;故选D。
11. [2020·浙江1月选考,12]下列关于铝及其化合物说法,不正确的是( )
A. 明矾可用作净水剂和消毒剂 B. 利用铝热反应可冶炼高熔点金属
C. 铝可用作包装材料和建筑材料 D. 氢氧化铝可用作治疗胃酸过多的药物
【答案】A
【解析】A.明矾溶于水可生成具有吸附性的氢氧化铝胶体,可以净水但不能消毒,故A错误;B.铝热反应是金属铝和沸点较高的金属氧化物之间反应冶炼高熔点金属的过程,故B正确。C.铝具有良好的延展性,铝箔可以做包装材料,铝合金硬度大密度小常用做建筑材料,故C正确;D.胃酸主要成分为HCl,氢氧化铝具有弱碱性可中和过多胃酸,故D正确;故答案为A。
12. [2020·浙江1月选考,24]100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是
A. 焦硫酸具有强氧化性
B. Na2S2O7水溶液呈中性
C. Na2S2O7可与碱性氧化物反应生成新盐
D. 100%硫酸吸收SO3生成焦硫酸的变化是化学变化
【答案】B
【解析】A项、从组成上看,焦硫酸是由等物质的量的三氧化硫与纯硫酸化合而成的,则焦硫酸具有比浓硫酸更强的氧化性、吸水性和腐蚀性,故A正确;B项、从组成上看,Na2S2O7可以形成Na2SO4·SO3,Na2SO4·SO3溶于水时,三氧化硫与水反应生成硫酸,水溶液显酸性,故B错误;C项、从组成上看,Na2S2O7可以形成Na2SO4·SO3,三氧化硫可与碱性氧化物反应生成硫酸钠,故C正确;D项、100%硫酸吸收SO3生成焦硫酸有新物质生成,属于化学变化,故D正确;故选B。
13. [2019·新课标Ⅰ] 固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10?3 mol·L?1(设冰的密度为0.9 g·cm?3)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HClH++Cl?
【答案】D
【解析】
【分析】由示意图可知,在冰的表面第一层主要为氯化氢的吸附,第二层中氯化氢溶于水中并发生部分电离,第三层主要是冰,与氯化氢的吸附和溶解无关。
【详解】A项、由图可知,冰的表面第一层主要为氯化氢的吸附,氯化氢以分子形式存在,故A正确;
B项、由题给数据可知,冰的表面第二层中氯离子和水的个数比为10—4:1,第二层中溶解的氯化氢分子应少于第一层吸附的氯化氢分子数,与水的质量相比,可忽略其中溶解的氯化氢的质量。设水的物质的量为1mol,则所得溶液质量为18g/mol×1mol=18g,则溶液的体积为×10—3L/ml=2.0×10—2L,由第二层氯离子和水个数比可知,溶液中氢离子物质的量等于氯离子物质的量,为10—4mol,则氢离子浓度为=5×10—3mol/L,故B正确;
C项、由图可知,第三层主要是冰,与氯化氢的吸附和溶解无关,冰的氢键网络结构保持不变,故C正确;
D项、由图可知,只有第二层存在氯化氢的电离平衡HClH++Cl—,而第一层和第三层均不存在,故D错误。
故选D。
14.[2019·江苏]下列有关物质的性质与用途具有对应关系的是
A.NH4HCO3受热易分解,可用作化肥
B.稀硫酸具有酸性,可用于除去铁锈
C.SO2具有氧化性,可用于纸浆漂白
D.Al2O3具有两性,可用于电解冶炼铝
【答案】B
【解析】A.NH4HCO3受热易分解和用作化肥无关,可以用作化肥是因为含有氮元素;
B.铁锈的主要成分为Fe2O3,硫酸具有酸性可以和金属氧化物反应,具有对应关系;
C.二氧化硫的漂白原理是二氧化硫与有色物质化合成不稳定的无色物质,不涉及氧化还原,故和二氧化硫的氧化性无关;
D.电解冶炼铝,只能说明熔融氧化铝能导电,是离子晶体,无法说明是否具有两性,和酸、碱都反应可以体现 Al2O3具有两性。
故选B。
15.[2019·江苏] 下列有关化学反应的叙述正确的是
A.Fe在稀硝酸中发生钝化 B.MnO2和稀盐酸反应制取Cl2
C.SO2与过量氨水反应生成(NH4)2SO3 D.室温下Na与空气中O2反应制取Na2O2
【答案】C
【解析】
A.常温下,Fe在与浓硝酸发生钝化反应,故A错误;
B.二氧化锰与浓盐酸在加热条件下反应制取氯气,故B错误;
C.二氧化硫与过量氨水反应生成硫酸铵,故C正确;
D.常温下,Na与空气中的氧气反应生成Na2O;加热条件下,钠与氧气反应生成Na2O2,故D错误;综上所述,本题应选C。
16.[2019·江苏] 在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq)Cl2(g)FeCl2(s)
B.MgCl2(aq)Mg(OH)2(s)MgO (s)
C.S(s)SO3(g)H2SO4(aq)
D.N2(g)NH3(g)Na2CO3(s)
【答案】B
【解析】
A.氯气的氧化性强,与铁单质反应直接生成氯化铁,故A错误;
B.氯化镁与石灰乳发生复分解反应生成氢氧化镁,氢氧化镁高温煅烧生成氧化镁和水,故B正确;
C.硫单质在空气中燃烧只能生成SO2,SO2在与氧气在催化剂条件下生成SO3,故C错误;
D.氨气与二氧化碳和氯化钠溶液反应生成碳酸氢钠,碳酸氢钠受热分解可生成碳酸钠,故D错误;综上所述,本题应选B。
17.[2019·天津] 下列有关金属及其化合物的应用不合理的是
A.将废铁屑加入溶液中,可用于除去工业废气中的
B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C.盐碱地(含较多等)不利于作物生长,可施加熟石灰进行改良
D.无水呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
【答案】C
【解析】
A、铁和亚铁能将氯气还原为氯离子,从而除去工业废气中的氯气,故A不选;
B、根据铝合金的性质,铝合金具有密度低、强度高,故可应用于航空航天等工业,故B不选;
C、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,产物仍然呈碱性,不能改变土壤的碱性,反而使土壤更板结,故C选;
D、利用无水氯化钴和氯化钴晶体的颜色不同,故可根据颜色判断硅胶中是否能吸水,故D不选。
故选C。
18.[2019·浙江4月选考]下列说法不正确的是
A.液氯可以储存在钢瓶中
B.天然气的主要成分是甲烷的水合物
C.天然石英和水晶的主要成分都是二氧化硅
D.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
【答案】B
【解析】A.液氯就是液态的氯气,与钢瓶不反应,可以储存在钢瓶中,A项正确;
B.天然气的主要成分是甲烷,可燃冰的主要成分是甲烷的水合物,B项错误;
C.石英、水晶、硅石、沙子的主要成分均为二氧化硅,C项正确;
D.硫在地壳中主要以硫化物、硫酸盐等形式存在,火山口处有硫单质,D项正确。
故答案选B。
19.[2019·浙江4月选考] 18.下列说法不正确的是
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
【答案】C
【解析】A.烧碱和纯碱均属于离子化合物,熔化时须克服离子键,A项正确;
B.加热蒸发氯化钾水溶液,液态水变为气态水,水分子之间的分子间作用力被破坏,B项正确;
C.CO2溶于水发生反应:CO2+H2O?H2CO3,这里有化学键的断裂和生成,C项错误;
D.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,D项正确。故答案选C。
20.[2018·新课标Ⅰ卷]磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
【答案】D
【解析】
A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;
B、根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;
C、得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;
D、硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。答案选D。
21.[2018·新课标Ⅱ卷]研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
【答案】C
【解析】
A.雾的分散剂是空气,分散质是水。霾的分散剂是空气,分散质固体颗粒。因此雾和霾的分散剂相同,A正确;
B.由于氮氧化物和二氧化硫转化为铵盐形成无机颗粒物,因此雾霾中含有硝酸铵和硫酸铵,B正确;
C.NH3作为反应物参加反应转化为铵盐,因此氨气不是形成无机颗粒物的催化剂,C错误;
D.氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关,由于氮肥会释放出氨气,因此雾霾的形成与过度施用氮肥有关,D正确。答案选C。
22.[2018·海南卷]絮凝剂有助于去除工业和生活废水中的悬浮物。下列物质可作为絮凝剂的是
A.NaFe(SO4)2·6H2O B.CaSO4·2H2O
C.Pb(CH3COO)2·3H2O D.KAl(SO4)2·12H2O
【答案】AD
【解析】由题意知,絮凝剂有助于去除工业和生活废水中的悬浮物,因此,絮凝剂本身或与水生成的产物具有吸附性。A.铁离子能水解生成氢氧化铁胶体可吸附悬浮物,符合题意;
B.硫酸钙本身是微溶物,没有吸附作用,不符合题意;
C.醋酸铅没有吸附性,不符合题意;
D.明矾可净水,其原理是铝离子水解生成氢氧化铝胶体,可吸附悬浮物,符合题意;
故答案为AD。
23.[2018·江苏卷]在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
【答案】A
【解析】A项,NaHCO3受热分解成Na2CO3、CO2和H2O,Na2CO3与饱和石灰水反应生成CaCO3和NaOH,两步反应均能实现;B项,Al与NaOH溶液反应生成NaAlO2和H2,NaAlO2与过量盐酸反应生成NaCl、AlCl3和H2O,第二步反应不能实现;C项,AgNO3中加入氨水可获得银氨溶液,蔗糖中不含醛基,蔗糖不能发生银镜反应,第二步反应不能实现;D项,Al与Fe2O3高温发生铝热反应生成Al2O3和Fe,Fe与HCl反应生成FeCl2和H2,第二步反应不能实现;物质间转化均能实现的是A项,答案选A。
点睛:本题考查元素及其化合物之间的相互转化和反应条件,解题的关键是熟悉常见物质的化学性质和转化的条件。注意量的多少对生成物的影响,如NaAlO2与少量HCl反应生成NaCl和Al(OH)3,NaAlO2与过量HCl反应生成NaCl、AlCl3和H2O。
24.[2018·浙江11月选考]下列说法不正确的是
A.电解熔融氯化镁可制取金属镁
B.电解饱和食盐水可制取氯气
C.生产普通玻璃的主要原料为石灰石、纯碱和晶体硅
D.接触法制硫酸的硫元素主要来源于硫黄或含硫矿石
【答案】C
【解析】A、制取金属镁时,由于镁的活泼性很强,故一般电解熔融的氯化镁制取金属镁,选项A正确;B、电解饱和食盐水生成氢氧化钠、氢气和氯气,可制取氯气,选项B正确;C、生产普通玻璃的主要原料为石灰石、纯碱和石英,选项C不正确;D、接触法制硫酸的硫元素主要来源于硫黄或含硫矿石,硫与氧气反应生成二氧化硫或煅烧硫铁矿生成二氧化硫,选项D正确。答案选C。
25. [2018·浙江4月选考,6]下列说法不正确的是
A. 纯碱可用于去除物品表面的油污
B. 二氧化碳可用作镁燃烧的灭火剂
C. 植物秸秆可用于制造酒精
D. 氢氧化铁胶体可用作净水剂
【答案】B
【解析】A项,纯碱水溶液呈碱性,油脂在碱溶液中水解生成溶于水的物质,可用于去除物品表面的油污,故A项正确;B项,镁可以与二氧化碳发生反应,二氧化碳不能作为镁的灭火剂,故B项错误;C项,纤维素能够水解变成葡萄糖,葡萄糖在某些酶的作用下可以转化为乙醇,故C项正确;D项,氢氧化铁的胶体具有吸附性,能够吸附水中固体杂质颗粒,可以作为净水剂,故D项正确。
26. [2018·浙江4月选考,9]下列反应中能产生二氧化硫的是
A. 氧化铜和稀硫酸反应 B. 亚硫酸钠和氧气反应
C. 三氧化硫和水反应 D. 铜和热的浓硫酸反应
【答案】D
【解析】A项,生成物为硫酸铜和水,不产生二氧化硫,故不选A;B项,亚硫酸钠和氧气反应生成硫酸钠,该反应不产生二氧化硫,故不选B;C项,三氧化硫和水反应生成硫酸,反应中无法产生二氧化硫,故不选C;D项,Cu与浓硫酸反应生成二氧化硫、水和硫酸铜,故选D。综上所述,本题正确选项为D。
12
专题06 元素及其化合物性质、制备及应用
1. [2020·新课标Ⅰ]铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是
A. CH3COI是反应中间体
B. 甲醇羰基化反应为CH3OH+CO=CH3CO2H
C. 反应过程中Rh成键数目保持不变
D. 存在反应CH3OH+HI=CH3I+H2O
【答案】C
【解析】
A.通过分析可知,CH3COI属于甲醇羰基化反应的反应中间体;其可与水作用,生成最终产物乙酸的同时,也可以生成使甲醇转化为CH3I的HI,A项正确;
B.通过分析可知,甲醇羰基化反应,反应物为甲醇以及CO,产物为乙酸,方程式可写成:,B项正确;
C.通过分析可知,铑配合物在整个反应历程中,成键数目,配体种类等均发生了变化,C项不正确;
D.通过分析可知,反应中间体CH3COI与水作用生成的HI可以使甲醇转化为CH3I,方程式可写成:,D项正确;
答案选C。
2. [2020·新课标Ⅱ]据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是
A. OH-参与了该催化循环 B. 该反应可产生清洁燃料H2
C. 该反应可消耗温室气体CO2 D. 该催化循环中Fe的成键数目发生变化
【答案】C
【解析】
A.从反应机理图中可知,OH-有进入箭头也有出去的箭头,说明OH-参与了该催化循环,故A项正确;
B.从反应机理图中可知,该反应的反应物为CO和H2O,产物为H2和CO2,Fe(CO)5作为整个反应的催化剂,而OH-仅仅在个别步骤中辅助催化剂完成反应,说明该反应方程式为,故有清洁燃料H2生成,故 B项正确;
C.由B项分析可知,该反应不是消耗温室气体CO2,反而是生成了温室气体CO2,故 C项不正确;
D.从反应机理图中可知,Fe的成键数目和成键微粒在该循环过程中均发生了变化,故 D项正确;
答案选C。
3. [2020·江苏]下列有关物质的性质与用途具有对应关系的是
A. 铝的金属活泼性强,可用于制作铝金属制品
B. 氧化铝熔点高,可用作电解冶炼铝的原料
C. 氢氧化铝受热分解,可用于中和过多的胃酸
D. 明矾溶于水并水解形成胶体,可用于净水
【答案】D
【解析】
A.铝在空气中可以与氧气反应生成致密氧化铝,致密氧化铝包覆在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A错误;
B.氧化铝为离子化合物,可用作电解冶炼铝的原料,B错误;
C.氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C错误;
D.明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,用于净水,D正确;
故选D。
4. [2020·江苏]下列有关化学反应叙述正确的是
A. 室温下,Na在空气中反应生成Na2O2
B. 室温下,Al与4.0 mol﹒L-1NaOH溶液反应生成NaAlO2
C. 室温下,Cu与浓HNO3反应放出NO气体
D. 室温下,Fe与浓H2SO4反应生成FeSO4
【答案】B
【解析】
A.室温下,钠与空气中氧气反应生成氧化钠,故A错误;
B.室温下,铝与NaOH溶液反应生成偏铝酸钠和氢气,故B正确;
C.室温下,铜与浓硝酸反应生成二氧化氮气体,故C错误;
D.室温下,铁在浓硫酸中发生钝化,故D错误。
综上所述,答案为B。
5. [2020·江苏]下列选项所示的物质间转化均能实现的是
A. (aq)(g)漂白粉(s)
B. (aq)(s)(s)
C. (aq)(aq)(aq)
D. (s)(aq)(s)
【答案】C
【解析】
A.石灰水中Ca(OH)2浓度太小,一般用氯气和石灰乳反应制取漂白粉,故A错误;
B.碳酸的酸性弱于盐酸,所以二氧化碳与氯化钠溶液不反应,故B错误;
C.氧化性Cl2>Br2>I2,所以氯气可以氧化NaBr得到溴单质,溴单质可以氧化碘化钠得到碘单质,故C正确;
D.电解氯化镁溶液无法得到镁单质,阳极氯离子放电生成氯气,阴极水电离出的氢离子放电产生氢气,同时产生大量氢氧根,与镁离子产生沉淀,故D错误。
综上所述,答案为C。
6.[2020·浙江7月选考,9]下列说法不正确的是( )
A. 高压钠灯可用于道路照明
B. 可用来制造光导纤维
C. 工业上可采用高温冶炼黄铜矿的方法获得粗铜
D. 不溶于水,可用作医疗上检查肠胃的钡餐
【答案】D
【解析】
A.高压钠灯发出的黄光射程远、透雾能力强,所以高压钠灯用于道路照明,故A正确;
B.二氧化硅传导光的能力非常强,用来制造光导纤维,故B正确;
C.黄铜矿高温煅烧生成粗铜、氧化亚铁和二氧化硫,故C正确;
D.碳酸钡不溶于水,但溶于酸,碳酸钡在胃酸中溶解生成的钡离子为重金属离子,有毒,不能用于钡餐,钡餐用硫酸钡,故D错误;答案选D。
7.[2020·浙江7月选考,12]下列说法正确的是( )
A. 在空气中加热可得固体
B. 加入到过量溶液中可得
C. 在沸腾炉中与反应主要生成
D. 溶液中加入少量粉末生成和
【答案】A
【解析】
A.无水状态下Na2O2比Na2O更稳定,Na2O在空气中加热可以生成更稳定的Na2O2,A正确;
B.Mg加入到FeCl3溶液中,Mg具有较强的还原性,先与Fe3+反应,生成Mg2+和Fe2+,若Mg过量,Mg与Fe2+继续反应生成Mg2+和Fe,但由于反应中FeCl3过量,Mg已消耗完,所以无Mg和Fe2+反应,所以不会生成Fe,B错误;
C.FeS2在沸腾炉中与O2发生的反应为:4 FeS2+11O22Fe2O3+8SO2,产物主要是SO2而不是SO3,C错误;
D.H2O2溶液中加入少量MnO2粉末生成H2O和O2,化学方程式为:2H2O22H2O+O2↑,D错误。
故仅A选项符合题意。
8. [2020·浙江7月选考,24]是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
A. 可发生反应:
B. 具有吸水性,需要密封保存
C. 能与,反应生成新盐
D. 与足量盐酸作用,所得固体产物主要为
【答案】D
【解析】
A.Ca3SiO5与NH4Cl反应的方程式为:Ca3SiO5+4NH4Cl CaSiO3+2CaCl2+4NH3↑+2H2O,A正确;
B.CaO能与水反应,所以需要密封保存,B正确;
C.亚硫酸的酸性比硅酸强,当二氧化硫通入到Ca3SiO5溶液时,发生反应:3SO2+H2O+ Ca3SiO5=3 CaSO3+H2SiO3,C正确;
D.盐酸的酸性比硅酸强,当盐酸与Ca3SiO5反应时,发生反应:6HCl+ Ca3SiO5=3CaCl2+H2SiO3+2H2O,D不正确;故仅D选项符合题意。
9. [2020·浙江1月选考,8]下列说法不正确的是( )
A.二氧化硅导电能力强,可用于制造光导纤维
B.石灰石在高温下可用于消除燃煤烟气中的SO2
C.钠着火不能用泡沫灭火器灭火
D.利用催化剂可减少汽车尾气中有害气体的排放
【答案】A
【解析】A.二氧化硅为绝缘体,不导电,故A项错误;B.石灰石在高温下分解为生石灰,生石灰与煤燃烧生成的SO2结合生成亚硫酸钙,CaSO3再与O2反应转化为CaSO4,从而实现了燃煤脱硫,故B项正确;C.钠着火时生成过氧化钠,过氧化钠与二氧化碳反应产生氧气,因此不能用泡沫灭火器灭火,故C项正确;D.在汽车尾气处理系统中利用催化剂,可降低尾气中CO、NOx等有害气体的排放,故D项正确。答案选A。
10. [2020·浙江1月选考,9]下列说法不正确的是
A. [Cu(NH3)4]SO4可通过CuSO4溶液与过量氨水作用得到
B. 铁锈的主要成分可表示为Fe2O3·nH2O
C. 钙单质可以从TiCl4中置换出Ti
D. 可用H2还原MgO制备单质Mg
【答案】D
【解析】A项、CuSO4溶液与少量氨水反应生成氢氧化铜沉淀,与过量氨水反应生成络合物[Cu(NH3)4]SO4,故A正确;B项、铁在潮湿空气中发生吸氧腐蚀生成红棕色的铁锈,铁锈的主要成分可表示为Fe2O3·nH2O,故B正确;C项、钙的化学性质活泼,在稀有气体的保护下,与熔融的四氯化钛反应可置换出Ti,故C正确;D项、制备单质Mg应该用电解熔融MgCl2的方法,故D错误;故选D。
11. [2020·浙江1月选考,12]下列关于铝及其化合物说法,不正确的是( )
A. 明矾可用作净水剂和消毒剂 B. 利用铝热反应可冶炼高熔点金属
C. 铝可用作包装材料和建筑材料 D. 氢氧化铝可用作治疗胃酸过多的药物
【答案】A
【解析】A.明矾溶于水可生成具有吸附性的氢氧化铝胶体,可以净水但不能消毒,故A错误;B.铝热反应是金属铝和沸点较高的金属氧化物之间反应冶炼高熔点金属的过程,故B正确。C.铝具有良好的延展性,铝箔可以做包装材料,铝合金硬度大密度小常用做建筑材料,故C正确;D.胃酸主要成分为HCl,氢氧化铝具有弱碱性可中和过多胃酸,故D正确;故答案为A。
12. [2020·浙江1月选考,24]100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是
A. 焦硫酸具有强氧化性
B. Na2S2O7水溶液呈中性
C. Na2S2O7可与碱性氧化物反应生成新盐
D. 100%硫酸吸收SO3生成焦硫酸的变化是化学变化
【答案】B
【解析】A项、从组成上看,焦硫酸是由等物质的量的三氧化硫与纯硫酸化合而成的,则焦硫酸具有比浓硫酸更强的氧化性、吸水性和腐蚀性,故A正确;B项、从组成上看,Na2S2O7可以形成Na2SO4·SO3,Na2SO4·SO3溶于水时,三氧化硫与水反应生成硫酸,水溶液显酸性,故B错误;C项、从组成上看,Na2S2O7可以形成Na2SO4·SO3,三氧化硫可与碱性氧化物反应生成硫酸钠,故C正确;D项、100%硫酸吸收SO3生成焦硫酸有新物质生成,属于化学变化,故D正确;故选B。
13. [2019·新课标Ⅰ] 固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。下列叙述错误的是
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10?3 mol·L?1(设冰的密度为0.9 g·cm?3)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HClH++Cl?
【答案】D
【解析】
【分析】由示意图可知,在冰的表面第一层主要为氯化氢的吸附,第二层中氯化氢溶于水中并发生部分电离,第三层主要是冰,与氯化氢的吸附和溶解无关。
【详解】A项、由图可知,冰的表面第一层主要为氯化氢的吸附,氯化氢以分子形式存在,故A正确;
B项、由题给数据可知,冰的表面第二层中氯离子和水的个数比为10—4:1,第二层中溶解的氯化氢分子应少于第一层吸附的氯化氢分子数,与水的质量相比,可忽略其中溶解的氯化氢的质量。设水的物质的量为1mol,则所得溶液质量为18g/mol×1mol=18g,则溶液的体积为×10—3L/ml=2.0×10—2L,由第二层氯离子和水个数比可知,溶液中氢离子物质的量等于氯离子物质的量,为10—4mol,则氢离子浓度为=5×10—3mol/L,故B正确;
C项、由图可知,第三层主要是冰,与氯化氢的吸附和溶解无关,冰的氢键网络结构保持不变,故C正确;
D项、由图可知,只有第二层存在氯化氢的电离平衡HClH++Cl—,而第一层和第三层均不存在,故D错误。
故选D。
14.[2019·江苏]下列有关物质的性质与用途具有对应关系的是
A.NH4HCO3受热易分解,可用作化肥
B.稀硫酸具有酸性,可用于除去铁锈
C.SO2具有氧化性,可用于纸浆漂白
D.Al2O3具有两性,可用于电解冶炼铝
【答案】B
【解析】A.NH4HCO3受热易分解和用作化肥无关,可以用作化肥是因为含有氮元素;
B.铁锈的主要成分为Fe2O3,硫酸具有酸性可以和金属氧化物反应,具有对应关系;
C.二氧化硫的漂白原理是二氧化硫与有色物质化合成不稳定的无色物质,不涉及氧化还原,故和二氧化硫的氧化性无关;
D.电解冶炼铝,只能说明熔融氧化铝能导电,是离子晶体,无法说明是否具有两性,和酸、碱都反应可以体现 Al2O3具有两性。
故选B。
15.[2019·江苏] 下列有关化学反应的叙述正确的是
A.Fe在稀硝酸中发生钝化 B.MnO2和稀盐酸反应制取Cl2
C.SO2与过量氨水反应生成(NH4)2SO3 D.室温下Na与空气中O2反应制取Na2O2
【答案】C
【解析】
A.常温下,Fe在与浓硝酸发生钝化反应,故A错误;
B.二氧化锰与浓盐酸在加热条件下反应制取氯气,故B错误;
C.二氧化硫与过量氨水反应生成硫酸铵,故C正确;
D.常温下,Na与空气中的氧气反应生成Na2O;加热条件下,钠与氧气反应生成Na2O2,故D错误;综上所述,本题应选C。
16.[2019·江苏] 在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq)Cl2(g)FeCl2(s)
B.MgCl2(aq)Mg(OH)2(s)MgO (s)
C.S(s)SO3(g)H2SO4(aq)
D.N2(g)NH3(g)Na2CO3(s)
【答案】B
【解析】
A.氯气的氧化性强,与铁单质反应直接生成氯化铁,故A错误;
B.氯化镁与石灰乳发生复分解反应生成氢氧化镁,氢氧化镁高温煅烧生成氧化镁和水,故B正确;
C.硫单质在空气中燃烧只能生成SO2,SO2在与氧气在催化剂条件下生成SO3,故C错误;
D.氨气与二氧化碳和氯化钠溶液反应生成碳酸氢钠,碳酸氢钠受热分解可生成碳酸钠,故D错误;综上所述,本题应选B。
17.[2019·天津] 下列有关金属及其化合物的应用不合理的是
A.将废铁屑加入溶液中,可用于除去工业废气中的
B.铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C.盐碱地(含较多等)不利于作物生长,可施加熟石灰进行改良
D.无水呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
【答案】C
【解析】
A、铁和亚铁能将氯气还原为氯离子,从而除去工业废气中的氯气,故A不选;
B、根据铝合金的性质,铝合金具有密度低、强度高,故可应用于航空航天等工业,故B不选;
C、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,产物仍然呈碱性,不能改变土壤的碱性,反而使土壤更板结,故C选;
D、利用无水氯化钴和氯化钴晶体的颜色不同,故可根据颜色判断硅胶中是否能吸水,故D不选。
故选C。
18.[2019·浙江4月选考]下列说法不正确的是
A.液氯可以储存在钢瓶中
B.天然气的主要成分是甲烷的水合物
C.天然石英和水晶的主要成分都是二氧化硅
D.硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等
【答案】B
【解析】A.液氯就是液态的氯气,与钢瓶不反应,可以储存在钢瓶中,A项正确;
B.天然气的主要成分是甲烷,可燃冰的主要成分是甲烷的水合物,B项错误;
C.石英、水晶、硅石、沙子的主要成分均为二氧化硅,C项正确;
D.硫在地壳中主要以硫化物、硫酸盐等形式存在,火山口处有硫单质,D项正确。
故答案选B。
19.[2019·浙江4月选考] 18.下列说法不正确的是
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
【答案】C
【解析】A.烧碱和纯碱均属于离子化合物,熔化时须克服离子键,A项正确;
B.加热蒸发氯化钾水溶液,液态水变为气态水,水分子之间的分子间作用力被破坏,B项正确;
C.CO2溶于水发生反应:CO2+H2O?H2CO3,这里有化学键的断裂和生成,C项错误;
D.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,D项正确。故答案选C。
20.[2018·新课标Ⅰ卷]磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
【答案】D
【解析】
A、废旧电池中含有重金属,随意排放容易污染环境,因此合理处理废旧电池有利于保护环境和资源再利用,A正确;
B、根据流程的转化可知从正极片中可回收的金属元素有Al、Fe、Li,B正确;
C、得到含Li、P、Fe的滤液,加入碱液生成氢氧化铁沉淀,因此“沉淀”反应的金属离子是Fe3+,C正确;
D、硫酸锂能溶于水,因此上述流程中不能用硫酸钠代替碳酸钠,D错误。答案选D。
21.[2018·新课标Ⅱ卷]研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
【答案】C
【解析】
A.雾的分散剂是空气,分散质是水。霾的分散剂是空气,分散质固体颗粒。因此雾和霾的分散剂相同,A正确;
B.由于氮氧化物和二氧化硫转化为铵盐形成无机颗粒物,因此雾霾中含有硝酸铵和硫酸铵,B正确;
C.NH3作为反应物参加反应转化为铵盐,因此氨气不是形成无机颗粒物的催化剂,C错误;
D.氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关,由于氮肥会释放出氨气,因此雾霾的形成与过度施用氮肥有关,D正确。答案选C。
22.[2018·海南卷]絮凝剂有助于去除工业和生活废水中的悬浮物。下列物质可作为絮凝剂的是
A.NaFe(SO4)2·6H2O B.CaSO4·2H2O
C.Pb(CH3COO)2·3H2O D.KAl(SO4)2·12H2O
【答案】AD
【解析】由题意知,絮凝剂有助于去除工业和生活废水中的悬浮物,因此,絮凝剂本身或与水生成的产物具有吸附性。A.铁离子能水解生成氢氧化铁胶体可吸附悬浮物,符合题意;
B.硫酸钙本身是微溶物,没有吸附作用,不符合题意;
C.醋酸铅没有吸附性,不符合题意;
D.明矾可净水,其原理是铝离子水解生成氢氧化铝胶体,可吸附悬浮物,符合题意;
故答案为AD。
23.[2018·江苏卷]在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
【答案】A
【解析】A项,NaHCO3受热分解成Na2CO3、CO2和H2O,Na2CO3与饱和石灰水反应生成CaCO3和NaOH,两步反应均能实现;B项,Al与NaOH溶液反应生成NaAlO2和H2,NaAlO2与过量盐酸反应生成NaCl、AlCl3和H2O,第二步反应不能实现;C项,AgNO3中加入氨水可获得银氨溶液,蔗糖中不含醛基,蔗糖不能发生银镜反应,第二步反应不能实现;D项,Al与Fe2O3高温发生铝热反应生成Al2O3和Fe,Fe与HCl反应生成FeCl2和H2,第二步反应不能实现;物质间转化均能实现的是A项,答案选A。
点睛:本题考查元素及其化合物之间的相互转化和反应条件,解题的关键是熟悉常见物质的化学性质和转化的条件。注意量的多少对生成物的影响,如NaAlO2与少量HCl反应生成NaCl和Al(OH)3,NaAlO2与过量HCl反应生成NaCl、AlCl3和H2O。
24.[2018·浙江11月选考]下列说法不正确的是
A.电解熔融氯化镁可制取金属镁
B.电解饱和食盐水可制取氯气
C.生产普通玻璃的主要原料为石灰石、纯碱和晶体硅
D.接触法制硫酸的硫元素主要来源于硫黄或含硫矿石
【答案】C
【解析】A、制取金属镁时,由于镁的活泼性很强,故一般电解熔融的氯化镁制取金属镁,选项A正确;B、电解饱和食盐水生成氢氧化钠、氢气和氯气,可制取氯气,选项B正确;C、生产普通玻璃的主要原料为石灰石、纯碱和石英,选项C不正确;D、接触法制硫酸的硫元素主要来源于硫黄或含硫矿石,硫与氧气反应生成二氧化硫或煅烧硫铁矿生成二氧化硫,选项D正确。答案选C。
25. [2018·浙江4月选考,6]下列说法不正确的是
A. 纯碱可用于去除物品表面的油污
B. 二氧化碳可用作镁燃烧的灭火剂
C. 植物秸秆可用于制造酒精
D. 氢氧化铁胶体可用作净水剂
【答案】B
【解析】A项,纯碱水溶液呈碱性,油脂在碱溶液中水解生成溶于水的物质,可用于去除物品表面的油污,故A项正确;B项,镁可以与二氧化碳发生反应,二氧化碳不能作为镁的灭火剂,故B项错误;C项,纤维素能够水解变成葡萄糖,葡萄糖在某些酶的作用下可以转化为乙醇,故C项正确;D项,氢氧化铁的胶体具有吸附性,能够吸附水中固体杂质颗粒,可以作为净水剂,故D项正确。
26. [2018·浙江4月选考,9]下列反应中能产生二氧化硫的是
A. 氧化铜和稀硫酸反应 B. 亚硫酸钠和氧气反应
C. 三氧化硫和水反应 D. 铜和热的浓硫酸反应
【答案】D
【解析】A项,生成物为硫酸铜和水,不产生二氧化硫,故不选A;B项,亚硫酸钠和氧气反应生成硫酸钠,该反应不产生二氧化硫,故不选B;C项,三氧化硫和水反应生成硫酸,反应中无法产生二氧化硫,故不选C;D项,Cu与浓硫酸反应生成二氧化硫、水和硫酸铜,故选D。综上所述,本题正确选项为D。
12
同课章节目录
