人教版高二化学选修5第二章第一节 脂肪烃(共18张PPT)
文档属性
| 名称 | 人教版高二化学选修5第二章第一节 脂肪烃(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-18 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
燃烧的石头
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载。
乙炔
炔烃
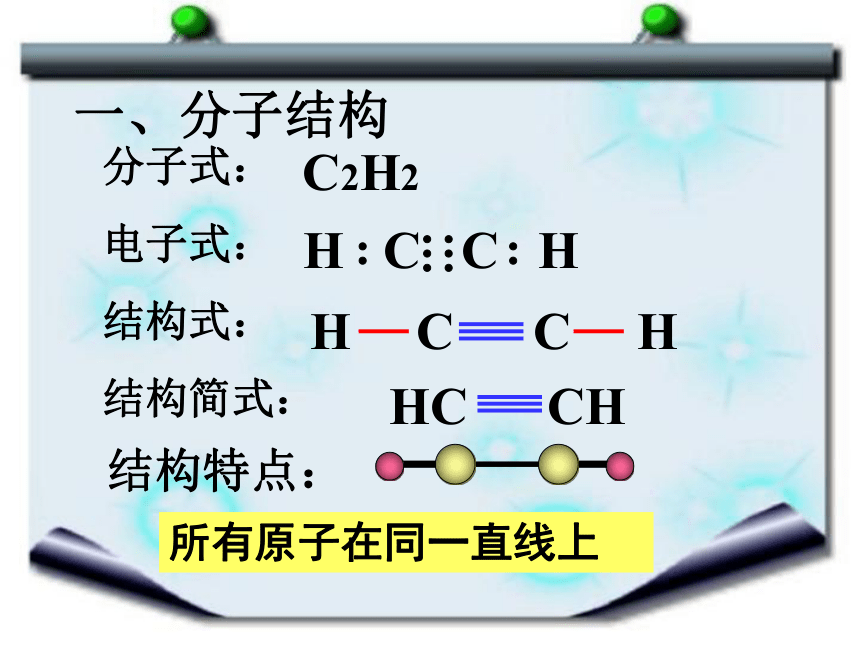
一、分子结构
分子式:
电子式:
结构式:
结构简式:
C2H2
结构特点:
所有原子在同一直线上
常用
除去。
用电石和水反应制取的乙炔,常闻到有恶臭气味。是因为在电石中含有少量硫化钙、磷化钙等杂质,跟水作用时生成H2S、PH3等气体有特殊的气味所致。
CuSO4溶液
注意事项:
(1)使用前要检验装置气密性。
(2)试剂瓶要及时密封,防止电石吸水而失效。
(3)取电石要用镊子夹取。
(4)电石与水反应很剧烈。常用饱和食盐水代替水,并用分液漏斗控制水流的速度,逐滴慢慢地滴入。
乙炔的实验室制法
制取时在导气管口附近塞入少量棉花
目的:为防止产生的泡沫进入导管。
乙炔的用途:
切割金属,焊接金属
30米挂车一路撒“火种”
江南大道“电光石火”13小时
20吨灰白色电石剧烈燃烧
燃烧的石头
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载。
3、炔烃的化学通性:
与乙炔相似,能发生氧化反应,加成反应
2、含有一个碳碳三键的炔烃的通式:
CnH2n-2
(n≥2)
炔烃
1、概念:分子里含有碳碳叁键的不饱链烃叫做炔烃。
乙烷、乙烯、乙炔性质的比较
H-C-C-H
H
H
H
H
C=C
H
H
H
H
乙烷
乙烯
乙炔
分子式
C2H6
C2H4
C2H2
结构式
电子式
化学活动性
稳定
活泼
活泼
取代反应
卤代
-----
-----
加成反应
---
使溴水褪色等
使溴水褪色等
下列物质中,碳元素的质量分数最大的是[
]
A.甲烷
B.乙烯
C.乙烷
D.乙炔
乙烷
乙烯
乙炔
氧化反应
KMnO4不褪色
KMnO4褪色
KMnO4褪色
燃烧
火焰不明亮
火焰明亮、有烟
火焰明亮、有浓烟
加成
溴水不褪色
溴水褪色
溴水褪色
烃燃烧时的现象和含碳量有何联系?
习题.
鉴别甲烷、乙烯、乙炔三种气体可采用的方法是:
A.
通入溴水中,观察溴水是否褪色。
B.
通入酸化的高锰酸钾溶液中,观察颜色是否变化。
C.
点燃,检验燃烧产物。
D.
点燃,观察火焰明亮程度及产生黑烟量的多少。
D
四、脂肪烃的来源及其应用
脂肪烃的来源有石油、天然气和煤等。
石油通过常压分馏可以得到石油气、汽油、煤油、柴油等;减压分馏可以得到润滑油、石蜡等分子量较大的烷烃;气态烯烃是最基本的化工原料;催化重整是获得芳香烃的主要途径。
煤也是获得有机化合物的源泉。通过煤焦油的分馏可以获得各种芳香烃;通过煤矿直接或间接液化,可以获得燃料油及多种化工原料。
天然气是高效清洁燃料,主要是烃类气体,以甲烷为主。
原油的分馏及裂化的产品和用途
石油催化重整的目的有两个:提高汽油的辛烷值和制取芳香烃。
石油裂解是深度的裂化,使短链的烷烃进一步分解生成乙烷、丙烷、丁烯等重要石油化工原料。
石油的催化裂化是将重油成分(如石油)在催化剂存在下,在460~520℃及100kPa~
200kPa的压强下,长链烷烃断裂成短链烷烃和烯烃,从而大大提高汽油的产量。
燃烧的石头
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载。
乙炔
炔烃
一、分子结构
分子式:
电子式:
结构式:
结构简式:
C2H2
结构特点:
所有原子在同一直线上
常用
除去。
用电石和水反应制取的乙炔,常闻到有恶臭气味。是因为在电石中含有少量硫化钙、磷化钙等杂质,跟水作用时生成H2S、PH3等气体有特殊的气味所致。
CuSO4溶液
注意事项:
(1)使用前要检验装置气密性。
(2)试剂瓶要及时密封,防止电石吸水而失效。
(3)取电石要用镊子夹取。
(4)电石与水反应很剧烈。常用饱和食盐水代替水,并用分液漏斗控制水流的速度,逐滴慢慢地滴入。
乙炔的实验室制法
制取时在导气管口附近塞入少量棉花
目的:为防止产生的泡沫进入导管。
乙炔的用途:
切割金属,焊接金属
30米挂车一路撒“火种”
江南大道“电光石火”13小时
20吨灰白色电石剧烈燃烧
燃烧的石头
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载。
3、炔烃的化学通性:
与乙炔相似,能发生氧化反应,加成反应
2、含有一个碳碳三键的炔烃的通式:
CnH2n-2
(n≥2)
炔烃
1、概念:分子里含有碳碳叁键的不饱链烃叫做炔烃。
乙烷、乙烯、乙炔性质的比较
H-C-C-H
H
H
H
H
C=C
H
H
H
H
乙烷
乙烯
乙炔
分子式
C2H6
C2H4
C2H2
结构式
电子式
化学活动性
稳定
活泼
活泼
取代反应
卤代
-----
-----
加成反应
---
使溴水褪色等
使溴水褪色等
下列物质中,碳元素的质量分数最大的是[
]
A.甲烷
B.乙烯
C.乙烷
D.乙炔
乙烷
乙烯
乙炔
氧化反应
KMnO4不褪色
KMnO4褪色
KMnO4褪色
燃烧
火焰不明亮
火焰明亮、有烟
火焰明亮、有浓烟
加成
溴水不褪色
溴水褪色
溴水褪色
烃燃烧时的现象和含碳量有何联系?
习题.
鉴别甲烷、乙烯、乙炔三种气体可采用的方法是:
A.
通入溴水中,观察溴水是否褪色。
B.
通入酸化的高锰酸钾溶液中,观察颜色是否变化。
C.
点燃,检验燃烧产物。
D.
点燃,观察火焰明亮程度及产生黑烟量的多少。
D
四、脂肪烃的来源及其应用
脂肪烃的来源有石油、天然气和煤等。
石油通过常压分馏可以得到石油气、汽油、煤油、柴油等;减压分馏可以得到润滑油、石蜡等分子量较大的烷烃;气态烯烃是最基本的化工原料;催化重整是获得芳香烃的主要途径。
煤也是获得有机化合物的源泉。通过煤焦油的分馏可以获得各种芳香烃;通过煤矿直接或间接液化,可以获得燃料油及多种化工原料。
天然气是高效清洁燃料,主要是烃类气体,以甲烷为主。
原油的分馏及裂化的产品和用途
石油催化重整的目的有两个:提高汽油的辛烷值和制取芳香烃。
石油裂解是深度的裂化,使短链的烷烃进一步分解生成乙烷、丙烷、丁烯等重要石油化工原料。
石油的催化裂化是将重油成分(如石油)在催化剂存在下,在460~520℃及100kPa~
200kPa的压强下,长链烷烃断裂成短链烷烃和烯烃,从而大大提高汽油的产量。
