苏教版高二化学选修 化学反应原理专题3 第一单元 弱电解质的电离平衡(共23张PPT)
文档属性
| 名称 | 苏教版高二化学选修 化学反应原理专题3 第一单元 弱电解质的电离平衡(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 350.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-18 18:25:35 | ||
图片预览






文档简介
(共23张PPT)
影响水电离的因素
学习目标
知识与技能:
运用微粒观和平衡观分析影响水电离平衡的因素,建立思维模型
。
过程与方法:运用推理论证使学生针对影响水电离的因素分析溶液中粒子行为的分析模型。
情感态度与价值观:通过本节课学习使学生逻辑思维能力增强。
教学重点:影响水电离平衡的因素。
教学难点:运用微粒观和平衡观分析影响水电离平衡的因素,建立思维模型。
复习:1、从物质分类角度考虑常见的强电解质与弱电解质有哪些?
强电解质:
强酸、强碱、绝大多数盐
强酸:H2SO4、HNO3、HClO4、
HCl、
HBr、HI
强碱:
NaOH
、KOH、Ca(OH)2、Ba(OH)2
绝大多数盐:NaCl、Na2SO4、KNO3、
BaSO4
、
CaCO3、AgCl等
弱酸、弱碱、极少数盐、水
弱电解质:
弱酸:CH3COOH、HClO、H2CO3、H2SO3、HF、
H2S、H3PO4等
弱碱:NH3?H2O、Fe(OH)
3、Cu(OH)
2、Mg(OH)2等
2、水的电离受温度有何影响?
影响水电离平衡的因素
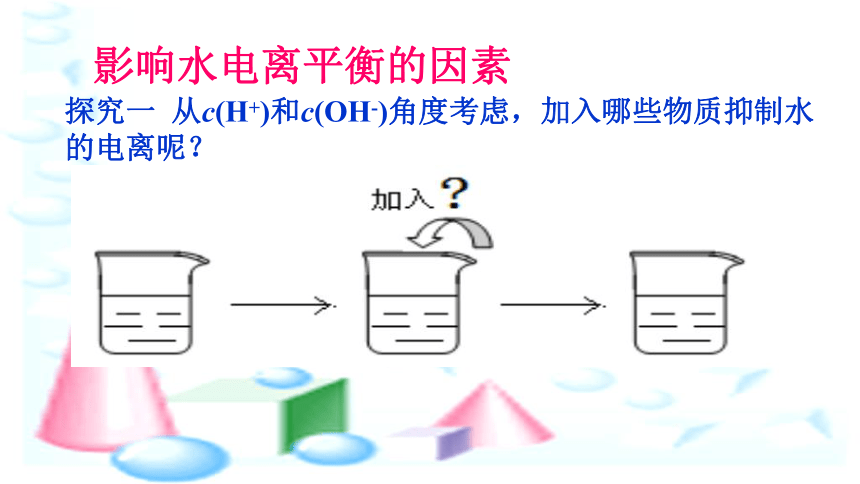
探究一
从c(H+)和c(OH-)角度考虑,加入哪些物质抑制水的电离呢?
变式
:
若把少量等物质的量HCl、H2SO4、CH3COOH
加入等量水中,对水的影响是否相同?
思
考
从离子的浓度考虑,如何增加水中的c(OH–)?
思考:把少量等物质的量的NH3、
NaOH
、Ba(OH)2加入等量水中,对水的影响是否相同?
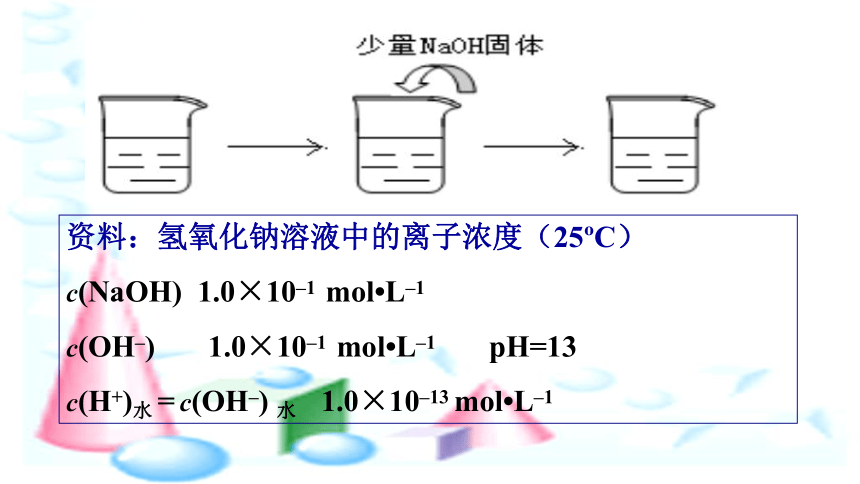
资料:氢氧化钠溶液中的离子浓度(25?C)
c(NaOH)
1.0×10–1
mol?L–1
c(OH–)
1.0×10–1
mol?L–1
pH=13
c(H+)水
=
c(OH–)
水
1.0×10–13
mol?L–1
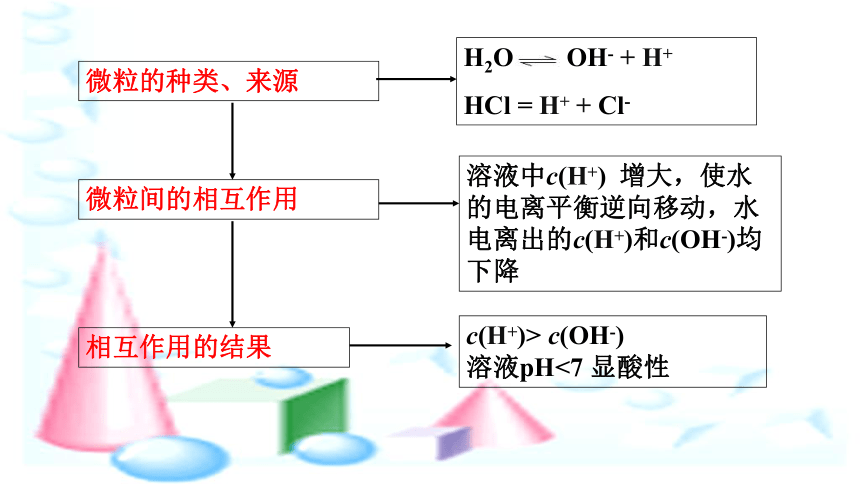
微粒的种类、来源
小结:
水中加入酸或者碱
水中加入酸或者碱,抑制水的电离,水电离的c(H+)和c(OH-)均有所下降,但Kw保持不变。
c(H+)
≠
c(OH-),水溶液的pH值改变。
从c(H+)和c(OH-)角度考虑,加入哪些物质促进水的电离呢?
探究二:
加入CH3COONa,水中的电离平衡如何移动,溶液中c(H+)和c(OH-)如何变化?
微粒的种类、来源
微粒间的相互作用
相互作用的结果
小结:水中加入盐类物质
(1)水中加入含有NH4+、Fe3+、
Cu2+、Al3+等离子的盐后,可以促进水电离,溶液显酸性。
(2)水中加入含有CO32–、HCO3–、ClO–、F–、S2–等离子的盐后,促进水电离,溶液显碱性。
(3)以上各离子均由盐类物质带入水中。
弱酸根离子
弱碱阳离子
总结之一
水的电离
H2O
H+
+
OH-
哪些因素可能影响醋酸的电离平衡呢?
CH3COOH
CH3COO-
+
H+
讨
论
你能用电离平衡的观点解释醋酸与碳酸钠溶液的反应吗?
CO32-与溶液中的哪种离子结合?
CO2是如何产生的?
H+从哪来?
c(H+)如何变化?
对醋酸电离有什么影响?
还有什么方法可以促进醋酸的电离?
如何抑制醋酸的电离?
醋酸的电离
CH3COOH
CH3COO-
+
H+
抑制
促进
微粒的种类、来源
微粒间的相互作用
相互作用的结果
H2O
OH-
+
H+
CH3COOH
CH3COO-
+
H+
溶液中c(H+)
增大,使水的电离平衡逆向移动,但由于电离程度差异很大,主要关注醋酸的电离
c(H+)>
c(OH-)
溶液pH<7
显酸性
总结之二
练习1、0.1
mol/L的CH3COOH溶液中存在平衡:CH3COOH
CH3COO-+H+。下列说法正确的是(
)
A.加水时,平衡向逆反应方向移动
B.加入少量0.1
mol/L盐酸,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体,平衡向正反应方向移动
C
2.已知在室温时纯水中存在电离平衡:
H2O
H++OH-。下列叙述正确的是(
)
A.升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性
B.向水中加入氨水,平衡向逆反应方向移动,水的电离受到抑制,所以c(OH-)降低
C.向水中加人少量硫酸,c(H+)增大,所以由水电离出的
c(H+)>1×10-7mol/L
D.向水中加入少量NH4Cl,NH4+结合水电离出的OH-由水电离出的c(H+)>l×10-7
mol/L
D
3.25℃时,水的电离达到平衡:H2O
H++OH-;ΔH>0,下列叙述正确的是(
)
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.
向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.
将水加热,Kw增大,pH不变
B
影响水电离的因素
学习目标
知识与技能:
运用微粒观和平衡观分析影响水电离平衡的因素,建立思维模型
。
过程与方法:运用推理论证使学生针对影响水电离的因素分析溶液中粒子行为的分析模型。
情感态度与价值观:通过本节课学习使学生逻辑思维能力增强。
教学重点:影响水电离平衡的因素。
教学难点:运用微粒观和平衡观分析影响水电离平衡的因素,建立思维模型。
复习:1、从物质分类角度考虑常见的强电解质与弱电解质有哪些?
强电解质:
强酸、强碱、绝大多数盐
强酸:H2SO4、HNO3、HClO4、
HCl、
HBr、HI
强碱:
NaOH
、KOH、Ca(OH)2、Ba(OH)2
绝大多数盐:NaCl、Na2SO4、KNO3、
BaSO4
、
CaCO3、AgCl等
弱酸、弱碱、极少数盐、水
弱电解质:
弱酸:CH3COOH、HClO、H2CO3、H2SO3、HF、
H2S、H3PO4等
弱碱:NH3?H2O、Fe(OH)
3、Cu(OH)
2、Mg(OH)2等
2、水的电离受温度有何影响?
影响水电离平衡的因素
探究一
从c(H+)和c(OH-)角度考虑,加入哪些物质抑制水的电离呢?
变式
:
若把少量等物质的量HCl、H2SO4、CH3COOH
加入等量水中,对水的影响是否相同?
思
考
从离子的浓度考虑,如何增加水中的c(OH–)?
思考:把少量等物质的量的NH3、
NaOH
、Ba(OH)2加入等量水中,对水的影响是否相同?
资料:氢氧化钠溶液中的离子浓度(25?C)
c(NaOH)
1.0×10–1
mol?L–1
c(OH–)
1.0×10–1
mol?L–1
pH=13
c(H+)水
=
c(OH–)
水
1.0×10–13
mol?L–1
微粒的种类、来源
小结:
水中加入酸或者碱
水中加入酸或者碱,抑制水的电离,水电离的c(H+)和c(OH-)均有所下降,但Kw保持不变。
c(H+)
≠
c(OH-),水溶液的pH值改变。
从c(H+)和c(OH-)角度考虑,加入哪些物质促进水的电离呢?
探究二:
加入CH3COONa,水中的电离平衡如何移动,溶液中c(H+)和c(OH-)如何变化?
微粒的种类、来源
微粒间的相互作用
相互作用的结果
小结:水中加入盐类物质
(1)水中加入含有NH4+、Fe3+、
Cu2+、Al3+等离子的盐后,可以促进水电离,溶液显酸性。
(2)水中加入含有CO32–、HCO3–、ClO–、F–、S2–等离子的盐后,促进水电离,溶液显碱性。
(3)以上各离子均由盐类物质带入水中。
弱酸根离子
弱碱阳离子
总结之一
水的电离
H2O
H+
+
OH-
哪些因素可能影响醋酸的电离平衡呢?
CH3COOH
CH3COO-
+
H+
讨
论
你能用电离平衡的观点解释醋酸与碳酸钠溶液的反应吗?
CO32-与溶液中的哪种离子结合?
CO2是如何产生的?
H+从哪来?
c(H+)如何变化?
对醋酸电离有什么影响?
还有什么方法可以促进醋酸的电离?
如何抑制醋酸的电离?
醋酸的电离
CH3COOH
CH3COO-
+
H+
抑制
促进
微粒的种类、来源
微粒间的相互作用
相互作用的结果
H2O
OH-
+
H+
CH3COOH
CH3COO-
+
H+
溶液中c(H+)
增大,使水的电离平衡逆向移动,但由于电离程度差异很大,主要关注醋酸的电离
c(H+)>
c(OH-)
溶液pH<7
显酸性
总结之二
练习1、0.1
mol/L的CH3COOH溶液中存在平衡:CH3COOH
CH3COO-+H+。下列说法正确的是(
)
A.加水时,平衡向逆反应方向移动
B.加入少量0.1
mol/L盐酸,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体,平衡向正反应方向移动
C
2.已知在室温时纯水中存在电离平衡:
H2O
H++OH-。下列叙述正确的是(
)
A.升高温度,水的电离程度增大,c(H+)增大,pH<7,所以溶液显酸性
B.向水中加入氨水,平衡向逆反应方向移动,水的电离受到抑制,所以c(OH-)降低
C.向水中加人少量硫酸,c(H+)增大,所以由水电离出的
c(H+)>1×10-7mol/L
D.向水中加入少量NH4Cl,NH4+结合水电离出的OH-由水电离出的c(H+)>l×10-7
mol/L
D
3.25℃时,水的电离达到平衡:H2O
H++OH-;ΔH>0,下列叙述正确的是(
)
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.
向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.
将水加热,Kw增大,pH不变
B
