人教版必修一高中化学4.1 《无机非金属材料的主角——硅》 课件(82张PPT)
文档属性
| 名称 | 人教版必修一高中化学4.1 《无机非金属材料的主角——硅》 课件(82张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-18 00:00:00 | ||
图片预览







文档简介
(共82张PPT)
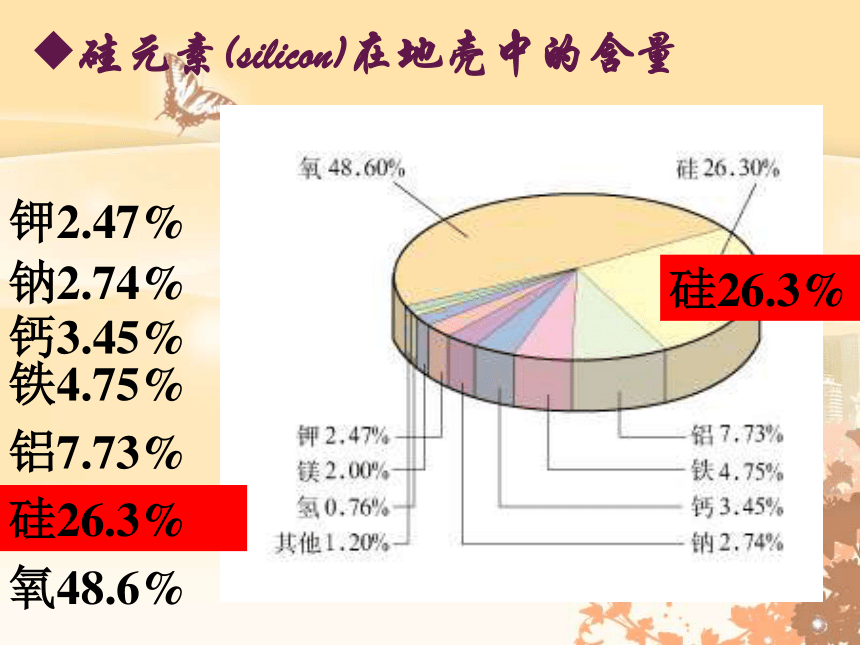
硅元素(silicon)在地壳中的含量
氧48.6%
硅26.3%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
硅26.3%
硅的分布与存在
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
第ⅣA族的二兄弟碳和硅—豪门二杰
构成了地壳大部分岩石、沙子和土壤,
“统治了地壳”
硅是构成岩石与许多矿物的基本元素,
“
统治无机矿物界”
硅酸盐工业的陶瓷、玻璃、水泥等使人类生活日新月异
碳元素
硅元素
形成了无数种构成人类和其它地球生物等的有机物,“统治了有机界”。
煤、石油等有机化产品和材料是现代化的基石
1、存在形式
{
晶体硅
无定形硅
硅有晶体硅和无定形硅两种。
一、硅单质
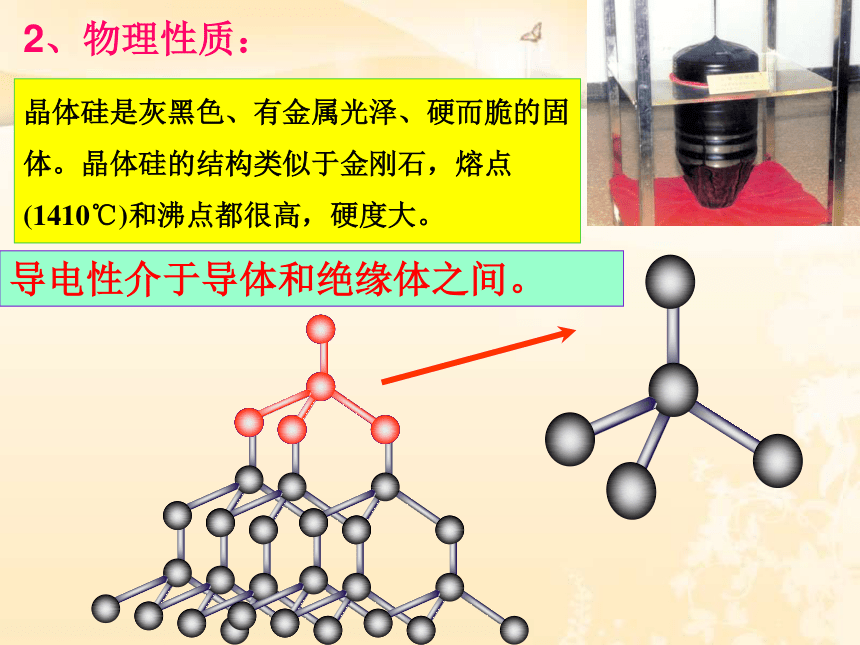
2、物理性质:
晶体硅是灰黑色、有金属光泽、硬而脆的固体。晶体硅的结构类似于金刚石,熔点(1410℃)和沸点都很高,硬度大。
导电性介于导体和绝缘体之间。
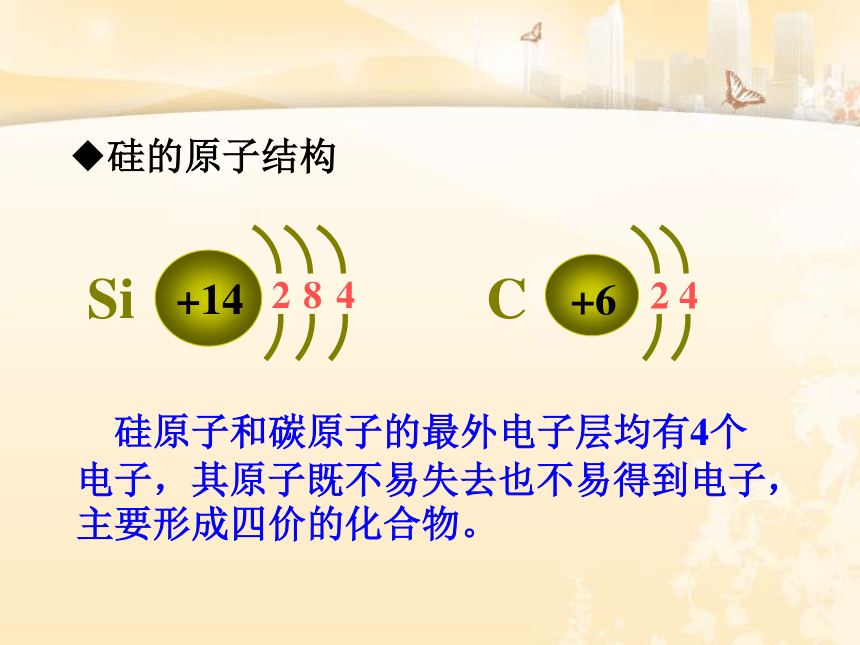
思考1:硅原子最外层电子数是多少?
我们很熟悉的哪种元素最外层电子数与它相同?
硅的原子结构
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成四价的化合物。
C
②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
①常温下化学性质不活泼,只能跟F2、HF和
NaOH溶液反应。
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
3
、硅单质的化学性质
工业上,用焦炭在高温下还原石英砂可制得粗硅,粗硅跟氯气反应经提纯得到
SiCl4后再用氢气还原制得纯硅:
4、硅的工业制备
硅单质
(1)反应①中焦炭做(
)
A.还原剂
B.氧化剂
C.二者都不是
(2)反应
②属于(
),反应③
属于(
)
A.化合反应
B.分解反应
C.氧化还原反应
D.非氧化还原反应
E.置换反应
A
AC
CE
SiO2+2C=Si(粗)+2CO↑
①
Si(粗)+2Cl2=SiCl4
②
SiCl4+2H2=Si(纯)+4HCl
③
根据以下反应回答下列问题:
5、用途:太阳能电池、计算机芯片以及半导体材料、信息技术等材料和人造卫星、登月车、火星探测器等动力设备新能源。
硅太阳能电池
硅芯片是各种计算机、微电子产品的核心
硅单质
硅是一种亲氧元素,在自然界它总是与氧相互化合。所以在氧化气氛包围的地球上,硅主要以熔点很高的氧化物及硅酸盐的形式存在。
二、二氧化硅和硅酸
SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
(一)、二氧化硅
1、存在
硅石(12%)
结晶形(石英晶体)
无定形——硅藻土
SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
晶体二氧化硅
晶体二氧化硅
玛瑙
晶体二氧化硅
硅藻土
中国硅藻土资源丰富。全国10个省(区)有硅藻土矿产出。探明储量的矿区有354处,总保有储量矿石3.85亿吨。仅次于美国,居世界第2位。在地区分
布上,以吉林最多,占全国储量的54.8%,云南、福建、河北等地次之。矿床类型主要为火山物源沉积型矿床(吉林长白、山东临胸、浙江嵊州市硅藻土矿等)和陆源沉积型(云南寻甸、四川米易硅藻土矿等)矿床。成矿时代集中在第三纪和第四纪,以第三纪为主。
无定形二氧化硅
二氧化硅的用途
二氧化硅的用途
二氧化硅的用途
光导纤维
二氧化硅的用途
危害:
在隧道开凿,石英粉加工等工作环境下易形成含有二氧化硅的粉尘,人长期吸入含有二氧化硅的粉尘,就会患硅肺病(旧称矽肺)。
物理性质:_____________________________
化学稳定性:_________________________
通常条件下,很稳定
硬度大、熔点高、难溶于水
思考
为什么二氧化硅和二氧化碳物理性质有这么大的差别?
是结构上的不同
Si
O
SiO2是由Si和O按1:2的比例组成的立体空间网状结构,没有SiO2
分子存在,只存在硅氧原子。
因此性质很稳定
CDE
下列说法错误的是(
)
A
.
SiO2
是二氧化硅的化学式
B
.
SiO2
晶体是由Si和O按1:2的比例所
组成的立体网状结构的晶体
C
.[SiO4
]
四面体只存在于二氧化硅晶体中
D
.
沙子里含无定形二氧化硅
E
.
石英就是水晶
F
.
SiO2
从古到今被人类广泛地应用着,
是因为SiO2
的立体网状结构和它在自
然界的广泛存在
化学性质很不活泼,氢氟酸(
HF)是唯一可以与之反应的酸。
SiO2+4HF=SiF4?+2H2O
化学性质:
实验室能不能用玻璃瓶盛装氢氟酸?
注意:玻璃中含有SiO2,所以可以用HF
来刻蚀玻璃。
(1)特性:
2.酸性氧化物
化学性质:
因为玻璃中含有SiO2,会与NaOH反应生成硅酸钠,使瓶塞与瓶口粘在一起而打不开。
实验室盛装NaOH溶液的试剂瓶为什么用橡胶塞而不用玻璃塞?
与碱性氧化物反应生成盐
与强碱反应生成盐和水
3、与盐反应:
(所以,不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。)
4、弱氧化性:
某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确?
SiO2与CO2化学性质的比较
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
SiO2+2NaOH=Na2SiO3+H2O
SiO2+
CaO
==
CaSiO3
高温
——
——
酸性氧化物
与碱性氧化物反应
与碱反应
与水反应
与氢氟酸反应
Na2CO3+CO2===2NaHCO3
CaCO3
+CO2
===
Ca(HCO3)2
与盐反应
性
质
二氧化碳(CO2)
二氧化硅(SiO2)
我们知道二氧化碳与水反应生成碳酸,但是SiO2不能与水直接化合成H2SiO3,这是一个特例。
思考:SiO2不能直接和水化合成H2SiO3,那怎样制备H2SiO3呢?
思考2
制取原理:强酸制弱酸
①滴入酚酞溶液呈红色
Na2SiO3+2HCl
=
H2SiO3(胶体)+2NaCl
②再滴入稀盐酸,溶液红色变浅至无色,有透明胶冻状物质产生
SiO32-
+
2H+
==
H2SiO3
(胶体)
a、Na2SiO3溶液呈碱性,b、可溶性
硅酸盐与盐酸反应生成不溶于水的硅酸,
c、先形成硅酸溶胶,后形成硅酸凝胶
现
象
结
论
方程式
离子方程式
硅酸是一种白色粉末状的固体,它不溶于水;是一种很弱的酸,不能使指示剂变色。
二、硅酸(
)
H2SiO3
硅酸钠水溶液久置在空气中会出现什
么现象?为什么?
硅酸钠水溶液久置在空气中会出现白色浑浊。因为发生下列反应:
SiO32-
+
H2O
+
CO2==
CO32-
+
H2SiO3↓
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
CO2通入下列各溶液中,无明显现象发生的是(
)
A、氯化钙溶液
B、澄清石灰水
C、硅酸钠溶液
A
合作讨论:
H2SiO3
+
2NaOH
==
Na2SiO3
+
2H2O
(2)不稳定(比H2CO3稳定),受热易分解
化学性质:
①弱酸性。只能与强碱发生中和反应
生成的硅酸逐渐聚合而形成硅酸溶胶(能流动),当硅酸的浓度较大时,就会形成硅酸凝胶(不能流动),硅酸凝胶经过干燥脱水就形成硅胶。
硅胶多孔,吸附水份能力强,常用作实验室和袋装食品,瓶装药品等的
干燥剂,也可以用
作催化剂的载体。
用途:
1、定义:
硅酸盐是由硅、氧和金属组成的化合物的总称
2、性质:
硅酸盐种类很多,是一大类结构复杂的固态物质,
大多数不溶于水,化学性质很稳定。
3、表示方法:
(1)化学式法:
适用于简单的硅酸盐如:Na2SiO3,K2SiO3、
CaSiO3等。
三、硅酸盐
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水
氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:
Na2SiO3
Na2O·SiO2
硅酸钙:
CaSiO3
CaO·SiO2
高岭石:Al2(Si2O5)(OH)4
Al2O3·2SiO2·2H2O
正长石:KAlSi3O8不能写
K2O·Al2O3·3SiO2,
应写成K2O·Al2O3·6SiO2
(2)氧化物法:
K2O·2Al2O3·6SiO2·H2O
K(Al2Si3O9)(OH)
4、最简单的硅酸盐------硅酸钠(Na2SiO3)
硅酸钠是白色固体,可溶于水,其水溶液俗称水玻璃。是制备硅胶和木材防火剂等的原料。
(1)、硅酸钠的物理性质
放入蒸馏水
现象
结论
水份蒸发后木条燃烧
放入Na2SiO3溶液
水份蒸发后
木条不燃烧
水份蒸发后
失去防火作用
防火效果好
Na2SiO3可作防火剂
[实验4-2]
(2)、硅酸钠化学性质
硅酸钠的化学性质相对稳定,不能燃烧,不易被腐蚀,热稳定性好。
(3)用途
可以作肥皂填料,还可以用做建筑、纸张的
黏合剂和木材、织物的防腐剂及防火剂
②与盐反应
①与酸反应
Na2SiO3
+
2HCl
=2NaCl
+
H2SiO3↓
CaCl2+Na2SiO3=CaSiO3+2NaCl
用途广泛的硅酸盐产品
四、硅酸盐工业
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
⑵生产过程:
黏土和石灰石
两磨、一烧。
研磨→煅烧→再磨成细粉;
⑴水泥的生产原料:
⑶普通硅酸盐水泥的成分:
1
、水泥
⑷水泥的性能:
水泥具有水硬性。
水泥、沙子和水的混合物——建筑黏合剂。
水泥、沙子和碎石的混合物。
混凝土:
水泥砂浆:
玻璃
玻璃
玻璃
有色玻璃
钢化玻璃
加入了不同的金属氧化物
普通玻璃加热接近熔化再急速冷却
2、玻璃:
⑵生产过程:
纯碱、石灰石和石英。
⑴玻璃的生产原料:
⑶普通玻璃的成分:
Na2SiO3、CaSiO3和SiO2组成
的混合物。
或Na2O·CaO·6SiO2;
玻璃无固定的熔沸点,
在一定温度范围内软化。
⑷玻璃的性能:
陶器
瓷器
3、陶瓷:
陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
家用陶瓷
江苏宜兴,
有陶都之称。
隋带烧制的三彩陶骆驼
瓷器是中华文明的象征。在许多拉丁语系国家中,“瓷器”和“中国”都以“CHINA”用同一字母拼音表示。
江西景德镇。
江西景德镇所烧制的薄胎瓷器被誉为:“洁如玉、明如镜、薄如纸、声如罄。”
我国素有“瓷都”之称的地方
江西景德镇所烧制的瓷器
传统无机非金属材料:
陶瓷、玻璃、水泥
新型无机非金属材料:
新型陶瓷
高温结构陶瓷、压电陶瓷
透明陶瓷、超导陶瓷等
五、新型无机非金属材料的特性
1.能承受高温、强度高。
例如:氮化硅陶瓷在1200℃左右的高温下,
仍具有很高的强度,可用来制造汽轮机叶
片、轴承、永久性模具等。
2.具有电学特性,一些新型无机非金属材料可以作为半导体、导体、超导体等,一些绝缘性材料常被用于集成电路的基板。
3.具有光学特性。有些新型无机非金属材料能发出各色的光,有的能透过可见光,有的能使红外线、雷达射线穿过。
处于高温下的光导纤维
F-117是一种单座战斗轰炸机。设计目的是凭隐身性能,突破敌火力网,压制敌方防空系统,摧毁严密防守的指挥所、战略要地、重要工业目标,还可执行侦察任务,具有一定空战能力。
4.
具有生物特性。有些新型无机非金属材料强度高、无毒、不溶于水,对人体组织有较好的适应性,可直接植入人体内,用这类材料制成的人造牙齿、人造骨骼,已被应用在医疗上。
人造关节
硅元素
单质硅
Si
+
F2
Si
+
HF
Si
+
NaOH
加热能与某
些非金属单
质反应(O2、Cl2)
练习:
1.下列说法正确的是(
)
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到原硅酸.
C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强.
D.二氧化硅是酸性氧化物,它不溶于任何酸
B
2.硅酸钠溶液俗称水玻璃,呈碱性.下列物质中,能用带磨口玻璃塞的试剂瓶盛放的是(
)
A.浓硫酸
B.水玻璃
C.氢氟酸
D
苛性碱
A
3.下列物质中能跟SiO2发生反应的是(
)
A
盐酸
B
硝酸
C
硫酸
D
烧碱溶液
D
4.光纤通讯是光作为信息的载体,让光在光导纤维中传输,制造光导纤维的基本原料是(
)
A
铜
B
钢
C
石英
D
铝
C
5.除去二氧化硅固体中混有的CaCO3固体,方法正确的是(
)
A
加水,过滤
B
加热
C
加盐酸,过滤
D
加NaOH溶液,过滤
C
6.将过量的CO2分别通入(1)CaCl2溶液(2)Na2SiO3溶液(3)Ca(ClO)2溶液(4)饱和Na2CO3溶液.最终溶液中有白色沉淀的是(
)
A
(1)(2)(3)(4)
B(2)(4)
C(1)
(2)(3)
D(2)(3)
B
硅元素(silicon)在地壳中的含量
氧48.6%
硅26.3%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
硅26.3%
硅的分布与存在
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
第ⅣA族的二兄弟碳和硅—豪门二杰
构成了地壳大部分岩石、沙子和土壤,
“统治了地壳”
硅是构成岩石与许多矿物的基本元素,
“
统治无机矿物界”
硅酸盐工业的陶瓷、玻璃、水泥等使人类生活日新月异
碳元素
硅元素
形成了无数种构成人类和其它地球生物等的有机物,“统治了有机界”。
煤、石油等有机化产品和材料是现代化的基石
1、存在形式
{
晶体硅
无定形硅
硅有晶体硅和无定形硅两种。
一、硅单质
2、物理性质:
晶体硅是灰黑色、有金属光泽、硬而脆的固体。晶体硅的结构类似于金刚石,熔点(1410℃)和沸点都很高,硬度大。
导电性介于导体和绝缘体之间。
思考1:硅原子最外层电子数是多少?
我们很熟悉的哪种元素最外层电子数与它相同?
硅的原子结构
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成四价的化合物。
C
②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
①常温下化学性质不活泼,只能跟F2、HF和
NaOH溶液反应。
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3+2H2↑
3
、硅单质的化学性质
工业上,用焦炭在高温下还原石英砂可制得粗硅,粗硅跟氯气反应经提纯得到
SiCl4后再用氢气还原制得纯硅:
4、硅的工业制备
硅单质
(1)反应①中焦炭做(
)
A.还原剂
B.氧化剂
C.二者都不是
(2)反应
②属于(
),反应③
属于(
)
A.化合反应
B.分解反应
C.氧化还原反应
D.非氧化还原反应
E.置换反应
A
AC
CE
SiO2+2C=Si(粗)+2CO↑
①
Si(粗)+2Cl2=SiCl4
②
SiCl4+2H2=Si(纯)+4HCl
③
根据以下反应回答下列问题:
5、用途:太阳能电池、计算机芯片以及半导体材料、信息技术等材料和人造卫星、登月车、火星探测器等动力设备新能源。
硅太阳能电池
硅芯片是各种计算机、微电子产品的核心
硅单质
硅是一种亲氧元素,在自然界它总是与氧相互化合。所以在氧化气氛包围的地球上,硅主要以熔点很高的氧化物及硅酸盐的形式存在。
二、二氧化硅和硅酸
SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
(一)、二氧化硅
1、存在
硅石(12%)
结晶形(石英晶体)
无定形——硅藻土
SiO2是硅的重要化合物。地球上存在的天然二氧化硅约占地壳质量的12%,其存在形态有结晶形和无定形两大类,通称硅石。
晶体二氧化硅
晶体二氧化硅
玛瑙
晶体二氧化硅
硅藻土
中国硅藻土资源丰富。全国10个省(区)有硅藻土矿产出。探明储量的矿区有354处,总保有储量矿石3.85亿吨。仅次于美国,居世界第2位。在地区分
布上,以吉林最多,占全国储量的54.8%,云南、福建、河北等地次之。矿床类型主要为火山物源沉积型矿床(吉林长白、山东临胸、浙江嵊州市硅藻土矿等)和陆源沉积型(云南寻甸、四川米易硅藻土矿等)矿床。成矿时代集中在第三纪和第四纪,以第三纪为主。
无定形二氧化硅
二氧化硅的用途
二氧化硅的用途
二氧化硅的用途
光导纤维
二氧化硅的用途
危害:
在隧道开凿,石英粉加工等工作环境下易形成含有二氧化硅的粉尘,人长期吸入含有二氧化硅的粉尘,就会患硅肺病(旧称矽肺)。
物理性质:_____________________________
化学稳定性:_________________________
通常条件下,很稳定
硬度大、熔点高、难溶于水
思考
为什么二氧化硅和二氧化碳物理性质有这么大的差别?
是结构上的不同
Si
O
SiO2是由Si和O按1:2的比例组成的立体空间网状结构,没有SiO2
分子存在,只存在硅氧原子。
因此性质很稳定
CDE
下列说法错误的是(
)
A
.
SiO2
是二氧化硅的化学式
B
.
SiO2
晶体是由Si和O按1:2的比例所
组成的立体网状结构的晶体
C
.[SiO4
]
四面体只存在于二氧化硅晶体中
D
.
沙子里含无定形二氧化硅
E
.
石英就是水晶
F
.
SiO2
从古到今被人类广泛地应用着,
是因为SiO2
的立体网状结构和它在自
然界的广泛存在
化学性质很不活泼,氢氟酸(
HF)是唯一可以与之反应的酸。
SiO2+4HF=SiF4?+2H2O
化学性质:
实验室能不能用玻璃瓶盛装氢氟酸?
注意:玻璃中含有SiO2,所以可以用HF
来刻蚀玻璃。
(1)特性:
2.酸性氧化物
化学性质:
因为玻璃中含有SiO2,会与NaOH反应生成硅酸钠,使瓶塞与瓶口粘在一起而打不开。
实验室盛装NaOH溶液的试剂瓶为什么用橡胶塞而不用玻璃塞?
与碱性氧化物反应生成盐
与强碱反应生成盐和水
3、与盐反应:
(所以,不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。)
4、弱氧化性:
某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确?
SiO2与CO2化学性质的比较
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
SiO2+2NaOH=Na2SiO3+H2O
SiO2+
CaO
==
CaSiO3
高温
——
——
酸性氧化物
与碱性氧化物反应
与碱反应
与水反应
与氢氟酸反应
Na2CO3+CO2===2NaHCO3
CaCO3
+CO2
===
Ca(HCO3)2
与盐反应
性
质
二氧化碳(CO2)
二氧化硅(SiO2)
我们知道二氧化碳与水反应生成碳酸,但是SiO2不能与水直接化合成H2SiO3,这是一个特例。
思考:SiO2不能直接和水化合成H2SiO3,那怎样制备H2SiO3呢?
思考2
制取原理:强酸制弱酸
①滴入酚酞溶液呈红色
Na2SiO3+2HCl
=
H2SiO3(胶体)+2NaCl
②再滴入稀盐酸,溶液红色变浅至无色,有透明胶冻状物质产生
SiO32-
+
2H+
==
H2SiO3
(胶体)
a、Na2SiO3溶液呈碱性,b、可溶性
硅酸盐与盐酸反应生成不溶于水的硅酸,
c、先形成硅酸溶胶,后形成硅酸凝胶
现
象
结
论
方程式
离子方程式
硅酸是一种白色粉末状的固体,它不溶于水;是一种很弱的酸,不能使指示剂变色。
二、硅酸(
)
H2SiO3
硅酸钠水溶液久置在空气中会出现什
么现象?为什么?
硅酸钠水溶液久置在空气中会出现白色浑浊。因为发生下列反应:
SiO32-
+
H2O
+
CO2==
CO32-
+
H2SiO3↓
Na2SiO3
+
H2O
+
CO2
==
Na2CO3
+
H2SiO3↓
CO2通入下列各溶液中,无明显现象发生的是(
)
A、氯化钙溶液
B、澄清石灰水
C、硅酸钠溶液
A
合作讨论:
H2SiO3
+
2NaOH
==
Na2SiO3
+
2H2O
(2)不稳定(比H2CO3稳定),受热易分解
化学性质:
①弱酸性。只能与强碱发生中和反应
生成的硅酸逐渐聚合而形成硅酸溶胶(能流动),当硅酸的浓度较大时,就会形成硅酸凝胶(不能流动),硅酸凝胶经过干燥脱水就形成硅胶。
硅胶多孔,吸附水份能力强,常用作实验室和袋装食品,瓶装药品等的
干燥剂,也可以用
作催化剂的载体。
用途:
1、定义:
硅酸盐是由硅、氧和金属组成的化合物的总称
2、性质:
硅酸盐种类很多,是一大类结构复杂的固态物质,
大多数不溶于水,化学性质很稳定。
3、表示方法:
(1)化学式法:
适用于简单的硅酸盐如:Na2SiO3,K2SiO3、
CaSiO3等。
三、硅酸盐
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水
氧化物前系数配置原则:除氧元素外,其他元素按配置前后原子个数守恒原则配置系数。
硅酸钠:
Na2SiO3
Na2O·SiO2
硅酸钙:
CaSiO3
CaO·SiO2
高岭石:Al2(Si2O5)(OH)4
Al2O3·2SiO2·2H2O
正长石:KAlSi3O8不能写
K2O·Al2O3·3SiO2,
应写成K2O·Al2O3·6SiO2
(2)氧化物法:
K2O·2Al2O3·6SiO2·H2O
K(Al2Si3O9)(OH)
4、最简单的硅酸盐------硅酸钠(Na2SiO3)
硅酸钠是白色固体,可溶于水,其水溶液俗称水玻璃。是制备硅胶和木材防火剂等的原料。
(1)、硅酸钠的物理性质
放入蒸馏水
现象
结论
水份蒸发后木条燃烧
放入Na2SiO3溶液
水份蒸发后
木条不燃烧
水份蒸发后
失去防火作用
防火效果好
Na2SiO3可作防火剂
[实验4-2]
(2)、硅酸钠化学性质
硅酸钠的化学性质相对稳定,不能燃烧,不易被腐蚀,热稳定性好。
(3)用途
可以作肥皂填料,还可以用做建筑、纸张的
黏合剂和木材、织物的防腐剂及防火剂
②与盐反应
①与酸反应
Na2SiO3
+
2HCl
=2NaCl
+
H2SiO3↓
CaCl2+Na2SiO3=CaSiO3+2NaCl
用途广泛的硅酸盐产品
四、硅酸盐工业
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
⑵生产过程:
黏土和石灰石
两磨、一烧。
研磨→煅烧→再磨成细粉;
⑴水泥的生产原料:
⑶普通硅酸盐水泥的成分:
1
、水泥
⑷水泥的性能:
水泥具有水硬性。
水泥、沙子和水的混合物——建筑黏合剂。
水泥、沙子和碎石的混合物。
混凝土:
水泥砂浆:
玻璃
玻璃
玻璃
有色玻璃
钢化玻璃
加入了不同的金属氧化物
普通玻璃加热接近熔化再急速冷却
2、玻璃:
⑵生产过程:
纯碱、石灰石和石英。
⑴玻璃的生产原料:
⑶普通玻璃的成分:
Na2SiO3、CaSiO3和SiO2组成
的混合物。
或Na2O·CaO·6SiO2;
玻璃无固定的熔沸点,
在一定温度范围内软化。
⑷玻璃的性能:
陶器
瓷器
3、陶瓷:
陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
家用陶瓷
江苏宜兴,
有陶都之称。
隋带烧制的三彩陶骆驼
瓷器是中华文明的象征。在许多拉丁语系国家中,“瓷器”和“中国”都以“CHINA”用同一字母拼音表示。
江西景德镇。
江西景德镇所烧制的薄胎瓷器被誉为:“洁如玉、明如镜、薄如纸、声如罄。”
我国素有“瓷都”之称的地方
江西景德镇所烧制的瓷器
传统无机非金属材料:
陶瓷、玻璃、水泥
新型无机非金属材料:
新型陶瓷
高温结构陶瓷、压电陶瓷
透明陶瓷、超导陶瓷等
五、新型无机非金属材料的特性
1.能承受高温、强度高。
例如:氮化硅陶瓷在1200℃左右的高温下,
仍具有很高的强度,可用来制造汽轮机叶
片、轴承、永久性模具等。
2.具有电学特性,一些新型无机非金属材料可以作为半导体、导体、超导体等,一些绝缘性材料常被用于集成电路的基板。
3.具有光学特性。有些新型无机非金属材料能发出各色的光,有的能透过可见光,有的能使红外线、雷达射线穿过。
处于高温下的光导纤维
F-117是一种单座战斗轰炸机。设计目的是凭隐身性能,突破敌火力网,压制敌方防空系统,摧毁严密防守的指挥所、战略要地、重要工业目标,还可执行侦察任务,具有一定空战能力。
4.
具有生物特性。有些新型无机非金属材料强度高、无毒、不溶于水,对人体组织有较好的适应性,可直接植入人体内,用这类材料制成的人造牙齿、人造骨骼,已被应用在医疗上。
人造关节
硅元素
单质硅
Si
+
F2
Si
+
HF
Si
+
NaOH
加热能与某
些非金属单
质反应(O2、Cl2)
练习:
1.下列说法正确的是(
)
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到原硅酸.
C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强.
D.二氧化硅是酸性氧化物,它不溶于任何酸
B
2.硅酸钠溶液俗称水玻璃,呈碱性.下列物质中,能用带磨口玻璃塞的试剂瓶盛放的是(
)
A.浓硫酸
B.水玻璃
C.氢氟酸
D
苛性碱
A
3.下列物质中能跟SiO2发生反应的是(
)
A
盐酸
B
硝酸
C
硫酸
D
烧碱溶液
D
4.光纤通讯是光作为信息的载体,让光在光导纤维中传输,制造光导纤维的基本原料是(
)
A
铜
B
钢
C
石英
D
铝
C
5.除去二氧化硅固体中混有的CaCO3固体,方法正确的是(
)
A
加水,过滤
B
加热
C
加盐酸,过滤
D
加NaOH溶液,过滤
C
6.将过量的CO2分别通入(1)CaCl2溶液(2)Na2SiO3溶液(3)Ca(ClO)2溶液(4)饱和Na2CO3溶液.最终溶液中有白色沉淀的是(
)
A
(1)(2)(3)(4)
B(2)(4)
C(1)
(2)(3)
D(2)(3)
B
