盐类的水解反应(第一课时)
文档属性
| 名称 | 盐类的水解反应(第一课时) |
|
|
| 格式 | rar | ||
| 文件大小 | 240.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-06-09 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
第三单元
盐类的水解
(第一课时)
专题3 溶液中的离子反应
【教材P70 5#】:
被黄蜂或蜜蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为黄蜂分泌物中含有的是一种碱性物质(主要成分为组胺、五羟色胺),而蜜蜂分泌物中含有的是一种酸性物质(主要成分是蚁酸).
【思考1】:
当黄蜂或蜜蜂叮咬后应如何利用家庭常用的物质加以处理?
被黄蜂叮咬:
在患处涂抹食醋即可.
被蜜蜂叮咬:
在患处涂抹纯碱、小苏打或肥皂水.
酸
盐 + 水
+
碱
【思考2】:
①.Na2CO3、NaHCO3和肥皂水溶液能减轻蜜蜂蛰后带来的痛楚说明了什么?
②.Na2CO3、NaHCO3和肥皂水(主要成分硬脂酸钠)属于哪类物质?
为什么Na2CO3、NaHCO3和硬脂酸钠溶液不显示为中性?
盐溶液的酸碱性如何 是否都呈中性
检测下列溶液的酸碱性 , 填写下表:
被测溶液 盐的类型 pH试纸颜色 pH值 酸碱性
NaCl
Na2CO3
NH4Cl
CH3COONa
AlCl3
中性
碱性
碱性
酸性
酸性
【活动与探究】P79
=7
<7
<7
>7
>7
强酸强碱盐
弱酸强碱盐
强酸弱碱盐
弱酸强碱盐
强酸弱碱盐
溶液的酸碱性怎样判断?
为什么有些盐溶液显酸碱性
【质疑1】同样为盐溶液,CH3COONa、NaCl、NH4Cl三种溶液,却表现出不同的酸碱性,其根本原因是什么?与生成该盐的酸和碱的强弱间有什么关系?
【质疑2】OH-与H+毫无疑问都来自于水的电离;按理说,由水电离出来的H+和OH-的物质的量浓度总是相等的, 即c(OH-)=c(H+),为什么某些盐溶液中会出现不相等的情况呢?
【质疑3】溶液中盐的离子是不是都参与了反应? 具有什么样条件的离子才能反应,反应造成的结果是什么?
学生阅读课本P79-P80
(1).试推测Na2CO3溶液显碱性原因.
【活动探究】:
推测Ⅰ:水能电离出OH-,使溶液显碱性.
推测Ⅱ:碳酸钠本身具有碱性.
推测Ⅲ:碳酸钠与水反应的生成物具有碱性.
(2).对比实验:
实验Ⅰ:
H2O+酚酞.
实验Ⅱ:
Na2CO3的乙醇溶液+酚酞.
实验Ⅱ混合液+H2O.
实验Ⅲ:
无色
无色
红色
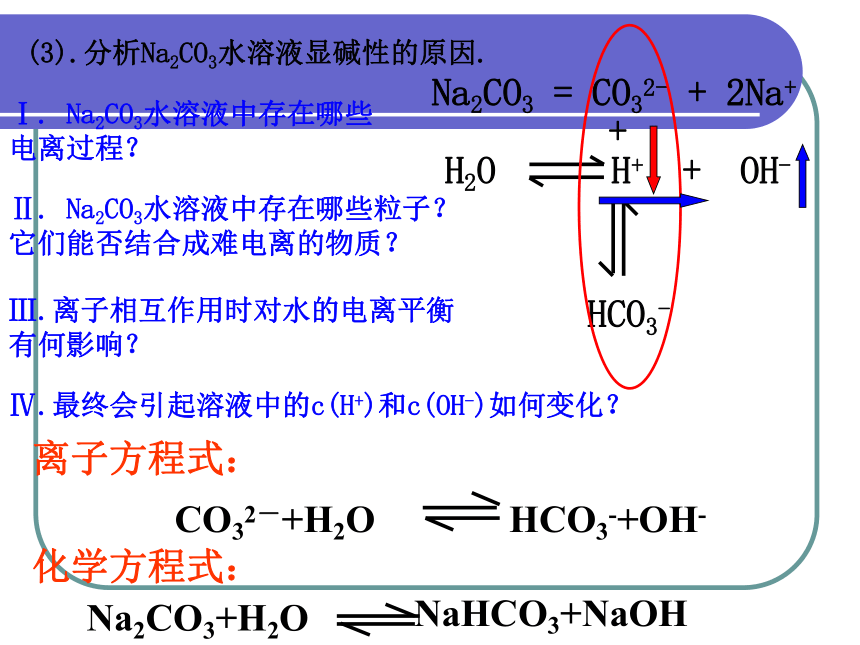
Na2CO3 = CO32- + 2Na+
+
HCO3-
H2O H+ + OH-
Na2CO3+H2O
NaHCO3+NaOH
化学方程式:
CO32-+H2O HCO3-+OH-
离子方程式:
(3).分析Na2CO3水溶液显碱性的原因.
Ⅰ. Na2CO3水溶液中存在哪些电离过程?
Ⅱ. Na2CO3水溶液中存在哪些粒子?它们能否结合成难电离的物质?
Ⅲ.离子相互作用时对水的电离平衡有何影响?
Ⅳ.最终会引起溶液中的c(H+)和c(OH-)如何变化?
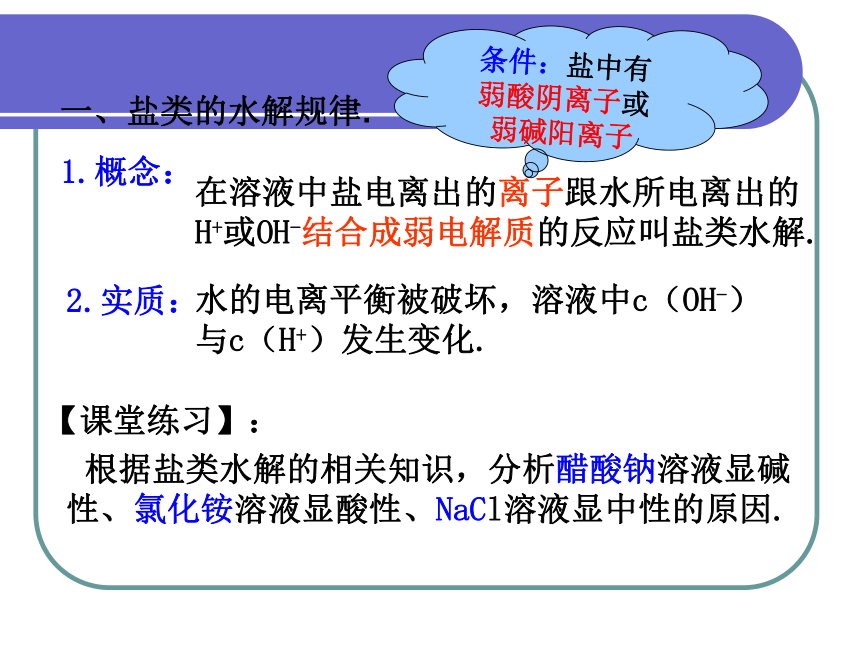
一、盐类的水解规律.
1.概念:
在溶液中盐电离出的离子跟水所电离出的H+或OH-结合成弱电解质的反应叫盐类水解.
2.实质:
水的电离平衡被破坏,溶液中c(OH-)与c(H+)发生变化.
条件:盐中有
弱酸阴离子或
弱碱阳离子
根据盐类水解的相关知识,分析醋酸钠溶液显碱性、氯化铵溶液显酸性、NaCl溶液显中性的原因.
【课堂练习】:
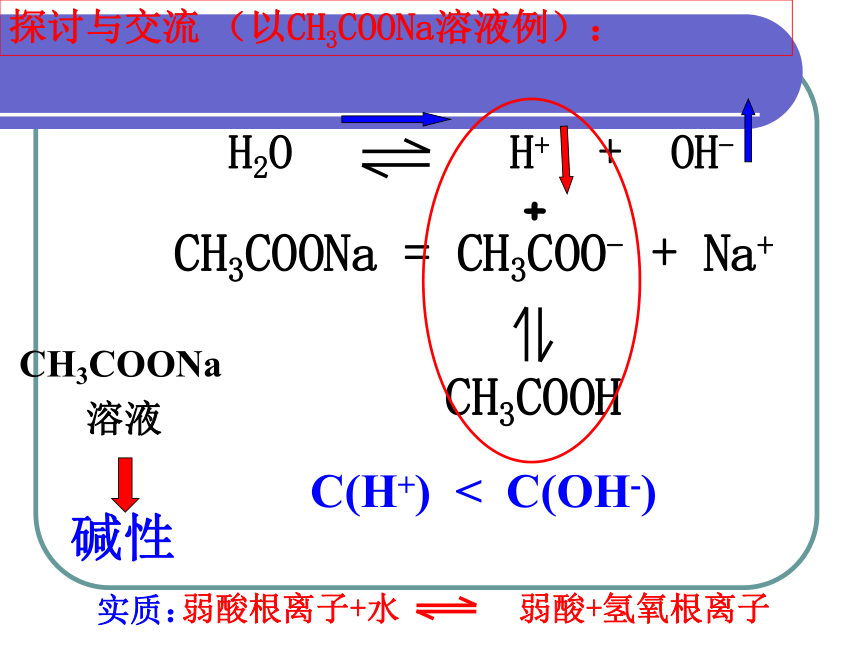
CH3COONa = CH3COO- + Na+
+
CH3COOH
探讨与交流 (以CH3COONa溶液例):
C(H+) < C(OH-)
碱性
CH3COONa
溶液
H2O H+ + OH-
实质:
弱酸根离子+水 弱酸+氢氧根离子
NH4Cl = NH4+ + Cl-
+
NH3·H2O
H2O OH- + H+
探讨与交流 (以NH4Cl溶液为例):
酸性
NH4Cl溶液
C(OH-) < C(H+)
NaCl溶液的情况又如何呢 ?
实质:
弱碱阳离子+水 弱碱+氢离子
盐类水解
H2O H + + OH -
CH3COONa = Na+ + CH3COO-
NH4Cl = Cl- + NH4+
结合CH3COONa和NH4Cl的水解机理,分析归纳。
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解,
条件—
结果—
盐类水解的规律
越弱越水解,
都弱双水解。
程度—
3、水解的特点:
⑴是中和反应的逆反应,存在水解平衡;
盐 + 水 酸 + 碱
水解
中和
⑵吸热反应,溶质微粒数增多;
(3)水解程度很小,故水解产物较少,盐溶液的酸碱性一般较弱。
CH3COO - + H2O CH3COOH + OH- △H>0
1、盐类水解反应与中和反应的关系如何?
2、水解反应过程是吸热反应还是放热反应呢?
1. 下列溶液PH小于7的是
A、 KBr B、 CuSO4 C、NaF D、Ba(NO3)2
2. 下列溶液能使酚酞指示剂显红色的是
A 、 K2CO3 B、 NaHSO4 C、 Na2S D、 FeCl3
3.下列离子在水溶液中不会发生水解的是
A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4. 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +
习 题 1:
下列盐的水溶液中,离子浓度比正确的是:
D、NaF c(Na+) : c(F-) < 1 : 1
B、K2SO4 c(K+) : c(SO42-) = 2 : 1
C、(NH4)2SO4 c(NH4+) : c(SO42-) < 2 : 1
A、NaClO c(Na+) : c(ClO-) = 1 : 1
习 题 2 :
B C
能力提高:
1、若某盐溶液呈中性,能否判断该盐未发生水解反应?该盐可能是什么盐?为什么?(结合CH3COO NH4为例思考)
2、酸式盐的水溶液一定显酸性吗?(结合NaHSO4 、 NaH2PO4、 NaHPO4 、NaHCO3 、 NaHS 等为例思考)
思考……
NaHSO3 NaH2PO4
NaHSO4
电离程度大于水解,显酸性;
NaHCO3、 Na2HPO4、NaHS
水解程度大于电离,显碱性;
越弱越水解 !
【练一练】书写下列物质水解的方程式:
NaClO、Na2S、
NH4NO3、CuCl2
Mg3N2
4、水解反应的方程式书写
A、一般用“ ”
B、一般不用“ ↑、↓ ”
C、多元弱酸根离子的水解分步写,一般只写第一步
D、多元弱碱阳离子的水解一步到位
E、双水解进行到底的,用“=、↑、↓”均一步到位
F、多元弱酸的酸式酸根离子水解与电离共存
5、水解平衡的影响因素
(一)内因:盐的本性(越弱越水解)
其酸性越弱
酸越难电离
酸根离子与H+的
结 合 能 力 越 强
水解后OH-浓度越大
溶液碱性越强
pH值越大
①不同弱酸对应的盐
NaClO> NaHCO3
NH4Cl< MgCl2对应的酸
HClO碱 性
②不同弱碱对应的盐
对应的碱
酸 性
NH3 · H2O >Mg(OH)2>Al(OH)3
③同一弱酸对应的盐
碱 性
对应的酸
Na2CO3 > NaHCO3
HCO3 -∴ 正盐的水解程度>酸式盐的水解程度
④多元弱酸对应的酸式盐:
一般来说,水解趋势大于电离趋势。
pH值:
Na2SO3>Na2SO4 >NaHSO3 >NaHSO4
Na3PO4>Na2HPO4>NaH2PO4 >H3PO4
( NaH2PO4和NaHSO3 例外)
讨论:
比较同浓度的下列各组溶液pH值的大小(提示:变价阳离子,价态越高,越易水解。)
Na2CO3 ___ CH3COONa ;
B.AlCl3 ___MgCl2
C.NaHCO3 ___ Na2CO3 ;
D.FeCl2 ___FeCl3
>
<
<
>
⑤弱酸弱碱盐:
水解程度较大。
(能生成沉淀或气体的双水解可以 进行到底。)
(二)外因:符合勒夏特列原理。
水解反应的特点:
①吸热; ②溶质微粒数增多。(与电离过程相同)
①温度:
升温促进水解,降温抑制水解。
CH3COONa的酚酞溶液加热后颜色:
加深
CH3COO - +H2O CH3COOH+OH- △H>0
②浓度:
Al3+ + 3H2O Al(OH)3 + 3 H+ △H>0
1
4
加水稀释,促进水解, c(H+)减小
加AlCl3固体,促进水解, c(H+)增大
作业:
1 判断下列溶液的酸碱性,能水解的写出其水解离子方程式
(1)FeCl3 (2) NaF (3)CuSO4
(4)K2CO3 (5) KI (6)Al2(SO4)3
(7) (8)Al2S3
第三单元
盐类的水解
(第一课时)
专题3 溶液中的离子反应
【教材P70 5#】:
被黄蜂或蜜蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为黄蜂分泌物中含有的是一种碱性物质(主要成分为组胺、五羟色胺),而蜜蜂分泌物中含有的是一种酸性物质(主要成分是蚁酸).
【思考1】:
当黄蜂或蜜蜂叮咬后应如何利用家庭常用的物质加以处理?
被黄蜂叮咬:
在患处涂抹食醋即可.
被蜜蜂叮咬:
在患处涂抹纯碱、小苏打或肥皂水.
酸
盐 + 水
+
碱
【思考2】:
①.Na2CO3、NaHCO3和肥皂水溶液能减轻蜜蜂蛰后带来的痛楚说明了什么?
②.Na2CO3、NaHCO3和肥皂水(主要成分硬脂酸钠)属于哪类物质?
为什么Na2CO3、NaHCO3和硬脂酸钠溶液不显示为中性?
盐溶液的酸碱性如何 是否都呈中性
检测下列溶液的酸碱性 , 填写下表:
被测溶液 盐的类型 pH试纸颜色 pH值 酸碱性
NaCl
Na2CO3
NH4Cl
CH3COONa
AlCl3
中性
碱性
碱性
酸性
酸性
【活动与探究】P79
=7
<7
<7
>7
>7
强酸强碱盐
弱酸强碱盐
强酸弱碱盐
弱酸强碱盐
强酸弱碱盐
溶液的酸碱性怎样判断?
为什么有些盐溶液显酸碱性
【质疑1】同样为盐溶液,CH3COONa、NaCl、NH4Cl三种溶液,却表现出不同的酸碱性,其根本原因是什么?与生成该盐的酸和碱的强弱间有什么关系?
【质疑2】OH-与H+毫无疑问都来自于水的电离;按理说,由水电离出来的H+和OH-的物质的量浓度总是相等的, 即c(OH-)=c(H+),为什么某些盐溶液中会出现不相等的情况呢?
【质疑3】溶液中盐的离子是不是都参与了反应? 具有什么样条件的离子才能反应,反应造成的结果是什么?
学生阅读课本P79-P80
(1).试推测Na2CO3溶液显碱性原因.
【活动探究】:
推测Ⅰ:水能电离出OH-,使溶液显碱性.
推测Ⅱ:碳酸钠本身具有碱性.
推测Ⅲ:碳酸钠与水反应的生成物具有碱性.
(2).对比实验:
实验Ⅰ:
H2O+酚酞.
实验Ⅱ:
Na2CO3的乙醇溶液+酚酞.
实验Ⅱ混合液+H2O.
实验Ⅲ:
无色
无色
红色
Na2CO3 = CO32- + 2Na+
+
HCO3-
H2O H+ + OH-
Na2CO3+H2O
NaHCO3+NaOH
化学方程式:
CO32-+H2O HCO3-+OH-
离子方程式:
(3).分析Na2CO3水溶液显碱性的原因.
Ⅰ. Na2CO3水溶液中存在哪些电离过程?
Ⅱ. Na2CO3水溶液中存在哪些粒子?它们能否结合成难电离的物质?
Ⅲ.离子相互作用时对水的电离平衡有何影响?
Ⅳ.最终会引起溶液中的c(H+)和c(OH-)如何变化?
一、盐类的水解规律.
1.概念:
在溶液中盐电离出的离子跟水所电离出的H+或OH-结合成弱电解质的反应叫盐类水解.
2.实质:
水的电离平衡被破坏,溶液中c(OH-)与c(H+)发生变化.
条件:盐中有
弱酸阴离子或
弱碱阳离子
根据盐类水解的相关知识,分析醋酸钠溶液显碱性、氯化铵溶液显酸性、NaCl溶液显中性的原因.
【课堂练习】:
CH3COONa = CH3COO- + Na+
+
CH3COOH
探讨与交流 (以CH3COONa溶液例):
C(H+) < C(OH-)
碱性
CH3COONa
溶液
H2O H+ + OH-
实质:
弱酸根离子+水 弱酸+氢氧根离子
NH4Cl = NH4+ + Cl-
+
NH3·H2O
H2O OH- + H+
探讨与交流 (以NH4Cl溶液为例):
酸性
NH4Cl溶液
C(OH-) < C(H+)
NaCl溶液的情况又如何呢 ?
实质:
弱碱阳离子+水 弱碱+氢离子
盐类水解
H2O H + + OH -
CH3COONa = Na+ + CH3COO-
NH4Cl = Cl- + NH4+
结合CH3COONa和NH4Cl的水解机理,分析归纳。
无弱不水解。
谁强显谁性,
同强显中性。
有弱才水解,
条件—
结果—
盐类水解的规律
越弱越水解,
都弱双水解。
程度—
3、水解的特点:
⑴是中和反应的逆反应,存在水解平衡;
盐 + 水 酸 + 碱
水解
中和
⑵吸热反应,溶质微粒数增多;
(3)水解程度很小,故水解产物较少,盐溶液的酸碱性一般较弱。
CH3COO - + H2O CH3COOH + OH- △H>0
1、盐类水解反应与中和反应的关系如何?
2、水解反应过程是吸热反应还是放热反应呢?
1. 下列溶液PH小于7的是
A、 KBr B、 CuSO4 C、NaF D、Ba(NO3)2
2. 下列溶液能使酚酞指示剂显红色的是
A 、 K2CO3 B、 NaHSO4 C、 Na2S D、 FeCl3
3.下列离子在水溶液中不会发生水解的是
A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
4. 氯化铵溶液中离子浓度从大到小排列正确的是:
A NH4+ 、H + 、OH-、Cl_ B Cl _ 、 NH4+ 、H + 、OH _
C H +、 Cl_ 、 NH4+ 、OH _ D Cl、 NH4+ 、 OH- 、H +
习 题 1:
下列盐的水溶液中,离子浓度比正确的是:
D、NaF c(Na+) : c(F-) < 1 : 1
B、K2SO4 c(K+) : c(SO42-) = 2 : 1
C、(NH4)2SO4 c(NH4+) : c(SO42-) < 2 : 1
A、NaClO c(Na+) : c(ClO-) = 1 : 1
习 题 2 :
B C
能力提高:
1、若某盐溶液呈中性,能否判断该盐未发生水解反应?该盐可能是什么盐?为什么?(结合CH3COO NH4为例思考)
2、酸式盐的水溶液一定显酸性吗?(结合NaHSO4 、 NaH2PO4、 NaHPO4 、NaHCO3 、 NaHS 等为例思考)
思考……
NaHSO3 NaH2PO4
NaHSO4
电离程度大于水解,显酸性;
NaHCO3、 Na2HPO4、NaHS
水解程度大于电离,显碱性;
越弱越水解 !
【练一练】书写下列物质水解的方程式:
NaClO、Na2S、
NH4NO3、CuCl2
Mg3N2
4、水解反应的方程式书写
A、一般用“ ”
B、一般不用“ ↑、↓ ”
C、多元弱酸根离子的水解分步写,一般只写第一步
D、多元弱碱阳离子的水解一步到位
E、双水解进行到底的,用“=、↑、↓”均一步到位
F、多元弱酸的酸式酸根离子水解与电离共存
5、水解平衡的影响因素
(一)内因:盐的本性(越弱越水解)
其酸性越弱
酸越难电离
酸根离子与H+的
结 合 能 力 越 强
水解后OH-浓度越大
溶液碱性越强
pH值越大
①不同弱酸对应的盐
NaClO> NaHCO3
NH4Cl< MgCl2
HClO
②不同弱碱对应的盐
对应的碱
酸 性
NH3 · H2O >Mg(OH)2>Al(OH)3
③同一弱酸对应的盐
碱 性
对应的酸
Na2CO3 > NaHCO3
HCO3 -
④多元弱酸对应的酸式盐:
一般来说,水解趋势大于电离趋势。
pH值:
Na2SO3>Na2SO4 >NaHSO3 >NaHSO4
Na3PO4>Na2HPO4>NaH2PO4 >H3PO4
( NaH2PO4和NaHSO3 例外)
讨论:
比较同浓度的下列各组溶液pH值的大小(提示:变价阳离子,价态越高,越易水解。)
Na2CO3 ___ CH3COONa ;
B.AlCl3 ___MgCl2
C.NaHCO3 ___ Na2CO3 ;
D.FeCl2 ___FeCl3
>
<
<
>
⑤弱酸弱碱盐:
水解程度较大。
(能生成沉淀或气体的双水解可以 进行到底。)
(二)外因:符合勒夏特列原理。
水解反应的特点:
①吸热; ②溶质微粒数增多。(与电离过程相同)
①温度:
升温促进水解,降温抑制水解。
CH3COONa的酚酞溶液加热后颜色:
加深
CH3COO - +H2O CH3COOH+OH- △H>0
②浓度:
Al3+ + 3H2O Al(OH)3 + 3 H+ △H>0
1
4
加水稀释,促进水解, c(H+)减小
加AlCl3固体,促进水解, c(H+)增大
作业:
1 判断下列溶液的酸碱性,能水解的写出其水解离子方程式
(1)FeCl3 (2) NaF (3)CuSO4
(4)K2CO3 (5) KI (6)Al2(SO4)3
(7) (8)Al2S3
