江苏省徐州市2019-2020学年高一下学期期末抽测化学试题
文档属性
| 名称 | 江苏省徐州市2019-2020学年高一下学期期末抽测化学试题 |  | |
| 格式 | doc | ||
| 文件大小 | 374.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-18 21:52:13 | ||
图片预览



文档简介
2019~2020学年度第二学期期末抽测
高一化学试题
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Mg 24 Al 27 C1 35.5 Zn 65
选择题
单项选择题:本题包括15小题,每小题3分,共计45分。每小题只有一个选项符合题意。
1.新型冠状病毒对人类健康构成严重威胁。下列物质或方法不能对新型冠状病毒消毒的是
A.生理盐水 B.高温蒸煮 C.医用酒精 D.次氯酸钠溶液
2.下列关于元素周期表、元素周期律的说法正确的是
A.元素周期表有8个周期 B. IA族元素均为金属元素
C.铝元素的主族序数与其周期数相等 D.稀有气体元素原子的最外层电子数均为8
3.下列含有共价键的离子化合物是
A. MgCl2 B. KOH . C. NH3·H2O D. C8H12O6 (葡萄糖)
4.反应NH4Cl+NaNO2==NaCl + N2↑+2H2O放热且产生气体。下列表示反应中相关微粒的
化学用语正确的是
A.中子数为12的钠原子: B. N2的结构式: N=N
C. O2-的结构示意图: D. NaCl 的电子式:
5.下列各组物质发生的变化中,所克服的微粒间的作用力属同种类型的是
A.蔗糖和食盐溶于水 B.碘和干冰的升华
C.金刚石和冰的熔融 D.石英和生石灰的熔化
6.有机化合物种类丰富,数量繁多。乙醇和二甲醚的结构式如下图所示: .
乙醇 二甲醚
下列关于上述两种物质的说法正确的是
A.分子式不同 B.碳氧键(C-O)数目相同
C.互为同分异构体 D.性质完全相同
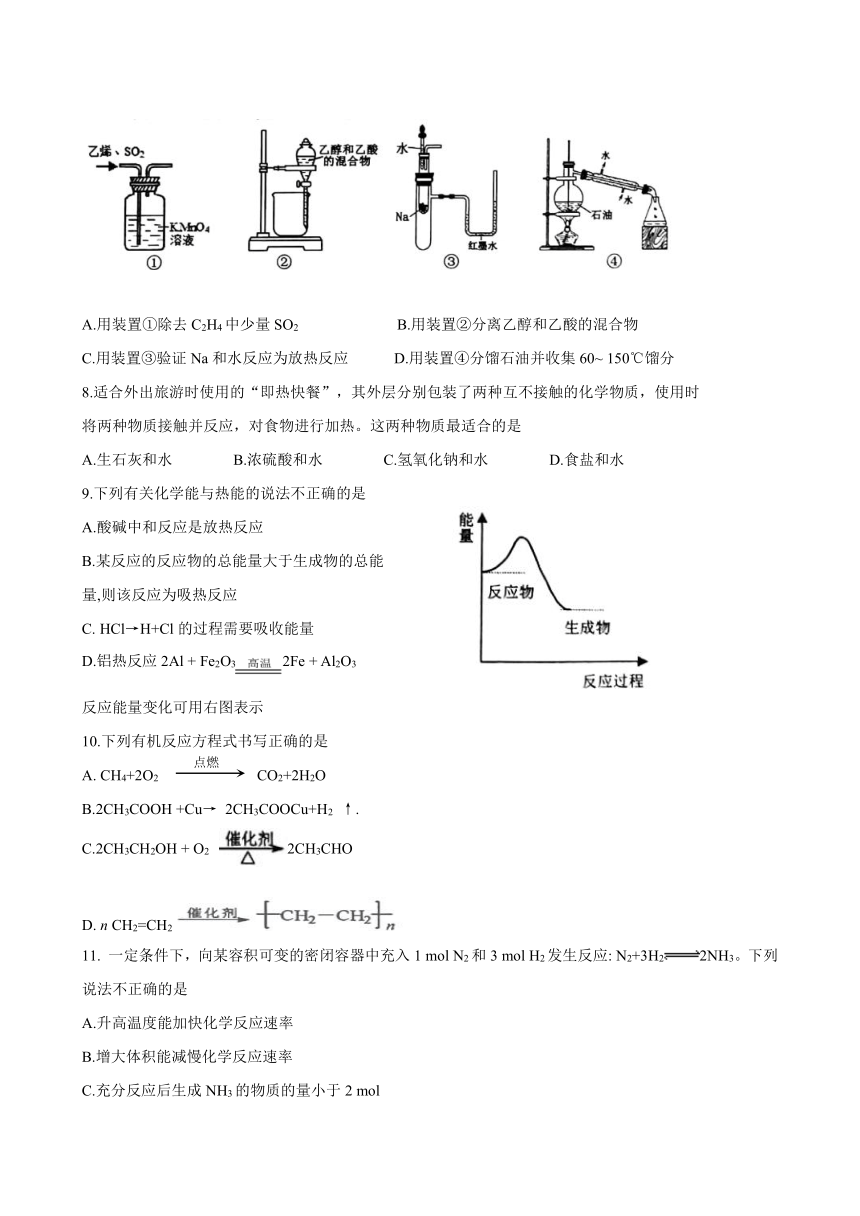
7.用下列实验装置进行相应实验,能达到实验目的的是
A.用装置①除去C2H4中少量SO2 B.用装置②分离乙醇和乙酸的混合物
C.用装置③验证Na和水反应为放热反应 D.用装置④分馏石油并收集60~ 150℃馏分
8.适合外出旅游时使用的“即热快餐”,其外层分别包装了两种互不接触的化学物质,使用时
将两种物质接触并反应,对食物进行加热。这两种物质最适合的是
A.生石灰和水 B.浓硫酸和水 C.氢氧化钠和水 D.食盐和水
9.下列有关化学能与热能的说法不正确的是
A.酸碱中和反应是放热反应
B.某反应的反应物的总能量大于生成物的总能
量,则该反应为吸热反应
C. HCl→H+Cl的过程需要吸收能量
D.铝热反应2Al + Fe2O32Fe + Al2O3
反应能量变化可用右图表示
10.下列有机反应方程式书写正确的是
A. CH4+2O2 CO2+2H2O
B.2CH3COOH +Cu→ 2CH3COOCu+H2 ↑.
C.2CH3CH2OH + O2 2CH3CHO
D. n CH2=CH2
11. 一定条件下,向某容积可变的密闭容器中充入1 mol N2和3 mol H2发生反应: N2+3H22NH3。下列说法不正确的是
A.升高温度能加快化学反应速率
B.增大体积能减慢化学反应速率
C.充分反应后生成NH3的物质的量小于2 mol
D.达到化学平衡状态时,v(H2)正 =v(NH3)逆
12.某同学利用家中废旧材料制作可使扬声器发出声音的电池,装置如下图所示。下列说法不正
确的是
A.扬声器发声,说明该装置将电能转化为化学能
B.铝质易拉罐逐渐被腐蚀,说明铝失去电子
C.在碳棒.上有气体生成,该气体可能为氢气
D.电子由铝制易拉罐经导线流向碳棒
13. 下列有关糖、油脂、蛋白质说法中正确的是
A.油脂在酸性条件下的水解反应又叫做皂化反应
B.饱和硫酸钠溶液可使蛋白质凝聚并失去生理功能
C.糖类、油脂、蛋白质均可以在一 定条件下发生水解
D.成熟苹果的汁液中含葡萄糖,可在一定的条件下和银氨溶液发生银镜反应
14.下列关于乙烯的说法错误的是
A.乙烯是最简单的烯烃 B.乙烯分子中的6个原子共平面
C.石油裂化是工业制乙烯的主要方法 D.乙烯能和溴水发生加成反应
15.下列关于乙酸的说法正确的是
A.分子式为C2H6O2 B.官能团为羧基
C.一种无色无味的液体 D.水溶液的pH大于7
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有-个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
16.下列说法中正确的是
A.石油的分馏、煤的气化和液化都是化学变化
B.制口單熔喷布的聚丙烯可由丙烯通过加聚反应生成
C.煤在空气中燃烧可生成水、一氧化碳和二氧化碳等
D.在汽油里加入适量乙醇制成的“乙醇汽油”是一种新型化合物
17.下列条件中,锌和硫酸开始反应时放出氢气的速率最大的是
选项 金属 酸溶液的浓度和体积 温度/℃
A 2.4g锌片 3 mol·L-1硫酸50 mL 40
B 2.4g锌粉 1 mol·L-1硫酸2000 mL 30
C 2.4g锌粉 3 mol·L-1硫酸50 mL 40
D 2.4g锌片 3 mol·L-1硫酸100 mL 30
18.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A 将盐酸滴入CaCO3中,产生的气体通入澄清石灰水,澄清石灰水变浑浊 盐酸的酸性强于碳酸
B 在两支试管中,分别放入除去氧化膜的大小相
同的镁条和铝条,再分别加入2 mL 2 mol·L-1
的盐酸,前者反应快 镁元素的金属性强于铝元素
C 向4 mL淀粉溶液中加入少量H2SO4溶液,加
热4~5min,然后调节溶液呈碱性,再加入新
制Cu(OH)2悬浊液,加热,出现砖红色沉淀 淀粉已经完全水解
D 向某乙醇中加入一小块金属钠,有气泡生成 该乙醇中含有一定量的水
19.短周期主族元素W、R、X、Y、Z的原子序数依次增大,W的原子半径是周期表中所有元素中最小的,R是地壳中含量最多的元素,X与W同主族,Y的最外层电子数是最内层电子数的3倍。
下列说法正确的是
A.原子半径: RY
C. R与X只能形成一种化合物 D.最高价氧化物的水化物的酸性: Z>Y
20.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
事实 推测
A Si是半导体材料,同族Ge也是半导体材料 IVA族的元素都是半导体材料
B Mg与水反应缓慢,Ca与水反应较快 Ba ( IIA族)与水反应更快
C HCI在1500℃时分解,HI在230℃时分解 HBr的分解温度介于二者之间
D H2SO4是强酸,HClO4也是强酸 H3PO4属于强酸
非选择题
21. (8分) X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
元素 相关信息
X 它的一种同位素被用作相对原子质量的标准
Y 常温下单质为双原子分子,分子中含有3对共用电子对
Z 是短周期中(除稀有气体外)原子半径最大的元素
Q 最外层电子数是次外层电子数的3倍
W 原子序数等于X、Y原子序数之和
R 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化
(1)元素X在元素周期表中的位置是 。
(2).上述六种元素中有2种元素能形成--种淡黄色的固体化合物,该化合物的电子式是 , 所含化学键的类型有离子键、
(3) Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为
(4).上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是 , 发生反应的离子方程式是
22. (8 分)丙烯酸乙酯具有菠萝香味,可用作食品添加剂。工业上可以用乙烯、丙烯等为原料合成制得。
(1)由CH2=CH2生成有机物A (分子式为C2H6O)的反应类型是 。
(2)丙烯酸乙酯(CH2=CH-COOCH2CH3)中含氧官能团的名称 。
(3)有机物B的结构简式为 ; 根据乙烯和乙酸的结构及性质进行类比,关于有机物B
的说法正确的是 。
a.有机物B与CH3COOH含有的官能团完全相同
b.可以与NaHCO3溶液反应放出CO2气体
c.在一定条件下可以发生酯化、加成、氧化反应
(4)有机物A、B反应生成丙烯酸乙酯的反应在实验室中可在如图装置中进行。
①该反应的化学方程式是
②试管乙中试剂的名称是 , 若要将制得的产物分离出来,采用的实验操作是 (填名称)。
23. (8分)某学生为探究锌与盐酸反应过程中的速率变化,在TC时,向100 mL 2 mol·L-1盐酸中加
入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时间(min) 1 2 3 4 5
氢气体积(mL) 50 120 232 290 310
(1)①在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为 .
②在0~5min内,反应速率最大的时间段是 (填 “1~2 min”、“2~3 min”或“3~4 min”)。
(2)若完全反应后放出15.2 kJ的热量,则反应Zn(s) + 2HCl(aq) = = ZnCl2(aq) + H2(g)的△H=
(3)为了减缓反应速率但不减少产生气体的量,可向反应物中分别加入等体积的下列液体,你认为可行的
是 (填字母) 。
a.蒸馏水 b. Na2CO3溶液 c. NaNO3溶液
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,
该同学操作 (填 “合理”或“不合理”),理由是
24. (11 分) CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是 。已知25℃、101 kPa时,1 mol甲烷完全燃烧生成CO2和
液态水时放出896 kJ热量,则甲烷的热值为 kJ·g-1
(2)一定温度下,在偏铝酸亚铜(CuAlO2) 的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,写出反应的化学方程式 ,
其优点是 (请写出一条)。
(3)甲烷可以消除氮氧化物污染。如: CH4(g)+2NO(g) N2(g) + CO2(g) + 2H2O(g)。
①下列措施能够加快化学反应速率的是 。
a.使用催化剂 b.降低温度 c.及时分离水
②若上述反应在恒容密闭容器中进行,则下列叙述能说明该反应达平衡的是 .
a.混合气体的质量不再变化 b. c(NO2) = 2c(N2)
c.单位时间内生成1 mol CO2,同时生成2 mol NO2
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
①b极电极反应式为 。
②若燃料电池消耗的空气在标准状况下的体积是5.6L (假设空气中O2体积分数为20%), 则理论上消耗
甲烷 mol.
2019~2020学年度第二学期期末抽测
高一化学试题参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其它合理答案的也给分。
一、共45分。每小题3分。每小题只有一个选项符合题意。
1.A 2.C 3.B 4.D 5.B 6.C 7.C 8.A 9.B 10.A 11.D 12.A 13.D 14.C 15.B
二、共20分。每小题4分。每小题每小题有一个或两个选项符合题意。
16.BC 17.C 18.B 19.BD 20.AD
三、共35分。
21.共8分。
(1)第2周期IVA族(1分) (2)(1分) 共价键(1分)
(3)H-O-H(1分) (4)S(硫)(1分)
(5)产生白色沉淀(1分)
H2SO3+2OH-+Ba2+=BaSO3↓ +2H2O或SO2+2OH-+Ba2+=BaSO3↓ +H2O(2分)
22.共8分。
(1)加成反应(1分) (2)酯基(1分)
(3)CH2=CHCOOH(1分) bc(1分)
(4)①C2H5OH + CH2=CHCOOH,\s\up8(浓硫酸),\s\do7(Δ))CH2=CHCOOC2H5 + H2O(2分)
②饱和碳酸钠溶液(1分) 分液(1分)
23.共8分。
(1)①0.1 mol·L-1·min-1 (2分) ②2~3min(1分)
(2)—152 kJ·mol-1(1分) (3)a(1分)
(4)合理(1分)
锌和置换出的铜构成原电池,加快反应速率;锌过量,不影响生产气体的量。(答案合理即可)(2分)
24.共11分。
(1)提供CH4分解所需的能量(1分) 56(1分)
(2)CH4+CO2CH3COOH (2分) 原子转化率100%(或符合绿色化学理念)(1分)
(3)①a(1分) ②c(1分)
(4)①O2 + 4e-=2O2-(2分) ②0.025(2分)
高一化学试题
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Mg 24 Al 27 C1 35.5 Zn 65
选择题
单项选择题:本题包括15小题,每小题3分,共计45分。每小题只有一个选项符合题意。
1.新型冠状病毒对人类健康构成严重威胁。下列物质或方法不能对新型冠状病毒消毒的是
A.生理盐水 B.高温蒸煮 C.医用酒精 D.次氯酸钠溶液
2.下列关于元素周期表、元素周期律的说法正确的是
A.元素周期表有8个周期 B. IA族元素均为金属元素
C.铝元素的主族序数与其周期数相等 D.稀有气体元素原子的最外层电子数均为8
3.下列含有共价键的离子化合物是
A. MgCl2 B. KOH . C. NH3·H2O D. C8H12O6 (葡萄糖)
4.反应NH4Cl+NaNO2==NaCl + N2↑+2H2O放热且产生气体。下列表示反应中相关微粒的
化学用语正确的是
A.中子数为12的钠原子: B. N2的结构式: N=N
C. O2-的结构示意图: D. NaCl 的电子式:
5.下列各组物质发生的变化中,所克服的微粒间的作用力属同种类型的是
A.蔗糖和食盐溶于水 B.碘和干冰的升华
C.金刚石和冰的熔融 D.石英和生石灰的熔化
6.有机化合物种类丰富,数量繁多。乙醇和二甲醚的结构式如下图所示: .
乙醇 二甲醚
下列关于上述两种物质的说法正确的是
A.分子式不同 B.碳氧键(C-O)数目相同
C.互为同分异构体 D.性质完全相同
7.用下列实验装置进行相应实验,能达到实验目的的是
A.用装置①除去C2H4中少量SO2 B.用装置②分离乙醇和乙酸的混合物
C.用装置③验证Na和水反应为放热反应 D.用装置④分馏石油并收集60~ 150℃馏分
8.适合外出旅游时使用的“即热快餐”,其外层分别包装了两种互不接触的化学物质,使用时
将两种物质接触并反应,对食物进行加热。这两种物质最适合的是
A.生石灰和水 B.浓硫酸和水 C.氢氧化钠和水 D.食盐和水
9.下列有关化学能与热能的说法不正确的是
A.酸碱中和反应是放热反应
B.某反应的反应物的总能量大于生成物的总能
量,则该反应为吸热反应
C. HCl→H+Cl的过程需要吸收能量
D.铝热反应2Al + Fe2O32Fe + Al2O3
反应能量变化可用右图表示
10.下列有机反应方程式书写正确的是
A. CH4+2O2 CO2+2H2O
B.2CH3COOH +Cu→ 2CH3COOCu+H2 ↑.
C.2CH3CH2OH + O2 2CH3CHO
D. n CH2=CH2
11. 一定条件下,向某容积可变的密闭容器中充入1 mol N2和3 mol H2发生反应: N2+3H22NH3。下列说法不正确的是
A.升高温度能加快化学反应速率
B.增大体积能减慢化学反应速率
C.充分反应后生成NH3的物质的量小于2 mol
D.达到化学平衡状态时,v(H2)正 =v(NH3)逆
12.某同学利用家中废旧材料制作可使扬声器发出声音的电池,装置如下图所示。下列说法不正
确的是
A.扬声器发声,说明该装置将电能转化为化学能
B.铝质易拉罐逐渐被腐蚀,说明铝失去电子
C.在碳棒.上有气体生成,该气体可能为氢气
D.电子由铝制易拉罐经导线流向碳棒
13. 下列有关糖、油脂、蛋白质说法中正确的是
A.油脂在酸性条件下的水解反应又叫做皂化反应
B.饱和硫酸钠溶液可使蛋白质凝聚并失去生理功能
C.糖类、油脂、蛋白质均可以在一 定条件下发生水解
D.成熟苹果的汁液中含葡萄糖,可在一定的条件下和银氨溶液发生银镜反应
14.下列关于乙烯的说法错误的是
A.乙烯是最简单的烯烃 B.乙烯分子中的6个原子共平面
C.石油裂化是工业制乙烯的主要方法 D.乙烯能和溴水发生加成反应
15.下列关于乙酸的说法正确的是
A.分子式为C2H6O2 B.官能团为羧基
C.一种无色无味的液体 D.水溶液的pH大于7
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有-个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
16.下列说法中正确的是
A.石油的分馏、煤的气化和液化都是化学变化
B.制口單熔喷布的聚丙烯可由丙烯通过加聚反应生成
C.煤在空气中燃烧可生成水、一氧化碳和二氧化碳等
D.在汽油里加入适量乙醇制成的“乙醇汽油”是一种新型化合物
17.下列条件中,锌和硫酸开始反应时放出氢气的速率最大的是
选项 金属 酸溶液的浓度和体积 温度/℃
A 2.4g锌片 3 mol·L-1硫酸50 mL 40
B 2.4g锌粉 1 mol·L-1硫酸2000 mL 30
C 2.4g锌粉 3 mol·L-1硫酸50 mL 40
D 2.4g锌片 3 mol·L-1硫酸100 mL 30
18.根据下列实验操作和现象所得出的结论正确的是
选项 实验操作和现象 结论
A 将盐酸滴入CaCO3中,产生的气体通入澄清石灰水,澄清石灰水变浑浊 盐酸的酸性强于碳酸
B 在两支试管中,分别放入除去氧化膜的大小相
同的镁条和铝条,再分别加入2 mL 2 mol·L-1
的盐酸,前者反应快 镁元素的金属性强于铝元素
C 向4 mL淀粉溶液中加入少量H2SO4溶液,加
热4~5min,然后调节溶液呈碱性,再加入新
制Cu(OH)2悬浊液,加热,出现砖红色沉淀 淀粉已经完全水解
D 向某乙醇中加入一小块金属钠,有气泡生成 该乙醇中含有一定量的水
19.短周期主族元素W、R、X、Y、Z的原子序数依次增大,W的原子半径是周期表中所有元素中最小的,R是地壳中含量最多的元素,X与W同主族,Y的最外层电子数是最内层电子数的3倍。
下列说法正确的是
A.原子半径: R
C. R与X只能形成一种化合物 D.最高价氧化物的水化物的酸性: Z>Y
20.根据元素周期律,由下列事实进行归纳推测,推测不合理的是
事实 推测
A Si是半导体材料,同族Ge也是半导体材料 IVA族的元素都是半导体材料
B Mg与水反应缓慢,Ca与水反应较快 Ba ( IIA族)与水反应更快
C HCI在1500℃时分解,HI在230℃时分解 HBr的分解温度介于二者之间
D H2SO4是强酸,HClO4也是强酸 H3PO4属于强酸
非选择题
21. (8分) X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
元素 相关信息
X 它的一种同位素被用作相对原子质量的标准
Y 常温下单质为双原子分子,分子中含有3对共用电子对
Z 是短周期中(除稀有气体外)原子半径最大的元素
Q 最外层电子数是次外层电子数的3倍
W 原子序数等于X、Y原子序数之和
R 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化
(1)元素X在元素周期表中的位置是 。
(2).上述六种元素中有2种元素能形成--种淡黄色的固体化合物,该化合物的电子式是 , 所含化学键的类型有离子键、
(3) Y、Q、R三种元素的简单氢化物中,稳定性最强的化合物的结构式为
(4).上述六种元素原子半径与主要化合价的关系如图,其中④对应的元素为
(5)将RQ2通入BaCl2溶液中,没有明显变化,再向其中加入Z的最高价氧化物的水化物,可观察到的现象是 , 发生反应的离子方程式是
22. (8 分)丙烯酸乙酯具有菠萝香味,可用作食品添加剂。工业上可以用乙烯、丙烯等为原料合成制得。
(1)由CH2=CH2生成有机物A (分子式为C2H6O)的反应类型是 。
(2)丙烯酸乙酯(CH2=CH-COOCH2CH3)中含氧官能团的名称 。
(3)有机物B的结构简式为 ; 根据乙烯和乙酸的结构及性质进行类比,关于有机物B
的说法正确的是 。
a.有机物B与CH3COOH含有的官能团完全相同
b.可以与NaHCO3溶液反应放出CO2气体
c.在一定条件下可以发生酯化、加成、氧化反应
(4)有机物A、B反应生成丙烯酸乙酯的反应在实验室中可在如图装置中进行。
①该反应的化学方程式是
②试管乙中试剂的名称是 , 若要将制得的产物分离出来,采用的实验操作是 (填名称)。
23. (8分)某学生为探究锌与盐酸反应过程中的速率变化,在TC时,向100 mL 2 mol·L-1盐酸中加
入过量的锌粉,测得氢气体积(已换算成标准状况)累计值如下:
时间(min) 1 2 3 4 5
氢气体积(mL) 50 120 232 290 310
(1)①在2~3 min时间段内,用盐酸的浓度变化表示的反应速率为 .
②在0~5min内,反应速率最大的时间段是 (填 “1~2 min”、“2~3 min”或“3~4 min”)。
(2)若完全反应后放出15.2 kJ的热量,则反应Zn(s) + 2HCl(aq) = = ZnCl2(aq) + H2(g)的△H=
(3)为了减缓反应速率但不减少产生气体的量,可向反应物中分别加入等体积的下列液体,你认为可行的
是 (填字母) 。
a.蒸馏水 b. Na2CO3溶液 c. NaNO3溶液
(4)为了加快反应速率但不减少产生气体的量,某同学向反应物中加入了少量CuSO4固体,
该同学操作 (填 “合理”或“不合理”),理由是
24. (11 分) CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时,要通入适量空气使部分甲烷燃烧,其目的是 。已知25℃、101 kPa时,1 mol甲烷完全燃烧生成CO2和
液态水时放出896 kJ热量,则甲烷的热值为 kJ·g-1
(2)一定温度下,在偏铝酸亚铜(CuAlO2) 的催化作用下,CH4与CO2转化成乙酸,可实现“CO2减排”,写出反应的化学方程式 ,
其优点是 (请写出一条)。
(3)甲烷可以消除氮氧化物污染。如: CH4(g)+2NO(g) N2(g) + CO2(g) + 2H2O(g)。
①下列措施能够加快化学反应速率的是 。
a.使用催化剂 b.降低温度 c.及时分离水
②若上述反应在恒容密闭容器中进行,则下列叙述能说明该反应达平衡的是 .
a.混合气体的质量不再变化 b. c(NO2) = 2c(N2)
c.单位时间内生成1 mol CO2,同时生成2 mol NO2
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
①b极电极反应式为 。
②若燃料电池消耗的空气在标准状况下的体积是5.6L (假设空气中O2体积分数为20%), 则理论上消耗
甲烷 mol.
2019~2020学年度第二学期期末抽测
高一化学试题参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其它合理答案的也给分。
一、共45分。每小题3分。每小题只有一个选项符合题意。
1.A 2.C 3.B 4.D 5.B 6.C 7.C 8.A 9.B 10.A 11.D 12.A 13.D 14.C 15.B
二、共20分。每小题4分。每小题每小题有一个或两个选项符合题意。
16.BC 17.C 18.B 19.BD 20.AD
三、共35分。
21.共8分。
(1)第2周期IVA族(1分) (2)(1分) 共价键(1分)
(3)H-O-H(1分) (4)S(硫)(1分)
(5)产生白色沉淀(1分)
H2SO3+2OH-+Ba2+=BaSO3↓ +2H2O或SO2+2OH-+Ba2+=BaSO3↓ +H2O(2分)
22.共8分。
(1)加成反应(1分) (2)酯基(1分)
(3)CH2=CHCOOH(1分) bc(1分)
(4)①C2H5OH + CH2=CHCOOH,\s\up8(浓硫酸),\s\do7(Δ))CH2=CHCOOC2H5 + H2O(2分)
②饱和碳酸钠溶液(1分) 分液(1分)
23.共8分。
(1)①0.1 mol·L-1·min-1 (2分) ②2~3min(1分)
(2)—152 kJ·mol-1(1分) (3)a(1分)
(4)合理(1分)
锌和置换出的铜构成原电池,加快反应速率;锌过量,不影响生产气体的量。(答案合理即可)(2分)
24.共11分。
(1)提供CH4分解所需的能量(1分) 56(1分)
(2)CH4+CO2CH3COOH (2分) 原子转化率100%(或符合绿色化学理念)(1分)
(3)①a(1分) ②c(1分)
(4)①O2 + 4e-=2O2-(2分) ②0.025(2分)
同课章节目录
