晶体
图片预览



文档简介
(共22张PPT)
高三化学
第一单元 晶体的类型与性质
单元复习
1、晶体
类型:离子晶体、分子晶体、原子晶体、金属晶体。
具有一定几何形状的固体,晶体确定的几何外形是晶体内部粒子有规则排列的外部表现。排列规则不同,晶体外形不同。
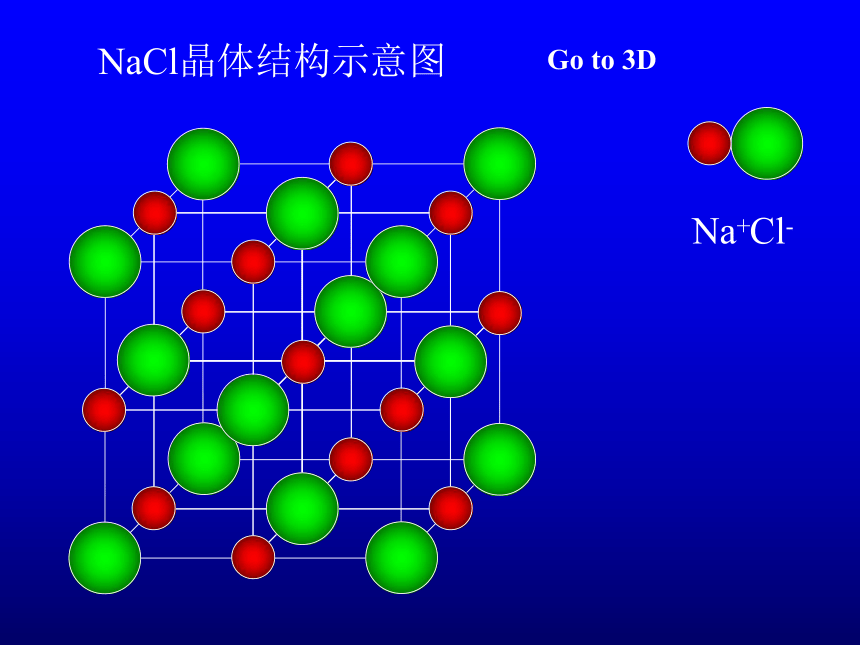
NaCl晶体结构示意图
Na+
Cl-
Go to 3D
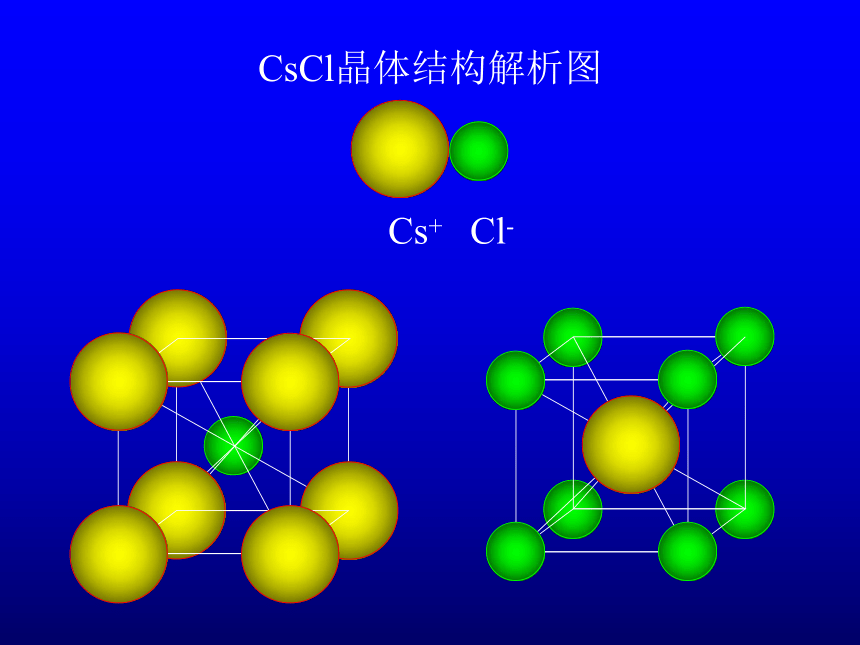
CsCl晶体结构解析图
Cs+
Cl-
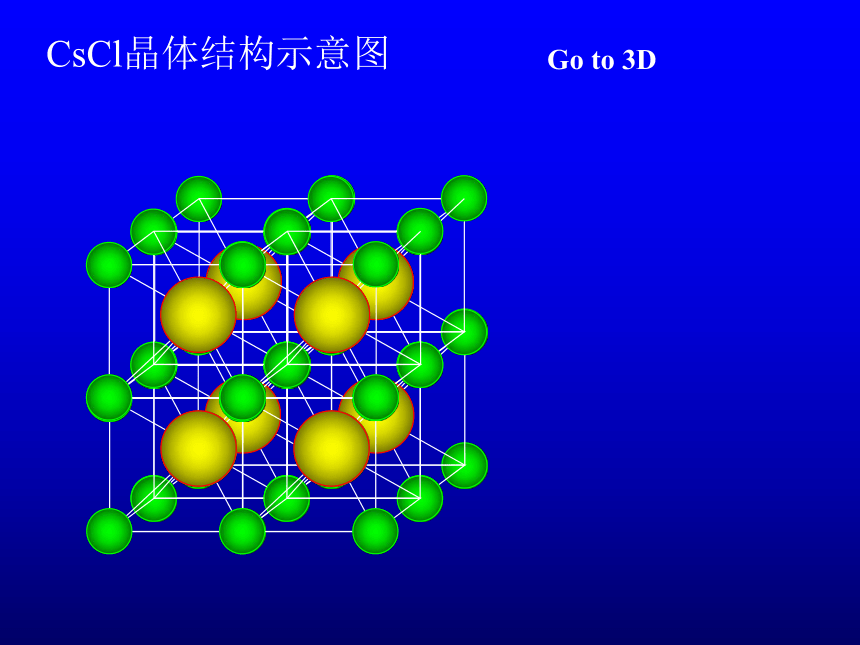
CsCl晶体结构示意图
Go to 3D
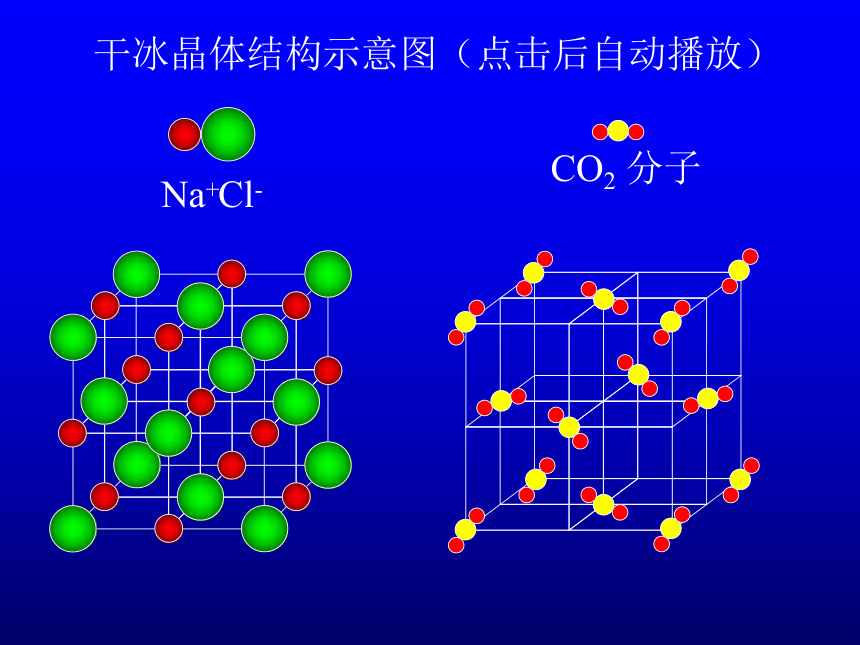
干冰晶体结构示意图(点击后自动播放)
CO2 分子
Na+
Cl-
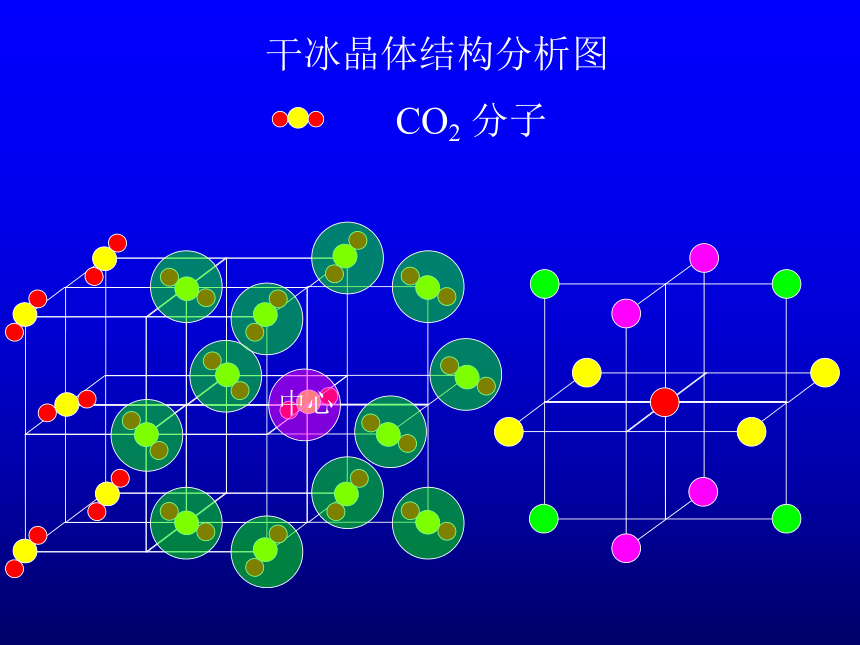
干冰晶体结构分析图
CO2 分子
中心
干冰晶体结构分析图
CO2 分子
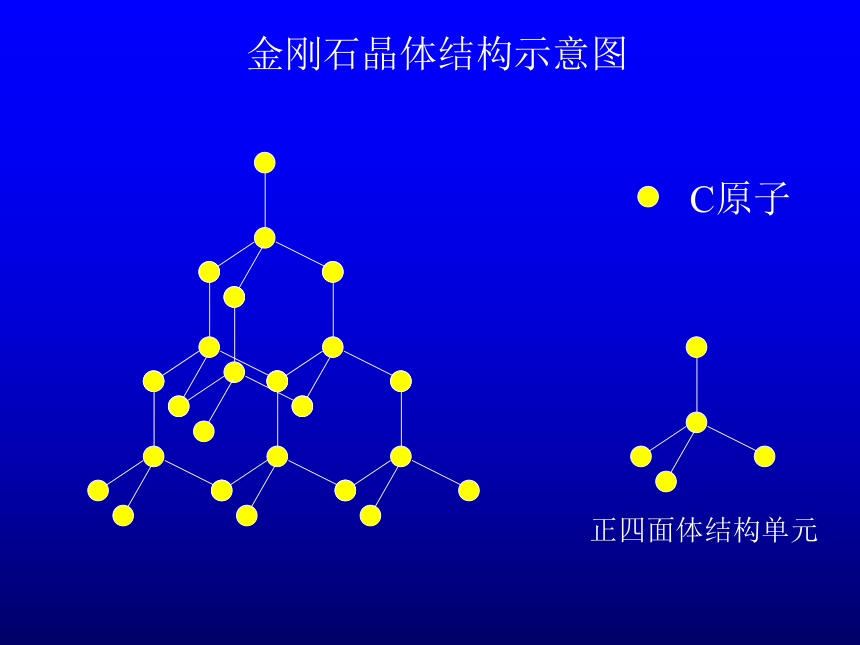
金刚石晶体结构示意图
C原子
正四面体结构单元
硅晶体结构示意图
Si原子
正四面体结构单元
二氧化硅晶体结构示意图
Si原子
结构单元
O原子
石墨晶体结构示意图
C原子
正六边形结构单元
石墨晶体中的邻层交错现象
第n层
第n+2层
第n+1层
金属晶体
金属原子
自由电子
金属的延展性1
金属原子
金属的延展性2
金属原子
自由电子
晶体
构成
粒子间作用
化学式含义
物理特性
代表物
物质类型
离子晶体
阴阳离子
离子键
离子个数比
略
NaCl、CsCl
离子化合物
分子晶体
分子
分子间作用力/氢键
分子式
略
CO2
单质、及共价化合物
原子晶体
原子
共价键
原子个数比
略
SiO2、金刚石
几种典型
金属晶体
金属阳离子及自由电子
阳离子与电子之间的相互作用
/
导电性、导热性、延展性
/
/
2、晶体比较
3、几种性质的解释
(5)相似相溶原理。
(4)HF、H2O、NH3的沸点反常原因
(3)解释离子晶体溶于水或熔化时可以导电;
(2)解释金属晶体的导电性、导热性、延展性;
(1)以氢键知识说明固体水的密度反常;
教学延伸:
晶体熔点比较:
4、金属晶体:离子半径小,熔点高,如,Na>K>Na-K。
3、原子晶体:结构相似,成键原子半径决定熔点,半径小,则熔点高,如金刚石>碳化硅>晶体硅;
2、分子晶体:结构相似,相对分子质量决定熔点,相对分子质量大,熔点高,如HI>HBr>HCl;
1、离子晶体:结构相似,离子半径和决定熔点,离子半径和小,熔点高,如,NaCl>KCl、KF>KCl等;
一般:原子晶体>离子晶体>分子晶体
练习:
1、根据下列物质的物理性质,推测它们在固态时可能属于哪类晶体。
(1)NaOH:熔点318.4 ℃ ,沸点1390 ℃ ,易溶于水,熔融时能导电。
(2)SO2:熔点-72.7 ℃ ,沸点-10.08 ℃ 。
(3)B:熔点2300 ℃ ,沸点2550 ℃ ,硬度大。
(4)SiC:熔点2327 ℃ ,硬度大。
离子晶体
分子晶体
原子晶体
原子晶体
2、问答题:
(1)常用的硫粉是一种硫的小晶体,熔点112.8 ℃,溶于CS2、CCl4等溶剂,试推断它可能属于哪一类晶体。
(2)干冰熔化或汽化时,CO2分子内的C=O
键是否受到破坏。
分子晶体
干冰熔化或汽化时, CO2分子间的分子间作用力受到破坏, CO2分子内的C=O键没有受到破坏。
Good Bye !
高三化学
第一单元 晶体的类型与性质
单元复习
1、晶体
类型:离子晶体、分子晶体、原子晶体、金属晶体。
具有一定几何形状的固体,晶体确定的几何外形是晶体内部粒子有规则排列的外部表现。排列规则不同,晶体外形不同。
NaCl晶体结构示意图
Na+
Cl-
Go to 3D
CsCl晶体结构解析图
Cs+
Cl-
CsCl晶体结构示意图
Go to 3D
干冰晶体结构示意图(点击后自动播放)
CO2 分子
Na+
Cl-
干冰晶体结构分析图
CO2 分子
中心
干冰晶体结构分析图
CO2 分子
金刚石晶体结构示意图
C原子
正四面体结构单元
硅晶体结构示意图
Si原子
正四面体结构单元
二氧化硅晶体结构示意图
Si原子
结构单元
O原子
石墨晶体结构示意图
C原子
正六边形结构单元
石墨晶体中的邻层交错现象
第n层
第n+2层
第n+1层
金属晶体
金属原子
自由电子
金属的延展性1
金属原子
金属的延展性2
金属原子
自由电子
晶体
构成
粒子间作用
化学式含义
物理特性
代表物
物质类型
离子晶体
阴阳离子
离子键
离子个数比
略
NaCl、CsCl
离子化合物
分子晶体
分子
分子间作用力/氢键
分子式
略
CO2
单质、及共价化合物
原子晶体
原子
共价键
原子个数比
略
SiO2、金刚石
几种典型
金属晶体
金属阳离子及自由电子
阳离子与电子之间的相互作用
/
导电性、导热性、延展性
/
/
2、晶体比较
3、几种性质的解释
(5)相似相溶原理。
(4)HF、H2O、NH3的沸点反常原因
(3)解释离子晶体溶于水或熔化时可以导电;
(2)解释金属晶体的导电性、导热性、延展性;
(1)以氢键知识说明固体水的密度反常;
教学延伸:
晶体熔点比较:
4、金属晶体:离子半径小,熔点高,如,Na>K>Na-K。
3、原子晶体:结构相似,成键原子半径决定熔点,半径小,则熔点高,如金刚石>碳化硅>晶体硅;
2、分子晶体:结构相似,相对分子质量决定熔点,相对分子质量大,熔点高,如HI>HBr>HCl;
1、离子晶体:结构相似,离子半径和决定熔点,离子半径和小,熔点高,如,NaCl>KCl、KF>KCl等;
一般:原子晶体>离子晶体>分子晶体
练习:
1、根据下列物质的物理性质,推测它们在固态时可能属于哪类晶体。
(1)NaOH:熔点318.4 ℃ ,沸点1390 ℃ ,易溶于水,熔融时能导电。
(2)SO2:熔点-72.7 ℃ ,沸点-10.08 ℃ 。
(3)B:熔点2300 ℃ ,沸点2550 ℃ ,硬度大。
(4)SiC:熔点2327 ℃ ,硬度大。
离子晶体
分子晶体
原子晶体
原子晶体
2、问答题:
(1)常用的硫粉是一种硫的小晶体,熔点112.8 ℃,溶于CS2、CCl4等溶剂,试推断它可能属于哪一类晶体。
(2)干冰熔化或汽化时,CO2分子内的C=O
键是否受到破坏。
分子晶体
干冰熔化或汽化时, CO2分子间的分子间作用力受到破坏, CO2分子内的C=O键没有受到破坏。
Good Bye !
