人教版高中必修一化学4.2富集在海水中的元素——氯(54张PPT)共2课时
文档属性
| 名称 | 人教版高中必修一化学4.2富集在海水中的元素——氯(54张PPT)共2课时 |  | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-19 17:17:16 | ||
图片预览









文档简介
(共108张PPT)
第二节
富集在海水中的元素——氯
如将海水中盐类全部提取出来,铺在地球的陆地上,可以使陆地平均升高150m
[自主探究]
1、指出氯元素在周期表中的位置,出它的原子结构示意图
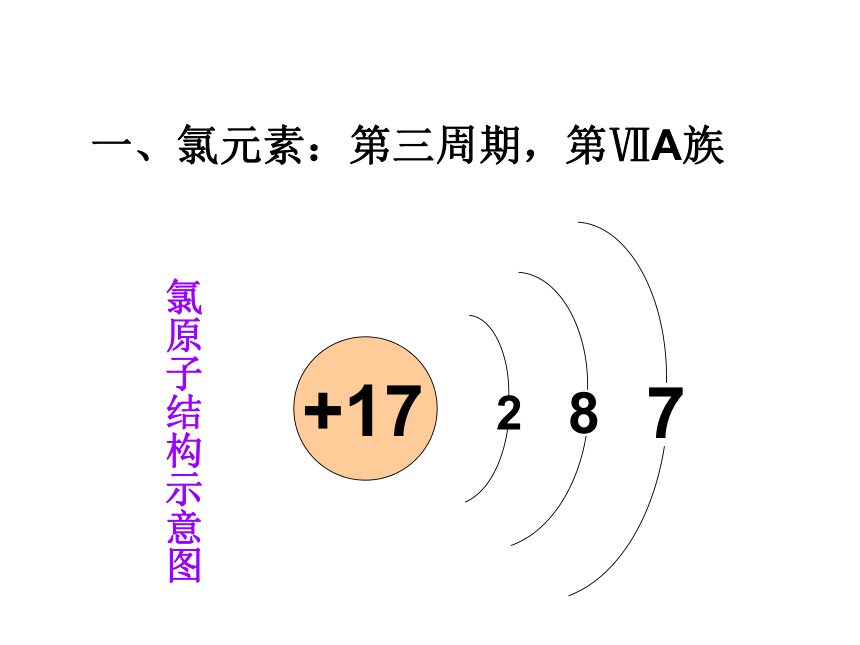
一、氯元素:第三周期,第ⅦA族
氯原子结构示意图
在第一次世界大战中,曾被德军制成毒气弹等化学武器用于战争。在战场上使得英法联军伤亡惨重的是什么?
[思考与交流](同组讨论)阅读课文P83页
1、从氯气的发现到确认时间长达30多年。你从中得到什么启示?
2、舍勒发现氯气的方法至今仍是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式:________________。
思考与交流
从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误
的理论,建立正确的理论或推动科学理论的发展。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
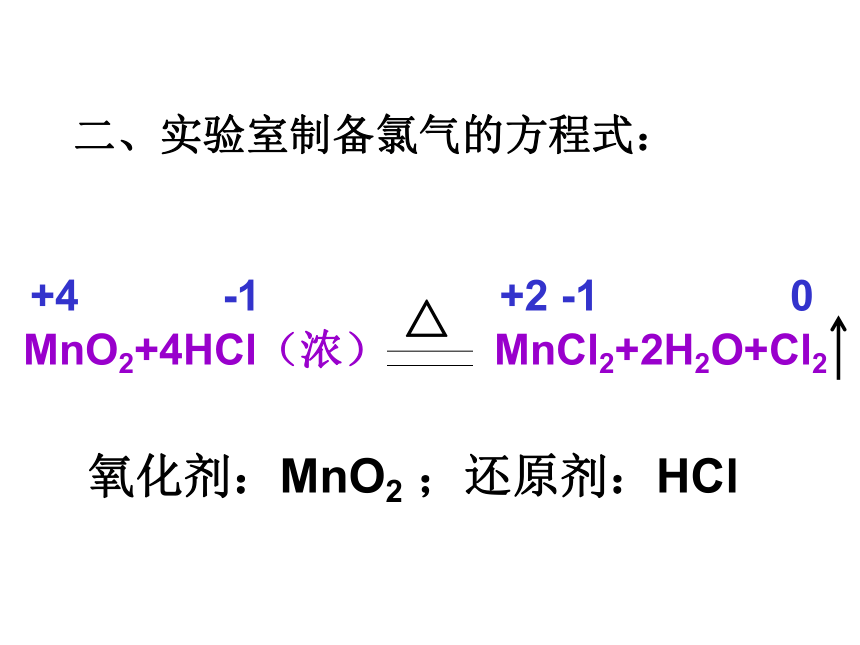
二、实验室制备氯气的方程式:
氧化剂:MnO2
;还原剂:HCl
+4
-1
+2
-1
0
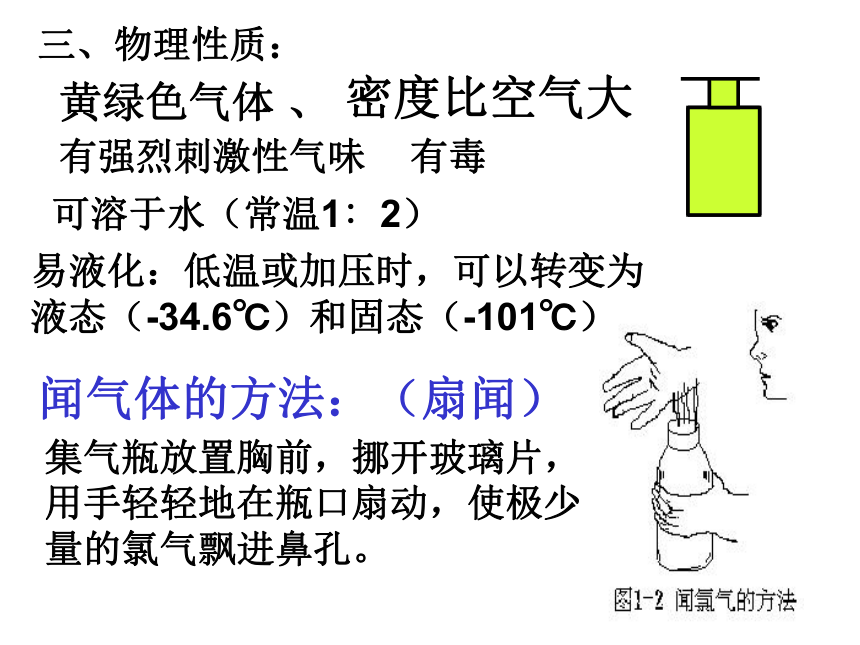
三、物理性质:
黄绿色气体
、
闻气体的方法:(扇闻)
可溶于水(常温1∶2)
易液化:低温或加压时,可以转变为液态(-34.6℃)和固态(-101℃)
集气瓶放置胸前,挪开玻璃片,用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。
有强烈刺激性气味
有毒
密度比空气大
[讨论]
1、实验室如何收集氯气?
向上排空气法
不能用排水法收集氯气
因为Cl2有毒,在一战中,曾被德军制成毒气弹等化学武器用于战争。在战场上使得英法联军伤亡惨重。
[讨论]
假如你是一名士兵,当遇到由氯气制成的毒气弹顺风爆炸时,你认为可采用哪些措施进行防御?
①人躲向地势较高地方去。②防毒面具。③活性炭。
氯原子的结构示意图:
在反应中氯气体现了强氧化性
结构决定性质
化学性质活泼
分子结构不稳定
原子结构不稳定
(1)氯气与金属的反应:
[Cl2与铜丝的反应]
实验步骤:用坩埚钳夹住铜丝,灼烧至红热后立刻放入充满氯气的集气瓶里,然后往瓶里加少量的水。
1、红热的铜丝剧烈燃烧,充满棕黄色的烟
2、溶液颜色呈蓝绿色(随CuCl2浓度不同而不同)
实验结论:
实验现象:
小知识:
烟:固体小颗粒分散在空气中。
雾:液体小液滴分散在空气中。
白烟
棕黄色的烟
苍白色火焰
爆炸
反应装置及主要现象
注意:
Cl2+有变价的金属==高价态的金属氯化物
二、化学性质
(1)与金属反应
实验现象
烟
(2)与非金属的反应:[氢气在氯气中燃烧]
实验步骤:在空气中点燃H2,然后把导管伸入
盛有Cl2的集气瓶中
实验现象:H2在Cl2中安静燃烧,
苍白色火焰,生成白雾
实验结论:
光照
H2
+
Cl2
===
2HCl
(爆炸
[讨论]
工业上常用Cl2和H2反应生成HCl,让其溶于水得盐酸,Cl2和H2反应生成HCl有三种途径
①纯净的H2在Cl2中燃烧
②将H2和Cl2混合后点燃
③H2和Cl2混合后光照,
那么工业上选用哪种方法?为什么?
[思考与交流]
1、通过氢气在Cl2中燃烧,你对燃烧的条件及其本质有什么新的认识?
初中教材:可燃物与氧气发生的一种发光、放热的剧烈的氧化反应
高中教材:任何发光、发热的剧烈的化学
反应,都称为燃烧
燃烧的特征:发光发热和化学反应
2、点燃和燃烧有何区别?
点燃和燃烧有何区别?
点燃是一种反应条件
燃烧是一种剧烈的化学反应,
其特点是有发光发热的现象。
在化学方程式等号的上方或下方书写的是反应条件,因此只能写点燃而不能写燃烧。
描述反应现象要注意事项:
1、区分烟和雾
2、不要把现象和结论混淆、不要把条件的现象混淆
课堂练习
1.下列化合物可以由金属和氯气直接化合制得的是
A.NaCl
B.CuCl2
C.FeCl2
D.FeCl3
2.氯的原子结构示意图为____.在化学反应中氯原子易得____个电子,形成____个电子的稳定结构,氯气通常作____剂。制取氯气时通常用____法收集。
3.下列叙述中,正确的是
A.氯气以液态形式存在时可称作氯水或液氯
B.红热的铜丝在氯气中燃烧,生成蓝色的
固体CuCl2
C.氯气有毒,氯离子也有毒
D.氯气和氯离子都呈黄绿色
4、下列金属能分别与氯气或盐酸反应,且生成同一种盐的是
A、铜丝
B、镁条
C、铁丝
D、铝粉
5、实验室可以在加热条件下用下面的方法制取少量氯气:
MnO2
+4HCl(浓)==MnCl2+2H2O
+
Cl2↑
在反应中,消耗的HCl的物质的量与作还原剂的HCl的物质的量的比是:
A、
1∶1
B、2
∶1
C、4
∶1
D、1
∶2
6、“盐都能作为人们日常生活中的调味品”这句话对吗?为什么?
错误
生活中做调味品的食盐仅是化学上年所学盐中的一种,而许多盐如CuSO4、NaNO2等对人体有毒,不能食用(或不理解盐的概念,未能分清盐与食盐的关系。
氯气的化学性质
1.
与金属反应
2.
与非金属反应
反应的相同点:
反应类型:两种单质的化合反应
反应条件:点燃
反应现象:发光发热
化合价:氯元素的化合价由零价
降至负一价。
得失电子:氯原子得到电子
富集在海水中的元素
Cl
第二课时
[自主探究]
1、氯气溶于水形成氯水,溶于水的部分Cl2会与水反应,请你根据已掌握的Cl2的性质猜测,Cl2与H2O反应可能形成的产物是什么?并设计各种实验方案,证明你的假设是否成立。
实验一:
向紫色石蕊试液中滴加氯水:
向硝酸银溶液中滴加氯水:
H+(酸性)
Cl-
分析:Cl2
+
H2O
=
HCl
+
HClO
成分:H2O、Cl2、HClO、H+
、
Cl-、ClO-、OH-
思考:液氯与氯水的区别?
实验二:
新制氯水的成分:H2O、Cl2、HClO、H+
、
Cl-、ClO-、OH-(重点)
(一)氯水的化学性质
1、酸性(H+)
2、氧化性(Cl2)
3、与银盐等其他物质的反应
3、氯气与水的反应
Cl2
+
H2O
=
HCl
+
HClO
[探究]除了以上性质还有没有其它性质呢?
观察实验4-4、4-5现象
4、有漂白作用
[探究]
判断氯水中的哪种成分在起漂白作用?
结论:HClO具有漂白作用,而Cl2不具有
3、HClO是一种不稳定的弱酸
思考:氯水长时间放置(即久置氯水),颜色有何变化?组成上有何变化?
氯水颜色变浅
盐酸成份增多
氯水储存在棕色试剂瓶中,并置于阴凉黑暗处
(二)氯水在实际生活中的应用
1、杀菌消毒:
Cl2(氧化性),HClO(强氧化性)
2、漂白:
HClO(强氧化性)
[实验]取两个装有氯气的集气瓶,先观察氯气的颜色。然后向一个瓶中注入少量水(约5ml),向另一个瓶中注入等体积的浓氢氧化钠溶液,振荡。片刻后,对比瓶里氯气的颜色。
注入碱液的瓶里黄绿色褪去,而注入水的瓶里的氯气的黄绿色变化不明显。
2、在工业上,Cl2与消石灰反应可以制得漂白粉,其有效成份是什么?起漂白作用的物质是什么?
反应:
Cl2与NaOH溶液的反应:
Cl2
+
H2O
=
HCl
+
HClO
HCl
+
NaOH
=
NaCl
+
H2O
HClO+
NaOH
=
NaClO
+
H2O
Cl2
+
2
NaOH
=
NaCl
+
NaClO
+
H2O
次氯酸钠
Cl2与Ca(OH)2溶液的反应
2Cl2
+
2Ca(OH)2
=
CaCl
2+
Ca(ClO)2
+
2H2O
4、Cl2与碱溶液的反应:
漂白液、漂白粉、漂白精成分的区别
漂白液的有效成分:NaClO
漂白粉的有效成分:Ca(ClO)2
漂白精的主要成分:Ca(ClO)2
(三)氯气的广泛应用
可用于制备:CuCl2、FeCl3、HCl、氯水、漂白液、高纯硅、农药等等
(四)氯离子(Cl-)的检验
方法:先滴少量稀硝酸酸化(排除干扰离子),再滴加硝酸银溶液
(实验4-6)
四、氯离子(Cl-)的检验
实验步骤:
①在5支试管中分别加入2mL稀盐酸、NaCl溶液、Na2CO3溶液、自来水、蒸馏水;
②分别滴入5滴AgNO3溶液,观察现象;
③再分别滴入2mL稀硝酸,观察现象。
根据自己所观察到的现象,填写表格。
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl-
+
Ag+
=AgCl↓
CO32-
+2Ag+
=Ag2CO3↓
Cl-
+
Ag+
=AgCl↓
Cl-
+
Ag+
=AgCl↓
白色沉淀
沉淀不消失
Ag2CO3+2H+=2Ag++CO2↑
+
H2O
白色沉淀
无现象
无现象
实验现象
解释或离子方程式
加入AgNO3溶液后
加入
稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
思考:
原因:
AgNO3溶液除可以与Cl-形成AgCl白色沉淀外,还可以与CO32-形成Ag2CO3白色沉淀,但AgCl不与稀硝酸反应;
Ag2CO3可与稀硝酸反应,沉淀溶解。
(五)成盐元素——卤素
ⅦA族:氟F、氯Cl、溴Br、碘Ⅰ、砹At
1
最外层7个电子,典型的非金属元素
2
单质都为双原子分子:F2、Cl2、Br2、I2
3
单质都有都具有氧化性,且随原子核电荷数的增大而逐渐减弱:
氧化性:F2>Cl2
>
Br2
>
I2
1、与金属直接化合
Cl2+H2O=HCl+HClO
Br2+H2O=HBr+HBrO
l2+H2O=Hl+HlO
卤素化学性质(重点)
1、与金属化合生成盐
2、与氢气化合,生成HX.从上至下反应越来越难(X=F、Cl
、Br、I)
3、与水反应
X2+H2O=HX+HXO(X=Cl、Br、I)
用自来水养鱼之前,应先将盛有自来水的鱼缸放在阳光下晒一段时间,主要目的是
(A)除去水中的HClO
(B)紫外线杀菌消毒
(C)增加水中含氧量
(D)提高水温
解析:自来水用氯气消毒,因此水中含有次氯酸,次氯酸对生物不利,光照可使次氯酸分解,选(A)
2.
把氯气通入紫色石蕊试液中,出现的现象是
(A)溶液变红色
(B)溶液变蓝色
(C)溶液不变色
(D)溶液先变红后褪色
(E)溶液先褪色后变红
解析:Cl2通入石蕊试液中,先与水反应生成盐酸和次氯酸,盐酸使石蕊试液变红(速度较快),而次氯酸有强氧化性,能把有色物质氧化成无色(速度较慢),故选(D)
次氯酸钙能与碳酸反应生成次氯酸,证明次氯酸的酸性比碳酸弱,次氯酸是弱酸。
3.
次氯酸是一种强氧化剂,能杀死水里的细菌,能使染料和有机色质褪色。它是强酸还是弱酸?怎样证明?
课堂练习
思路:强酸和弱酸的盐反应能生成弱酸和强酸的盐
4.
写出氯气分别与水、氢氧化钠、熟石灰
反应的化学方程式,并分析上述三个反应有何相似点。
课堂练习
Cl2
+
H2O
=
HCl
+
HClO
Cl2
+
2NaOH
=
NaCl
+
NaClO
+
H2O
2Cl2
+
2Ca(OH)2
=
CaCl2
+
Ca(ClO)2
+
2H2O
氯气分别与水、氢氧化钠、熟石灰反应的化学方程式:
三个反应的相似处:
氯元素的化合价,有一半由零价降为-1价,
有一半由零价升为+1价。
0
0
0
-1
-1
-1
+1
+1
+1
第二节
富集在海水中的元素——氯
如将海水中盐类全部提取出来,铺在地球的陆地上,可以使陆地平均升高150m
[自主探究]
1、指出氯元素在周期表中的位置,出它的原子结构示意图
一、氯元素:第三周期,第ⅦA族
氯原子结构示意图
在第一次世界大战中,曾被德军制成毒气弹等化学武器用于战争。在战场上使得英法联军伤亡惨重的是什么?
[思考与交流](同组讨论)阅读课文P83页
1、从氯气的发现到确认时间长达30多年。你从中得到什么启示?
2、舍勒发现氯气的方法至今仍是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式:________________。
思考与交流
从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误
的理论,建立正确的理论或推动科学理论的发展。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
二、实验室制备氯气的方程式:
氧化剂:MnO2
;还原剂:HCl
+4
-1
+2
-1
0
三、物理性质:
黄绿色气体
、
闻气体的方法:(扇闻)
可溶于水(常温1∶2)
易液化:低温或加压时,可以转变为液态(-34.6℃)和固态(-101℃)
集气瓶放置胸前,挪开玻璃片,用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。
有强烈刺激性气味
有毒
密度比空气大
[讨论]
1、实验室如何收集氯气?
向上排空气法
不能用排水法收集氯气
因为Cl2有毒,在一战中,曾被德军制成毒气弹等化学武器用于战争。在战场上使得英法联军伤亡惨重。
[讨论]
假如你是一名士兵,当遇到由氯气制成的毒气弹顺风爆炸时,你认为可采用哪些措施进行防御?
①人躲向地势较高地方去。②防毒面具。③活性炭。
氯原子的结构示意图:
在反应中氯气体现了强氧化性
结构决定性质
化学性质活泼
分子结构不稳定
原子结构不稳定
(1)氯气与金属的反应:
[Cl2与铜丝的反应]
实验步骤:用坩埚钳夹住铜丝,灼烧至红热后立刻放入充满氯气的集气瓶里,然后往瓶里加少量的水。
1、红热的铜丝剧烈燃烧,充满棕黄色的烟
2、溶液颜色呈蓝绿色(随CuCl2浓度不同而不同)
实验结论:
实验现象:
小知识:
烟:固体小颗粒分散在空气中。
雾:液体小液滴分散在空气中。
白烟
棕黄色的烟
苍白色火焰
爆炸
反应装置及主要现象
注意:
Cl2+有变价的金属==高价态的金属氯化物
二、化学性质
(1)与金属反应
实验现象
烟
(2)与非金属的反应:[氢气在氯气中燃烧]
实验步骤:在空气中点燃H2,然后把导管伸入
盛有Cl2的集气瓶中
实验现象:H2在Cl2中安静燃烧,
苍白色火焰,生成白雾
实验结论:
光照
H2
+
Cl2
===
2HCl
(爆炸
[讨论]
工业上常用Cl2和H2反应生成HCl,让其溶于水得盐酸,Cl2和H2反应生成HCl有三种途径
①纯净的H2在Cl2中燃烧
②将H2和Cl2混合后点燃
③H2和Cl2混合后光照,
那么工业上选用哪种方法?为什么?
[思考与交流]
1、通过氢气在Cl2中燃烧,你对燃烧的条件及其本质有什么新的认识?
初中教材:可燃物与氧气发生的一种发光、放热的剧烈的氧化反应
高中教材:任何发光、发热的剧烈的化学
反应,都称为燃烧
燃烧的特征:发光发热和化学反应
2、点燃和燃烧有何区别?
点燃和燃烧有何区别?
点燃是一种反应条件
燃烧是一种剧烈的化学反应,
其特点是有发光发热的现象。
在化学方程式等号的上方或下方书写的是反应条件,因此只能写点燃而不能写燃烧。
描述反应现象要注意事项:
1、区分烟和雾
2、不要把现象和结论混淆、不要把条件的现象混淆
课堂练习
1.下列化合物可以由金属和氯气直接化合制得的是
A.NaCl
B.CuCl2
C.FeCl2
D.FeCl3
2.氯的原子结构示意图为____.在化学反应中氯原子易得____个电子,形成____个电子的稳定结构,氯气通常作____剂。制取氯气时通常用____法收集。
3.下列叙述中,正确的是
A.氯气以液态形式存在时可称作氯水或液氯
B.红热的铜丝在氯气中燃烧,生成蓝色的
固体CuCl2
C.氯气有毒,氯离子也有毒
D.氯气和氯离子都呈黄绿色
4、下列金属能分别与氯气或盐酸反应,且生成同一种盐的是
A、铜丝
B、镁条
C、铁丝
D、铝粉
5、实验室可以在加热条件下用下面的方法制取少量氯气:
MnO2
+4HCl(浓)==MnCl2+2H2O
+
Cl2↑
在反应中,消耗的HCl的物质的量与作还原剂的HCl的物质的量的比是:
A、
1∶1
B、2
∶1
C、4
∶1
D、1
∶2
6、“盐都能作为人们日常生活中的调味品”这句话对吗?为什么?
错误
生活中做调味品的食盐仅是化学上年所学盐中的一种,而许多盐如CuSO4、NaNO2等对人体有毒,不能食用(或不理解盐的概念,未能分清盐与食盐的关系。
氯气的化学性质
1.
与金属反应
2.
与非金属反应
反应的相同点:
反应类型:两种单质的化合反应
反应条件:点燃
反应现象:发光发热
化合价:氯元素的化合价由零价
降至负一价。
得失电子:氯原子得到电子
富集在海水中的元素
Cl
第二课时
[自主探究]
1、氯气溶于水形成氯水,溶于水的部分Cl2会与水反应,请你根据已掌握的Cl2的性质猜测,Cl2与H2O反应可能形成的产物是什么?并设计各种实验方案,证明你的假设是否成立。
实验一:
向紫色石蕊试液中滴加氯水:
向硝酸银溶液中滴加氯水:
H+(酸性)
Cl-
分析:Cl2
+
H2O
=
HCl
+
HClO
成分:H2O、Cl2、HClO、H+
、
Cl-、ClO-、OH-
思考:液氯与氯水的区别?
实验二:
新制氯水的成分:H2O、Cl2、HClO、H+
、
Cl-、ClO-、OH-(重点)
(一)氯水的化学性质
1、酸性(H+)
2、氧化性(Cl2)
3、与银盐等其他物质的反应
3、氯气与水的反应
Cl2
+
H2O
=
HCl
+
HClO
[探究]除了以上性质还有没有其它性质呢?
观察实验4-4、4-5现象
4、有漂白作用
[探究]
判断氯水中的哪种成分在起漂白作用?
结论:HClO具有漂白作用,而Cl2不具有
3、HClO是一种不稳定的弱酸
思考:氯水长时间放置(即久置氯水),颜色有何变化?组成上有何变化?
氯水颜色变浅
盐酸成份增多
氯水储存在棕色试剂瓶中,并置于阴凉黑暗处
(二)氯水在实际生活中的应用
1、杀菌消毒:
Cl2(氧化性),HClO(强氧化性)
2、漂白:
HClO(强氧化性)
[实验]取两个装有氯气的集气瓶,先观察氯气的颜色。然后向一个瓶中注入少量水(约5ml),向另一个瓶中注入等体积的浓氢氧化钠溶液,振荡。片刻后,对比瓶里氯气的颜色。
注入碱液的瓶里黄绿色褪去,而注入水的瓶里的氯气的黄绿色变化不明显。
2、在工业上,Cl2与消石灰反应可以制得漂白粉,其有效成份是什么?起漂白作用的物质是什么?
反应:
Cl2与NaOH溶液的反应:
Cl2
+
H2O
=
HCl
+
HClO
HCl
+
NaOH
=
NaCl
+
H2O
HClO+
NaOH
=
NaClO
+
H2O
Cl2
+
2
NaOH
=
NaCl
+
NaClO
+
H2O
次氯酸钠
Cl2与Ca(OH)2溶液的反应
2Cl2
+
2Ca(OH)2
=
CaCl
2+
Ca(ClO)2
+
2H2O
4、Cl2与碱溶液的反应:
漂白液、漂白粉、漂白精成分的区别
漂白液的有效成分:NaClO
漂白粉的有效成分:Ca(ClO)2
漂白精的主要成分:Ca(ClO)2
(三)氯气的广泛应用
可用于制备:CuCl2、FeCl3、HCl、氯水、漂白液、高纯硅、农药等等
(四)氯离子(Cl-)的检验
方法:先滴少量稀硝酸酸化(排除干扰离子),再滴加硝酸银溶液
(实验4-6)
四、氯离子(Cl-)的检验
实验步骤:
①在5支试管中分别加入2mL稀盐酸、NaCl溶液、Na2CO3溶液、自来水、蒸馏水;
②分别滴入5滴AgNO3溶液,观察现象;
③再分别滴入2mL稀硝酸,观察现象。
根据自己所观察到的现象,填写表格。
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl-
+
Ag+
=AgCl↓
CO32-
+2Ag+
=Ag2CO3↓
Cl-
+
Ag+
=AgCl↓
Cl-
+
Ag+
=AgCl↓
白色沉淀
沉淀不消失
Ag2CO3+2H+=2Ag++CO2↑
+
H2O
白色沉淀
无现象
无现象
实验现象
解释或离子方程式
加入AgNO3溶液后
加入
稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
思考:
原因:
AgNO3溶液除可以与Cl-形成AgCl白色沉淀外,还可以与CO32-形成Ag2CO3白色沉淀,但AgCl不与稀硝酸反应;
Ag2CO3可与稀硝酸反应,沉淀溶解。
(五)成盐元素——卤素
ⅦA族:氟F、氯Cl、溴Br、碘Ⅰ、砹At
1
最外层7个电子,典型的非金属元素
2
单质都为双原子分子:F2、Cl2、Br2、I2
3
单质都有都具有氧化性,且随原子核电荷数的增大而逐渐减弱:
氧化性:F2>Cl2
>
Br2
>
I2
1、与金属直接化合
Cl2+H2O=HCl+HClO
Br2+H2O=HBr+HBrO
l2+H2O=Hl+HlO
卤素化学性质(重点)
1、与金属化合生成盐
2、与氢气化合,生成HX.从上至下反应越来越难(X=F、Cl
、Br、I)
3、与水反应
X2+H2O=HX+HXO(X=Cl、Br、I)
用自来水养鱼之前,应先将盛有自来水的鱼缸放在阳光下晒一段时间,主要目的是
(A)除去水中的HClO
(B)紫外线杀菌消毒
(C)增加水中含氧量
(D)提高水温
解析:自来水用氯气消毒,因此水中含有次氯酸,次氯酸对生物不利,光照可使次氯酸分解,选(A)
2.
把氯气通入紫色石蕊试液中,出现的现象是
(A)溶液变红色
(B)溶液变蓝色
(C)溶液不变色
(D)溶液先变红后褪色
(E)溶液先褪色后变红
解析:Cl2通入石蕊试液中,先与水反应生成盐酸和次氯酸,盐酸使石蕊试液变红(速度较快),而次氯酸有强氧化性,能把有色物质氧化成无色(速度较慢),故选(D)
次氯酸钙能与碳酸反应生成次氯酸,证明次氯酸的酸性比碳酸弱,次氯酸是弱酸。
3.
次氯酸是一种强氧化剂,能杀死水里的细菌,能使染料和有机色质褪色。它是强酸还是弱酸?怎样证明?
课堂练习
思路:强酸和弱酸的盐反应能生成弱酸和强酸的盐
4.
写出氯气分别与水、氢氧化钠、熟石灰
反应的化学方程式,并分析上述三个反应有何相似点。
课堂练习
Cl2
+
H2O
=
HCl
+
HClO
Cl2
+
2NaOH
=
NaCl
+
NaClO
+
H2O
2Cl2
+
2Ca(OH)2
=
CaCl2
+
Ca(ClO)2
+
2H2O
氯气分别与水、氢氧化钠、熟石灰反应的化学方程式:
三个反应的相似处:
氯元素的化合价,有一半由零价降为-1价,
有一半由零价升为+1价。
0
0
0
-1
-1
-1
+1
+1
+1
