浙教版科学八级年上册“胜人一筹”暑期培优讲义(七):溶质质量分数 (学案)【含答案】
文档属性
| 名称 | 浙教版科学八级年上册“胜人一筹”暑期培优讲义(七):溶质质量分数 (学案)【含答案】 |  | |
| 格式 | zip | ||
| 文件大小 | 260.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-07-20 22:43:07 | ||
图片预览


文档简介
(
2020浙教版科学八年级上册暑期培优“胜人一筹”讲义(
七
):
)
(
溶质质量分数
)
1.溶质的质量分数
(1)概念:溶质的质量与溶液的质量之比,可用小数或百分数表示。
(2)科学上用溶质的质量分数来定量表示溶液的组成。
(3)有关计算公式
溶质的质量分数=×l00%=×l00%
2.配制溶液时,固体用天平称取,液体用量筒量取,倒入烧杯中配制。
步骤:计算、称量、量取、溶解、装瓶贴标签。
【误差分析】
(1)偏小:
①天平使用不正确,如药品、砝码放反(称量时使用游码),使药品称量质量偏小。
②量取水的过程中仰视读数,使水量取多了。
③烧杯不干燥,原来内部就有一些水。
④固体药品中含有杂质等。
(2)偏大:
①天平使用不正确,如称量前没有调平衡,指针偏右,导致药品称量偏多。
②砝码已生锈,导致药品称量偏多。
③量取水的过程中俯视读数,使水量取少了。
④将量筒中的水倒入烧杯中时,一部分洒在外面等。
3、溶液稀释和浓缩前后溶质的质量不变
即m浓×p浓%=(m浓+m水)×p稀%
m浓——浓溶液的质量
p浓%——浓溶液的质量分数
p稀%——稀溶液的质量分数
4、相同溶质不同质量分数的两种溶液混合
m浓×p浓%+m稀×p稀%=
(m浓
+
m稀)×p混%
m稀——稀溶液的质量
p混%——混合溶液的质量分数
5、溶液体积、质量、密度三者之间的关系:
溶液的质量=溶液的体积×溶液的密度
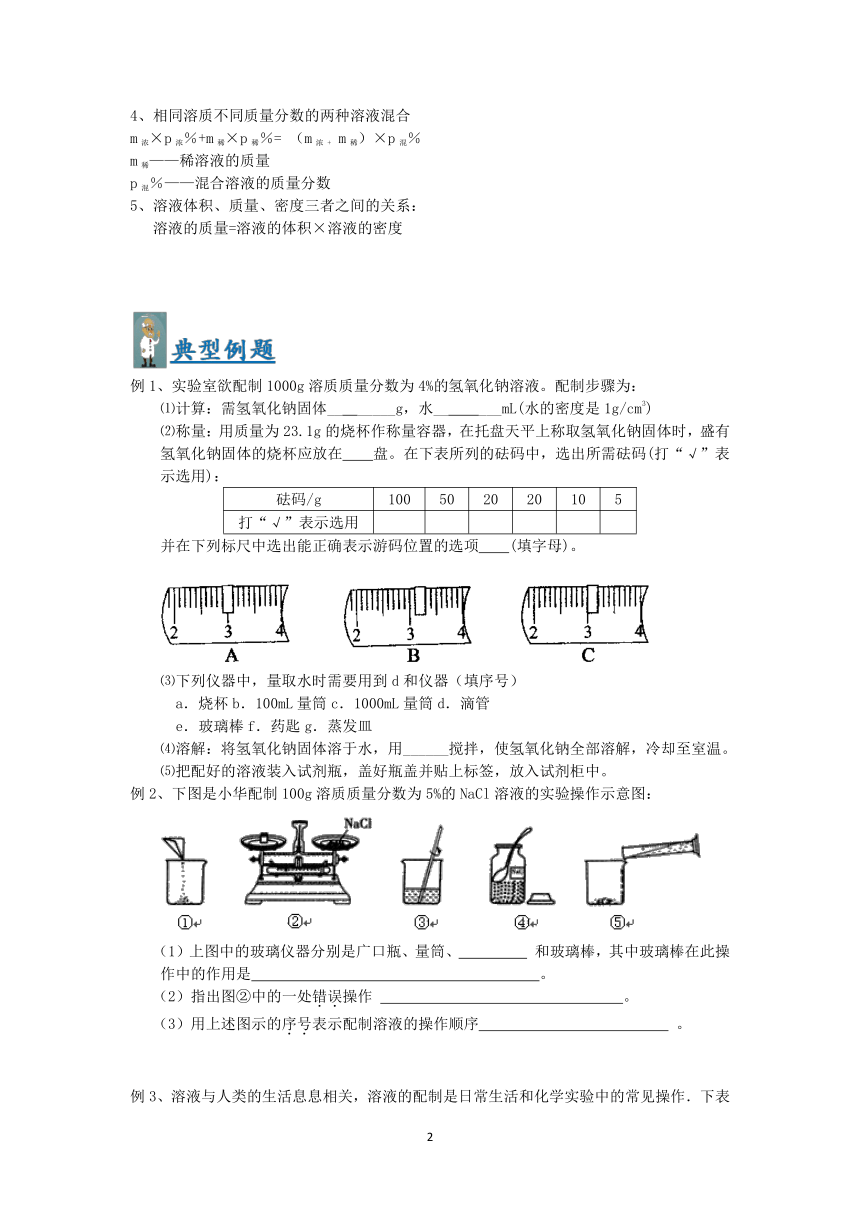
例1、实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液。配制步骤为:
⑴计算:需氢氧化钠固体__ _____g,水__ ___mL(水的密度是1g/cm3)
⑵称量:用质量为23.1g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘。在下表所列的砝码中,选出所需砝码(打“√”表示选用):
砝码/g
100
50
20
20
10
5
打“√”表示选用
并在下列标尺中选出能正确表示游码位置的选项 (填字母)。
⑶下列仪器中,量取水时需要用到d和仪器(填序号)
a.烧杯b.100mL量筒c.1000mL量筒d.滴管
e.玻璃棒f.药匙g.蒸发皿
⑷溶解:将氢氧化钠固体溶于水,用______搅拌,使氢氧化钠全部溶解,冷却至室温。
⑸把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
例2、下图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、
和玻璃棒,其中玻璃棒在此操作中的作用是
。
(2)指出图②中的一处错误操作
。
(3)用上述图示的序号表示配制溶液的操作顺序
。
例3、溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作.下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).
溶液中溶质的质量分数/%
4
12
16
24
28
硫酸溶液的密度/g/mL
1.02
1.08
1.11
1.17
1.20
氨水的密度/g/mL
0.98
0.95
0.94
0.91
0.90
请仔细分析后回答下列问题:
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐
(填增大、减小或不变);氨水的密度逐渐
(填增大、减小或不变)
取12%的硫酸溶液100%配制成6%的溶液,向100g12%的硫酸溶液中加水的质量应
100g(填大于、小于或等于).21世纪教育网版权所有
(3)向100g24%的氨水中加入100g水,摇匀,溶液体积是
mL(保留到0.1)
1、用氯化钠固体配制一定质量分数的氯化钠溶液,必须使用的一组仪器是( )
A.天平、烧杯、量筒、玻璃棒、药匙
B.天平、烧杯、漏斗、蒸发皿、玻璃棒
C.天平、烧杯、量筒、铁架台、药匙
D.天平、集气瓶、漏斗、蒸发皿、玻璃棒
2、.实验室里用已知溶质质量分数的浓盐酸(密度已知),配制成一定溶质质量分数的稀盐酸。操作步骤有:a.量取
b.计算
c.称量
d.稀释,则下列操作步骤正确的是(
)
A.a→b→c→d
B.b→c→d
C.b→a→c→d
D.b→a→d
3、要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90mL水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
4、农业上常用质量分数为16%的氯化钠溶液来选种。下列方法能配制出该选种溶液的是(
)
A.4g氯化钠和16g水
B.16g20%的氯化钠溶液和5g水
C.10g8%的氯化钠溶液蒸发4g水
D.14g10%的氯化钠溶液和1g氯化钠
5、制作“叶脉书签”需要配制100g12%的NaOH溶液(设水的密度为1g/mL)。下列操作正确的是(
)
A.称量前调节天平平衡时发现指针向右偏转,可调节游码
B.在左右托盘上垫滤纸称取12.0gNaOH固体
C.将准确称取的NaOH固体直接倒入装有水的量筒中溶解
D.选用100mL量筒量取88.0mL的水
6、配制20%的氯化钠溶液时,不会引起溶液中氯化钠的质量分数偏小的是(
)
A.氯化钠晶体不纯
B.转移已配好的溶液时,有少量液体溅出
C.用量筒取水时仰视读数
D.烧杯用蒸馏水润洗后再配制溶液
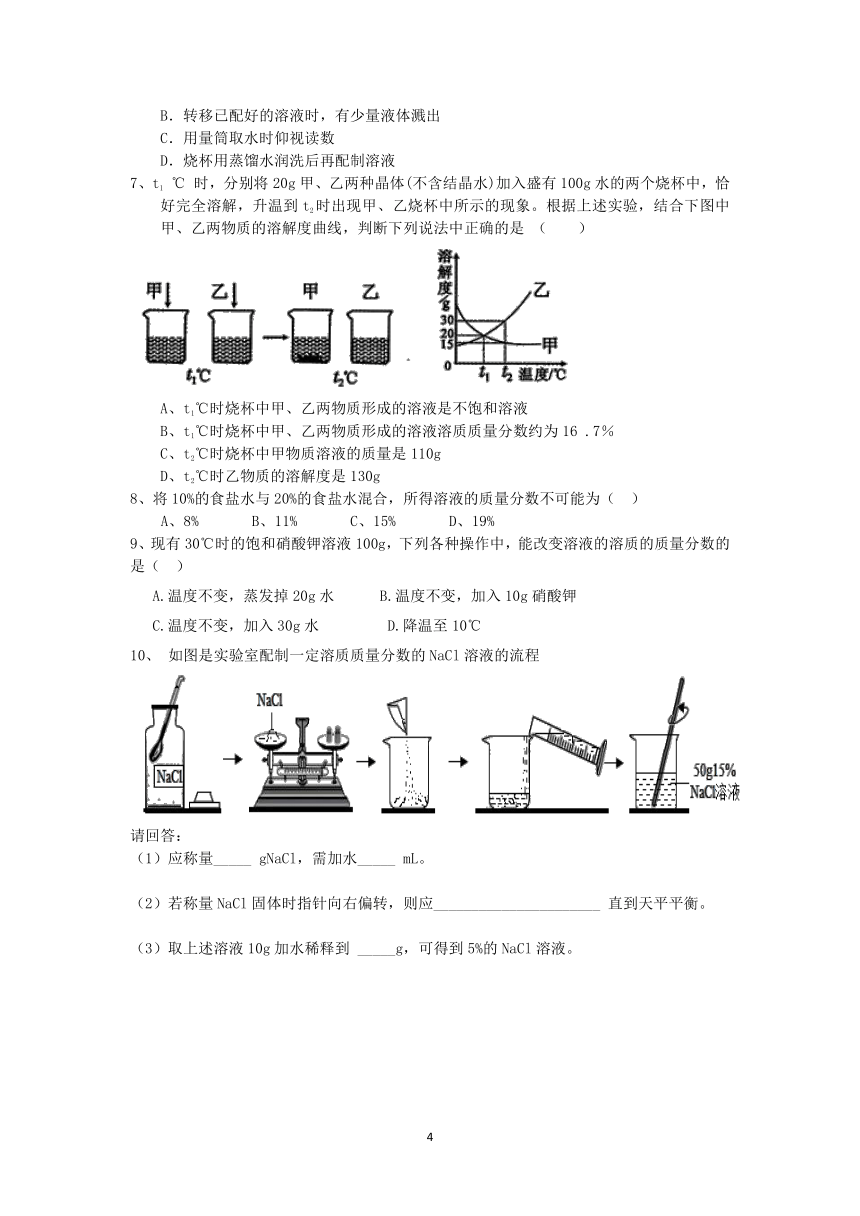
7、t1
℃
时,分别将20g甲、乙两种晶体(不含结晶水)加入盛有100g水的两个烧杯中,恰好完全溶解,升温到t2时出现甲、乙烧杯中所示的现象。根据上述实验,结合下图中甲、乙两物质的溶解度曲线,判断下列说法中正确的是
(
)
A、t1℃时烧杯中甲、乙两物质形成的溶液是不饱和溶液
B、t1℃时烧杯中甲、乙两物质形成的溶液溶质质量分数约为16
.7%
C、t2℃时烧杯中甲物质溶液的质量是110g
D、t2℃时乙物质的溶解度是130g
8、将10%的食盐水与20%的食盐水混合,所得溶液的质量分数不可能为(
)
A、8%
B、11%
C、15%
D、19%
9、现有30℃时的饱和硝酸钾溶液100g,下列各种操作中,能改变溶液的溶质的质量分数的是(
)
A.温度不变,蒸发掉20g水 B.温度不变,加入10g硝酸钾
C.温度不变,加入30g水 ?
D.降温至10℃
10、
如图是实验室配制一定溶质质量分数的NaCl溶液的流程
请回答:
(1)应称量_____
gNaCl,需加水_____
mL。
(2)若称量NaCl固体时指针向右偏转,则应______________________
直到天平平衡。
(3)取上述溶液10g加水稀释到
_____g,可得到5%的NaCl溶液。
11、下列是配制一定溶质质量分数的氯化钠溶液的实验图示。请回答下列问题:
(1)在量取水的操作中,当水面接近所需刻度时,应使用_____添加水。
(2)指出图A中的错误操作_____。
(3)将图A中错误操作改正后,用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,接
下来的操作应是_____。
(4)在其他操作无错误的前提下,量取所需要的水时,按图B进行操作,一定能导致所配制溶液的溶
质质量分数_____(填“偏大”、“不变”或“偏小”)。
(5)图D中玻璃棒的作用是_____。
(6)实验室用50g98%的浓硫酸配制成20%的稀硫酸,需要水的质量_____g。配制该溶液的操作方法是。
12、市售浓盐酸的溶质质量分数为37%,密度为1.18g/mL.用这种浓盐酸配制50g溶质质量分数为5%的盐酸,需要水和浓盐酸的体积各为多少?(结果保留两位小数)
13、现有一瓶未开启的浓盐酸,试剂瓶标签上的部分内容如下图所示,欲将10mL的浓盐酸稀释为7.3%的稀盐酸,需加水多少克?
1、下列有关溶液的说法正确的是( )
溶液是均一、稳定的,所以均一、稳定的物质一定是溶液
两种液体混合经充分振荡后一定得到溶液
将10%的KNO3,溶液倒出一半,剩余溶液中溶质的质量分数为20%
将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20%
现有100克溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数增加一倍,下列
操作中正确的是( )
A.加入食盐10克
B.加入水50克
C.蒸发掉溶剂的一半
D.加入100克溶质质量分数为30%的食盐溶液
3、化学兴趣小组要在实验室中配制一定溶质质量分数的氯化钠溶液。
(1)甲图中缺少一种必须用到的玻璃仪器是_____(填写名称),其作用是_____。
(2)在用量筒量取蒸馏水时,读数时视线应该与_____保持水平。
(3)准确称量氯化钠18g,量取蒸馏水的体积如乙图所示,完全溶解后所得溶液中溶质质量分数是_____(水的密度为1g?cm-3)。
(4)若他们在量取溶剂时,俯视量筒读数,会导致所配的溶液溶质质量分数_____(填“增大”“减少”或“不变”)
4、20℃时,100克饱和石灰水加入10克生石灰后溶液温度_______(填“升高”、“降低”或“不变”);溶液质量_______(填“增加”、“减少”、“不变”);恢复到20℃后所得溶液中溶质质量分数_______(填“增加”、“减少”、“不变”)。
5、小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验:
请回答:
(1)操作中不规范的步骤是________(填序号)。
(2)改正后,图示实验中正确的操作顺序是________(填字号)。
(3)⑤中玻璃棒作用是________。
(4)小丽发现图示实验操作步骤不完整,应补充的是________。
6、小华实验操作考试的题目是:配制一定溶质质量分数的碳酸钠溶液并测定其酸碱度.考试时,小华进行了如图1所示的操作:
(1)称量时C出现了右盘低的现象,则接下来小华的操作是________。
(2)以上实验的正确操作顺序为________(用字母表示)。
(3)小华量取蒸馏水的体积如图2所示,则小华配制的碳酸钠溶液中溶质的质量分数为________。
(4)下列原因能导致溶质质量分数偏低的是________(填序号)。
①碳酸钠不纯 ②称量时,砝码和药品放错
③向烧杯中倒水时,有水洒出 ④量取水仰视凹液面最低处读数
(5)小华用湿润的pH试纸测定所配制溶液的pH,则结果________。(填“偏大”、“偏小”或“不变”)
7、某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算用40%的浓硫酸(密度为1.30g/cm3)10ml配制2%的稀硫酸,需加水多少毫升?(密度为1.0g/cm3)
参考答案
例1、(1)40
960
(2)左
在“50”和“10”下面打√
B
(3)c
(4)玻璃棒
例2、(1)烧杯
搅拌,加快溶解速度
(2)食盐和砝码放错了盘
(3)④②①⑤③
例3、(1)增大
减小
(2)等于
(3)210.5
1、A
2、D
3、D
4、D
5、D
6、B
7、B
8、A
9、D
10、
(1)7.5;42.5;(2)继续向左盘添加氯化钠;(3)30。
11、(1)胶头滴管;(2)砝码与药品位置放反了;(3)减少NaCl,直至天平平衡;
(4)偏小;(5)搅拌,加快溶解速率;(6)195;计算、量取、溶解。
12、需要水和浓盐酸的体积各为43.24ml,5.73mL
13、需加水47.2g克
1、D
2、D
3、(1)玻璃棒;搅拌,加快溶解速率;(2)凹液面的最低处;(3)18%;(4)增大。
4、升高;减小;不变。
5、(1)③;(2)②①④③⑤.(3)搅拌,加速溶解。(4)装瓶贴标签。
6、(1)继续加药品,直至天平平衡;(2)E、C、A、D、B;(3)16%;(4)①②④;
(5)偏小。
7、需加水247ml
(
1
)
2020浙教版科学八年级上册暑期培优“胜人一筹”讲义(
七
):
)
(
溶质质量分数
)
1.溶质的质量分数
(1)概念:溶质的质量与溶液的质量之比,可用小数或百分数表示。
(2)科学上用溶质的质量分数来定量表示溶液的组成。
(3)有关计算公式
溶质的质量分数=×l00%=×l00%
2.配制溶液时,固体用天平称取,液体用量筒量取,倒入烧杯中配制。
步骤:计算、称量、量取、溶解、装瓶贴标签。
【误差分析】
(1)偏小:
①天平使用不正确,如药品、砝码放反(称量时使用游码),使药品称量质量偏小。
②量取水的过程中仰视读数,使水量取多了。
③烧杯不干燥,原来内部就有一些水。
④固体药品中含有杂质等。
(2)偏大:
①天平使用不正确,如称量前没有调平衡,指针偏右,导致药品称量偏多。
②砝码已生锈,导致药品称量偏多。
③量取水的过程中俯视读数,使水量取少了。
④将量筒中的水倒入烧杯中时,一部分洒在外面等。
3、溶液稀释和浓缩前后溶质的质量不变
即m浓×p浓%=(m浓+m水)×p稀%
m浓——浓溶液的质量
p浓%——浓溶液的质量分数
p稀%——稀溶液的质量分数
4、相同溶质不同质量分数的两种溶液混合
m浓×p浓%+m稀×p稀%=
(m浓
+
m稀)×p混%
m稀——稀溶液的质量
p混%——混合溶液的质量分数
5、溶液体积、质量、密度三者之间的关系:
溶液的质量=溶液的体积×溶液的密度
例1、实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液。配制步骤为:
⑴计算:需氢氧化钠固体__ _____g,水__ ___mL(水的密度是1g/cm3)
⑵称量:用质量为23.1g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘。在下表所列的砝码中,选出所需砝码(打“√”表示选用):
砝码/g
100
50
20
20
10
5
打“√”表示选用
并在下列标尺中选出能正确表示游码位置的选项 (填字母)。
⑶下列仪器中,量取水时需要用到d和仪器(填序号)
a.烧杯b.100mL量筒c.1000mL量筒d.滴管
e.玻璃棒f.药匙g.蒸发皿
⑷溶解:将氢氧化钠固体溶于水,用______搅拌,使氢氧化钠全部溶解,冷却至室温。
⑸把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。
例2、下图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、
和玻璃棒,其中玻璃棒在此操作中的作用是
。
(2)指出图②中的一处错误操作
。
(3)用上述图示的序号表示配制溶液的操作顺序
。
例3、溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作.下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).
溶液中溶质的质量分数/%
4
12
16
24
28
硫酸溶液的密度/g/mL
1.02
1.08
1.11
1.17
1.20
氨水的密度/g/mL
0.98
0.95
0.94
0.91
0.90
请仔细分析后回答下列问题:
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐
(填增大、减小或不变);氨水的密度逐渐
(填增大、减小或不变)
取12%的硫酸溶液100%配制成6%的溶液,向100g12%的硫酸溶液中加水的质量应
100g(填大于、小于或等于).21世纪教育网版权所有
(3)向100g24%的氨水中加入100g水,摇匀,溶液体积是
mL(保留到0.1)
1、用氯化钠固体配制一定质量分数的氯化钠溶液,必须使用的一组仪器是( )
A.天平、烧杯、量筒、玻璃棒、药匙
B.天平、烧杯、漏斗、蒸发皿、玻璃棒
C.天平、烧杯、量筒、铁架台、药匙
D.天平、集气瓶、漏斗、蒸发皿、玻璃棒
2、.实验室里用已知溶质质量分数的浓盐酸(密度已知),配制成一定溶质质量分数的稀盐酸。操作步骤有:a.量取
b.计算
c.称量
d.稀释,则下列操作步骤正确的是(
)
A.a→b→c→d
B.b→c→d
C.b→a→c→d
D.b→a→d
3、要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90mL水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
4、农业上常用质量分数为16%的氯化钠溶液来选种。下列方法能配制出该选种溶液的是(
)
A.4g氯化钠和16g水
B.16g20%的氯化钠溶液和5g水
C.10g8%的氯化钠溶液蒸发4g水
D.14g10%的氯化钠溶液和1g氯化钠
5、制作“叶脉书签”需要配制100g12%的NaOH溶液(设水的密度为1g/mL)。下列操作正确的是(
)
A.称量前调节天平平衡时发现指针向右偏转,可调节游码
B.在左右托盘上垫滤纸称取12.0gNaOH固体
C.将准确称取的NaOH固体直接倒入装有水的量筒中溶解
D.选用100mL量筒量取88.0mL的水
6、配制20%的氯化钠溶液时,不会引起溶液中氯化钠的质量分数偏小的是(
)
A.氯化钠晶体不纯
B.转移已配好的溶液时,有少量液体溅出
C.用量筒取水时仰视读数
D.烧杯用蒸馏水润洗后再配制溶液
7、t1
℃
时,分别将20g甲、乙两种晶体(不含结晶水)加入盛有100g水的两个烧杯中,恰好完全溶解,升温到t2时出现甲、乙烧杯中所示的现象。根据上述实验,结合下图中甲、乙两物质的溶解度曲线,判断下列说法中正确的是
(
)
A、t1℃时烧杯中甲、乙两物质形成的溶液是不饱和溶液
B、t1℃时烧杯中甲、乙两物质形成的溶液溶质质量分数约为16
.7%
C、t2℃时烧杯中甲物质溶液的质量是110g
D、t2℃时乙物质的溶解度是130g
8、将10%的食盐水与20%的食盐水混合,所得溶液的质量分数不可能为(
)
A、8%
B、11%
C、15%
D、19%
9、现有30℃时的饱和硝酸钾溶液100g,下列各种操作中,能改变溶液的溶质的质量分数的是(
)
A.温度不变,蒸发掉20g水 B.温度不变,加入10g硝酸钾
C.温度不变,加入30g水 ?
D.降温至10℃
10、
如图是实验室配制一定溶质质量分数的NaCl溶液的流程
请回答:
(1)应称量_____
gNaCl,需加水_____
mL。
(2)若称量NaCl固体时指针向右偏转,则应______________________
直到天平平衡。
(3)取上述溶液10g加水稀释到
_____g,可得到5%的NaCl溶液。
11、下列是配制一定溶质质量分数的氯化钠溶液的实验图示。请回答下列问题:
(1)在量取水的操作中,当水面接近所需刻度时,应使用_____添加水。
(2)指出图A中的错误操作_____。
(3)将图A中错误操作改正后,用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,接
下来的操作应是_____。
(4)在其他操作无错误的前提下,量取所需要的水时,按图B进行操作,一定能导致所配制溶液的溶
质质量分数_____(填“偏大”、“不变”或“偏小”)。
(5)图D中玻璃棒的作用是_____。
(6)实验室用50g98%的浓硫酸配制成20%的稀硫酸,需要水的质量_____g。配制该溶液的操作方法是。
12、市售浓盐酸的溶质质量分数为37%,密度为1.18g/mL.用这种浓盐酸配制50g溶质质量分数为5%的盐酸,需要水和浓盐酸的体积各为多少?(结果保留两位小数)
13、现有一瓶未开启的浓盐酸,试剂瓶标签上的部分内容如下图所示,欲将10mL的浓盐酸稀释为7.3%的稀盐酸,需加水多少克?
1、下列有关溶液的说法正确的是( )
溶液是均一、稳定的,所以均一、稳定的物质一定是溶液
两种液体混合经充分振荡后一定得到溶液
将10%的KNO3,溶液倒出一半,剩余溶液中溶质的质量分数为20%
将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20%
现有100克溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数增加一倍,下列
操作中正确的是( )
A.加入食盐10克
B.加入水50克
C.蒸发掉溶剂的一半
D.加入100克溶质质量分数为30%的食盐溶液
3、化学兴趣小组要在实验室中配制一定溶质质量分数的氯化钠溶液。
(1)甲图中缺少一种必须用到的玻璃仪器是_____(填写名称),其作用是_____。
(2)在用量筒量取蒸馏水时,读数时视线应该与_____保持水平。
(3)准确称量氯化钠18g,量取蒸馏水的体积如乙图所示,完全溶解后所得溶液中溶质质量分数是_____(水的密度为1g?cm-3)。
(4)若他们在量取溶剂时,俯视量筒读数,会导致所配的溶液溶质质量分数_____(填“增大”“减少”或“不变”)
4、20℃时,100克饱和石灰水加入10克生石灰后溶液温度_______(填“升高”、“降低”或“不变”);溶液质量_______(填“增加”、“减少”、“不变”);恢复到20℃后所得溶液中溶质质量分数_______(填“增加”、“减少”、“不变”)。
5、小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验:
请回答:
(1)操作中不规范的步骤是________(填序号)。
(2)改正后,图示实验中正确的操作顺序是________(填字号)。
(3)⑤中玻璃棒作用是________。
(4)小丽发现图示实验操作步骤不完整,应补充的是________。
6、小华实验操作考试的题目是:配制一定溶质质量分数的碳酸钠溶液并测定其酸碱度.考试时,小华进行了如图1所示的操作:
(1)称量时C出现了右盘低的现象,则接下来小华的操作是________。
(2)以上实验的正确操作顺序为________(用字母表示)。
(3)小华量取蒸馏水的体积如图2所示,则小华配制的碳酸钠溶液中溶质的质量分数为________。
(4)下列原因能导致溶质质量分数偏低的是________(填序号)。
①碳酸钠不纯 ②称量时,砝码和药品放错
③向烧杯中倒水时,有水洒出 ④量取水仰视凹液面最低处读数
(5)小华用湿润的pH试纸测定所配制溶液的pH,则结果________。(填“偏大”、“偏小”或“不变”)
7、某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应).试计算用40%的浓硫酸(密度为1.30g/cm3)10ml配制2%的稀硫酸,需加水多少毫升?(密度为1.0g/cm3)
参考答案
例1、(1)40
960
(2)左
在“50”和“10”下面打√
B
(3)c
(4)玻璃棒
例2、(1)烧杯
搅拌,加快溶解速度
(2)食盐和砝码放错了盘
(3)④②①⑤③
例3、(1)增大
减小
(2)等于
(3)210.5
1、A
2、D
3、D
4、D
5、D
6、B
7、B
8、A
9、D
10、
(1)7.5;42.5;(2)继续向左盘添加氯化钠;(3)30。
11、(1)胶头滴管;(2)砝码与药品位置放反了;(3)减少NaCl,直至天平平衡;
(4)偏小;(5)搅拌,加快溶解速率;(6)195;计算、量取、溶解。
12、需要水和浓盐酸的体积各为43.24ml,5.73mL
13、需加水47.2g克
1、D
2、D
3、(1)玻璃棒;搅拌,加快溶解速率;(2)凹液面的最低处;(3)18%;(4)增大。
4、升高;减小;不变。
5、(1)③;(2)②①④③⑤.(3)搅拌,加速溶解。(4)装瓶贴标签。
6、(1)继续加药品,直至天平平衡;(2)E、C、A、D、B;(3)16%;(4)①②④;
(5)偏小。
7、需加水247ml
(
1
)
同课章节目录
