人教版高中必修二化学2.1-化学能与热能(44张PPT)
文档属性
| 名称 | 人教版高中必修二化学2.1-化学能与热能(44张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-20 16:23:02 | ||
图片预览








文档简介
(共44张PPT)
能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。目前化石燃料(
煤、石油、天然气)是我们当下的主要能源,但不可再生人类面临能源枯竭的危机,在这方面化学能做出什么贡献?
科学视野
1.提高能源利用率
2.开辟新能源
第一节 化学能与热能
第1课时
第二章 化学反应与能量
学习目标:
1.了解化学反应中能量变化的主要原因
2.学会从化学键和物质的能量两个角度来判断一个反应是放出能量还是吸收能量
白磷的燃烧
氨的燃烧
反应中的能量变化
1、化学变化的特征:
有新物质生成,并且常常伴随着发光、放热、变色、放出气体、生成沉淀等现象的发生。
2、化学反应的作用:
⑴制取新物质;
⑵利用反应中的能量.
思考:燃料在燃烧反应中产生的热能来自哪里?
【自学导练】
请同学们快速默看P32前三
自然段,思考以下问题:
1、化学反应的能量从何而来?
2、化学反应到底是吸收能量还是
放出能量由什么决定?
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
==
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
形成
点燃
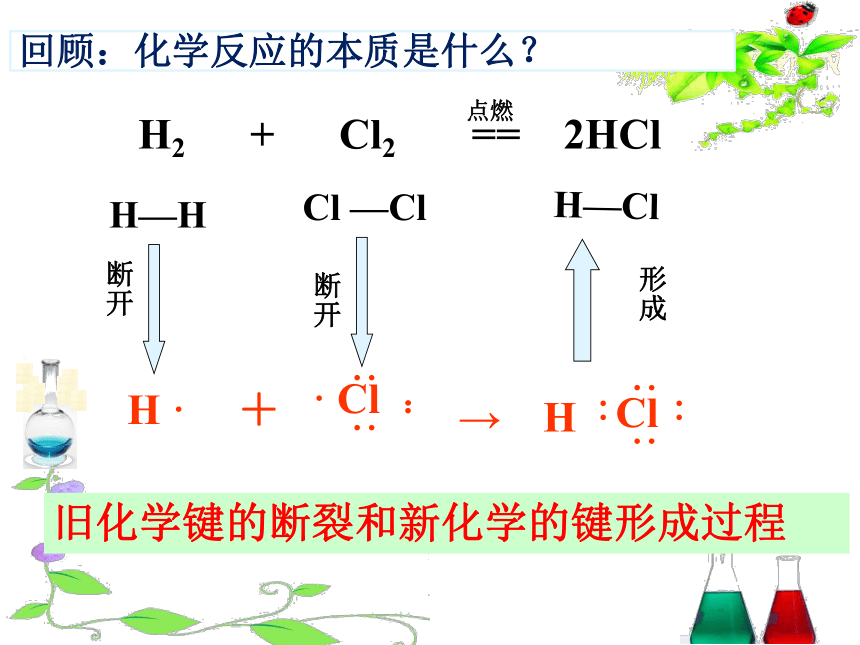
回顾:化学反应的本质是什么?
旧化学键的断裂和新化学的键形成过程
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
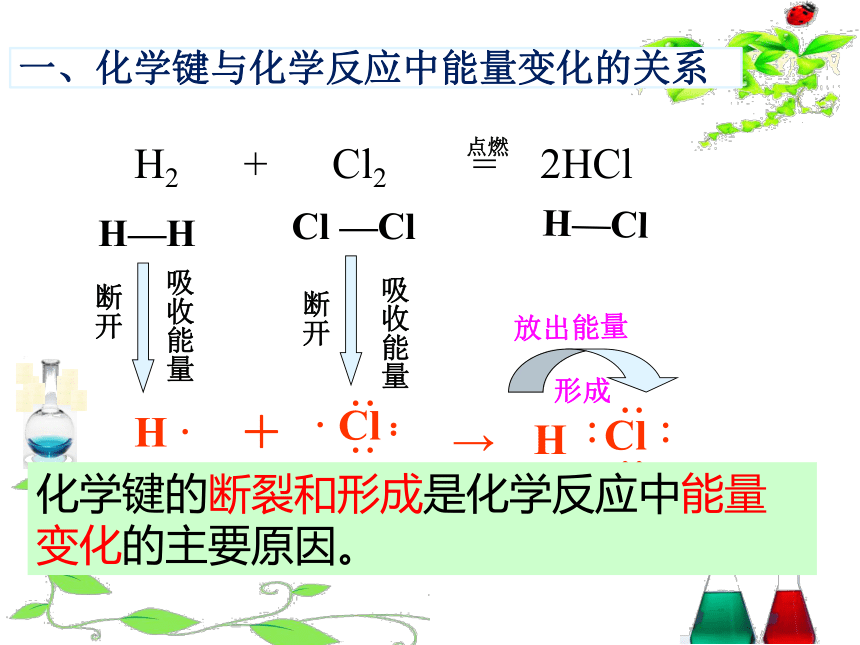
吸收能量
断开
断开
吸收能量
形成
放出能量
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
一、化学键与化学反应中能量变化的关系
吸收
放出
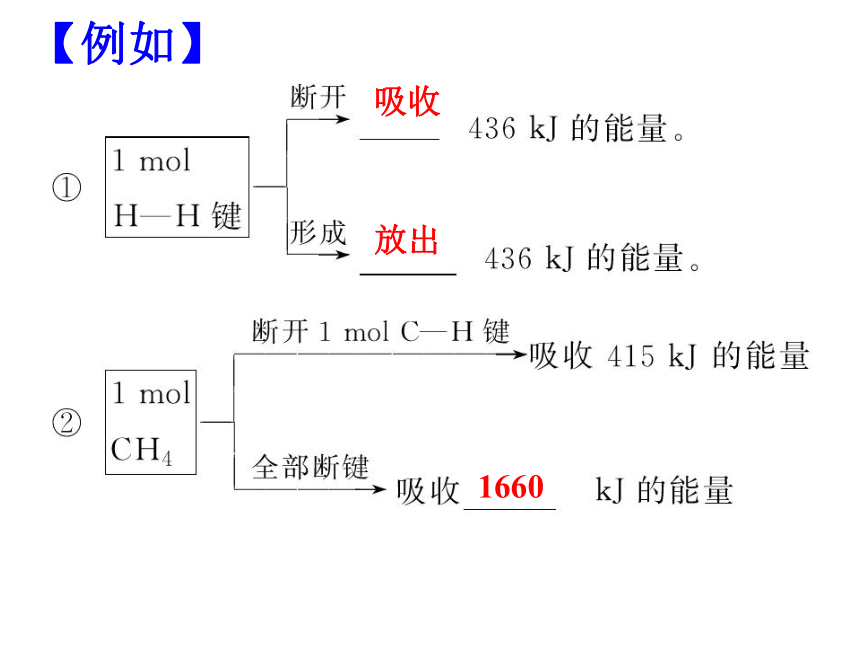
1660
【例如】
键能
:拆开1
mol某键所需的能量或形成1
mol该化学键所释放的能量叫键能。单位:kJ/mol。
键
H—H
Br—Br
I—I
Cl—Cl
H—F
H—Cl
H—Br
H—I
键能
436
193
151
247
570
431
396
299
某些化学键的键能(KJ/mol)
通常,键能越大,键越牢固,由该键构成的分子也越稳定。
有新物质生成
断裂
形成
吸收
放出
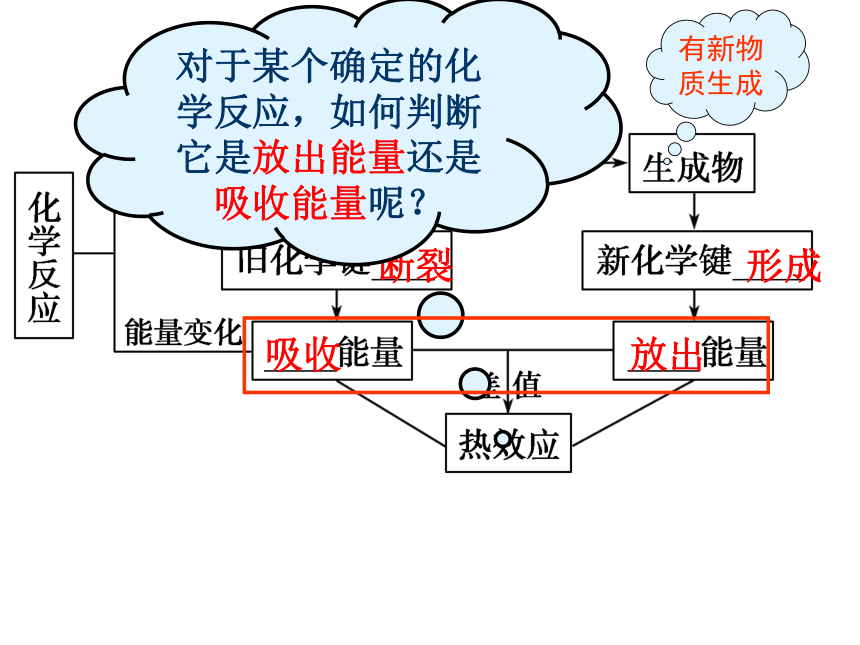
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
从化学键的角度来看
形成新键放出的总能量>断键吸收的总能量
断键吸收的总能量>形成新键放出的总能量
放出能量
吸收能量
疑难解析
436
kJ·mol-1
243
kJ·mol-1
431
kJ·mol-1
Cl2
H2
431kJ·mol-1
HCl
HCl
Cl
H
E放出=(431
+431)kJ
E吸收=
(243+436)kJ
E放出
-
E吸收=183
kJ
一、化学键与化学反应中能量变化的关系
2molH2和1molO2生成2molH2O的能量变化?
(H-H键能是436KJ/mol,O=O键能是496KJ/m,H-O键能是463KJ/mol)
小结:断键要吸收能量,成键要释放能量
E吸收=436kJX2
+496kJ=1368KJ
E放出=436kJX4=1852KJ
E放出
-
E吸收=484
kJ
该反应中放出484KJ的能量
【反馈形成】
【解疑精讲二】
思考:
1、化学反应到底是吸收能量还是
放出能量还可以由其他来决定吗?
2、物质所具有的能量与物质稳定性
之间有何种关系?
水由高处向低处流要释放能量(多出的势能转换为动能)
分析化学反应:
反应物的总能量>生成物的总能量
化学反应放出能量
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)
分析化学反应:
反应物的总能量
<生成物的总能量
化学反应吸收能量
图像表示:
放出能量
吸收能量
思考物质的稳定性与能量有何关系?????
物质具有的能量越高越不稳定
物质所具有的能量越低越稳定
1.下列各图,
表示反应吸收能量的是(
)
B
能量
反应物
生成物
0
反应进程
能量
反应物
生成物
0
反应进程
能量
反应物
生成物
0
反应进程
生成物
0
反应进程
能量
反应物
B
A
C
D
【课堂过关检测】
烩贾蒜誉荷读宛形拟奴挑檬渗德碳爬捌板铲核径泣盾粒称迫旅慌阁甄埔稽化学能与热能课件第1课时课件化学能与热能课件第1课时课件
键能
含该键的物质越稳定
物质的能量
该物质越稳定
越大
越低
三、物质的稳定性与物质的键能和能量关系
总结
二、化学反应的能量变化与物质总能量和化学键键的关系:
一、化学反应中能量变化原因
(1)微观:化学键的断裂和形成是化学反应中能量变化的主要原因。
(2)宏观:化学反应中,化学反应中能量变化主要取决于反应物的总能量和生成物的总能量的相对大小。
断键吸收总能量
<成键放出总能量
断键吸收总能量
>
成键放出总能量
反应物的总能量
<生成物的总能量
反应放出能量
反应吸收能量
反应物的总能量
>生成物的总能量
1、金刚石和石墨是碳元素的两种结构不同的单质
(同素异形体)。在100
kPa时,1
mol石墨转化为金刚石,要吸收1.895
kJ的热能。据此,试判断在100
kPa压强下,下列结论正确的是[??
?
]
A、石墨和金刚石不能相互转化
B
、金刚石比石墨稳定
C、1
mol石墨比1
mol金刚石的总能量高
D、1
mol金刚石比1
mol石墨的总能量高
【课堂练习】
D?
C
2.已知反应A+B=C+D为放热反应,对该反应
的下列说法中正确的是(
)
A.
A的能量一定高于C
B.
B的能量一定高于D
C.
A和B的总能量一定高于C和D的总能量
D.
该反应为放热反应,故不必加热就一定
能发生
3、下表中的数据是破坏1mol物质中的化学键所消耗的能量(KJ)
(1)下列物质本身具有的能量最低的是(
)
A
H2
B
Cl2
C
Br2
D
I2
(2)下列氢化物中最稳定的是(
)
A
HCl
B
HBr
C
H
I
物质
H2
Cl2
Br2
I2
HCl
HBr
HI
能量
436
243
193
151
432
366
298
A
A
第2课时
化学能与热能的相互转化
焕艘逞刷鸯富休详侈动图势裳守息抬颇丛话决迁发天巡湿笋暗笼驶幼穴诡化学能与热能课件第1课时课件化学能与热能课件第1课时课件
学习目标:
1.了解化学能与热能的相互转化
2.能熟练判断一个化学反应是放热反应还是吸热反应
3.知道常见的吸热反应和放热反应
4.了解化学能的应用及人类能源利用的历史和前景,提高节能意识
加热剂是分开包装的生石灰和水,生石灰和水混合,加热食品。
锭墟同胃行灿换谁辊扛裔胶疫洛愿唱钉亲桩和贿戚狞阻拭端茨饰逃舀剩秸化学能与热能课件第1课时课件化学能与热能课件第1课时课件
自热米饭
摇摇冰
在饮料罐的夹层中分别装有硝酸铵和水。喝的时候将底部的旋钮转一下,旋钮转动将装水的小袋划破,倒过来,摇一摇,使硝酸铵和水混合,罐内饮料就会变成冷饮。
????
利糠爽旦渗植碘熙诉苍耻祖精姨槐泄浸赣清丛龚斜牢劲吸魁蛛秒字又亨刑化学能与热能课件第1课时课件化学能与热能课件第1课时课件
化学上把放出能量的化学反应叫做放热反应。
化学上把吸收能量的化学反应叫做吸热反应。
一.化学反应中的热量变化
1.放热反应和吸热反应
如何确定一个化学反应是放热还是吸热?
微观角度:取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小;
宏观角度:即取决于反应物的总能量与生成物的总能量的相对大小。
1.下列各图中,表示该化学反应是吸热反应的是( )
A
下面我们一起通过实验来认识和感受一下化学能与热能的相互转化!
现象
结论
实验
2-1:盐酸与铝条的反应
实验
2-2:Ba(OH)2·
8H2O与NH4Cl的反应
现象
结论
反应放出热量
有气泡放出,温度升高
有刺激性气味,烧杯变冷,烧杯下面的玻璃片被冻在一起,混合物呈糊状
反应吸收热量
金属与酸或水的反应一般都是放热反应。
Ba(OH)2·8H2O+2NH4Cl
=
BaCl2+2NH3↑+10H2O
实验
2-3:盐酸与NaOH的反应
现象
结论
反应后温度升高
反应放出热量
H+
+
OH-
=
H2O
中和热:酸与碱发生中和反应生成1molH2O时
所释放的热量称为中和热
中和热的测定
装置
保温、隔热、减少实验过程中的热量损失
常见的放热反应和吸热反应
吸热反应
放热反应
(1)所有的燃烧反应
(3)酸碱中和反应
(2)金属与酸或水的反应
(4)C与H2O(g)的反应
(5)缓慢氧化:食物的腐败
(1)大多数分解反应
(2)Ba(OH)2·8H2O晶体与
NH4Cl晶体的反应
(3)C、H2或CO还原金属氧
化物的反应
(4)大多数化合反应
(5)C与CO2的反应
判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.高温煅烧石灰石。
3.氧化钙与水的反应。
4.盐酸与氢氧化钠溶液反应
课堂练习:
放热
放热
放热
吸热
5.高温下木炭与CO2反应生成一氧化碳。
6.炸药爆炸
7.Ca(OH)2和NH4Cl的反应
8.炽热的碳与H2O(g)的反应
9.甲烷在氧气中的燃烧
放热
吸热
放热
吸热
吸热
2、吸热反应一定要加热,而放热反应一定不加热?
不一定,反应放热和吸热与反应条件无关如:Ba(OH)2·8H2O与NH4Cl(吸热反应)常温可以进行,Fe+S
FeS(放热反应)
1、浓硫酸溶于水,是放热反应吗?
不是,吸热反应和放热反应是对化学反应的分类结果。浓硫酸溶于水可称为放热过程。
【思考与交流】
[例1]由图
分析,下列说法
正确的是( )。
A.A===B+C
与
B+C===A
两个反应吸收和放出的
热量不等
B.A===B+C
是放热反应
C.A
具有的能量高于
B
和
C
具有的能量总和
D.A===B+C
是吸热反应,B+C===A
必然是放热反应
D
2.在反应H2
+
Cl2
=2HCl中,已知断裂1molH-H需要能量为Q1,断裂1mol
Cl-Cl键需要能量为Q2,形成1mol
H-Cl放出能量为Q3,下列关系式正确的是(
)
A.
Q1+Q2
>
Q3
B.
Q1+Q2
<
Q3
C.
Q1+Q2
>
2Q3
D.
Q1+Q2
<
2Q3
D
弧寸寸曙闸签逢双禽赐循刀樱舌均王乌逮关窟枷考琅涅蹈癸揽装殷莹待谬化学能与热能课件第1课时课件化学能与热能课件第1课时课件
化学能的应用
利用化学反应产生的热量进行生活、生产和科研。
利用热能使很多化学反应得以发生,从
而制备所需的物质。
化学能
热能
提供了人类生存和发展的能量和动力
进行化工生产、研制新的物质
1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
4、化学反应中能量转化遵循能量守衡原则。
【本节小结】
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
【科学视野】
启示:
生物化学过程在利用“能源”上更为合理、有效。
科学视野
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
启示:
生物化学过程在利用“能源”上更为合理、有效。
科学视野
1、社会发展与能源利用
2、人类利用能源的三个阶段
柴草时期
化石能源时期
多能源结构时期
能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。目前化石燃料(
煤、石油、天然气)是我们当下的主要能源,但不可再生人类面临能源枯竭的危机,在这方面化学能做出什么贡献?
科学视野
1.提高能源利用率
2.开辟新能源
第一节 化学能与热能
第1课时
第二章 化学反应与能量
学习目标:
1.了解化学反应中能量变化的主要原因
2.学会从化学键和物质的能量两个角度来判断一个反应是放出能量还是吸收能量
白磷的燃烧
氨的燃烧
反应中的能量变化
1、化学变化的特征:
有新物质生成,并且常常伴随着发光、放热、变色、放出气体、生成沉淀等现象的发生。
2、化学反应的作用:
⑴制取新物质;
⑵利用反应中的能量.
思考:燃料在燃烧反应中产生的热能来自哪里?
【自学导练】
请同学们快速默看P32前三
自然段,思考以下问题:
1、化学反应的能量从何而来?
2、化学反应到底是吸收能量还是
放出能量由什么决定?
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
==
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
形成
点燃
回顾:化学反应的本质是什么?
旧化学键的断裂和新化学的键形成过程
H
·
··
·
Cl
··
:
+
→
Cl
··
··
H
··
··
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
吸收能量
断开
断开
吸收能量
形成
放出能量
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
一、化学键与化学反应中能量变化的关系
吸收
放出
1660
【例如】
键能
:拆开1
mol某键所需的能量或形成1
mol该化学键所释放的能量叫键能。单位:kJ/mol。
键
H—H
Br—Br
I—I
Cl—Cl
H—F
H—Cl
H—Br
H—I
键能
436
193
151
247
570
431
396
299
某些化学键的键能(KJ/mol)
通常,键能越大,键越牢固,由该键构成的分子也越稳定。
有新物质生成
断裂
形成
吸收
放出
对于某个确定的化学反应,如何判断它是放出能量还是吸收能量呢?
从化学键的角度来看
形成新键放出的总能量>断键吸收的总能量
断键吸收的总能量>形成新键放出的总能量
放出能量
吸收能量
疑难解析
436
kJ·mol-1
243
kJ·mol-1
431
kJ·mol-1
Cl2
H2
431kJ·mol-1
HCl
HCl
Cl
H
E放出=(431
+431)kJ
E吸收=
(243+436)kJ
E放出
-
E吸收=183
kJ
一、化学键与化学反应中能量变化的关系
2molH2和1molO2生成2molH2O的能量变化?
(H-H键能是436KJ/mol,O=O键能是496KJ/m,H-O键能是463KJ/mol)
小结:断键要吸收能量,成键要释放能量
E吸收=436kJX2
+496kJ=1368KJ
E放出=436kJX4=1852KJ
E放出
-
E吸收=484
kJ
该反应中放出484KJ的能量
【反馈形成】
【解疑精讲二】
思考:
1、化学反应到底是吸收能量还是
放出能量还可以由其他来决定吗?
2、物质所具有的能量与物质稳定性
之间有何种关系?
水由高处向低处流要释放能量(多出的势能转换为动能)
分析化学反应:
反应物的总能量>生成物的总能量
化学反应放出能量
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)
分析化学反应:
反应物的总能量
<生成物的总能量
化学反应吸收能量
图像表示:
放出能量
吸收能量
思考物质的稳定性与能量有何关系?????
物质具有的能量越高越不稳定
物质所具有的能量越低越稳定
1.下列各图,
表示反应吸收能量的是(
)
B
能量
反应物
生成物
0
反应进程
能量
反应物
生成物
0
反应进程
能量
反应物
生成物
0
反应进程
生成物
0
反应进程
能量
反应物
B
A
C
D
【课堂过关检测】
烩贾蒜誉荷读宛形拟奴挑檬渗德碳爬捌板铲核径泣盾粒称迫旅慌阁甄埔稽化学能与热能课件第1课时课件化学能与热能课件第1课时课件
键能
含该键的物质越稳定
物质的能量
该物质越稳定
越大
越低
三、物质的稳定性与物质的键能和能量关系
总结
二、化学反应的能量变化与物质总能量和化学键键的关系:
一、化学反应中能量变化原因
(1)微观:化学键的断裂和形成是化学反应中能量变化的主要原因。
(2)宏观:化学反应中,化学反应中能量变化主要取决于反应物的总能量和生成物的总能量的相对大小。
断键吸收总能量
<成键放出总能量
断键吸收总能量
>
成键放出总能量
反应物的总能量
<生成物的总能量
反应放出能量
反应吸收能量
反应物的总能量
>生成物的总能量
1、金刚石和石墨是碳元素的两种结构不同的单质
(同素异形体)。在100
kPa时,1
mol石墨转化为金刚石,要吸收1.895
kJ的热能。据此,试判断在100
kPa压强下,下列结论正确的是[??
?
]
A、石墨和金刚石不能相互转化
B
、金刚石比石墨稳定
C、1
mol石墨比1
mol金刚石的总能量高
D、1
mol金刚石比1
mol石墨的总能量高
【课堂练习】
D?
C
2.已知反应A+B=C+D为放热反应,对该反应
的下列说法中正确的是(
)
A.
A的能量一定高于C
B.
B的能量一定高于D
C.
A和B的总能量一定高于C和D的总能量
D.
该反应为放热反应,故不必加热就一定
能发生
3、下表中的数据是破坏1mol物质中的化学键所消耗的能量(KJ)
(1)下列物质本身具有的能量最低的是(
)
A
H2
B
Cl2
C
Br2
D
I2
(2)下列氢化物中最稳定的是(
)
A
HCl
B
HBr
C
H
I
物质
H2
Cl2
Br2
I2
HCl
HBr
HI
能量
436
243
193
151
432
366
298
A
A
第2课时
化学能与热能的相互转化
焕艘逞刷鸯富休详侈动图势裳守息抬颇丛话决迁发天巡湿笋暗笼驶幼穴诡化学能与热能课件第1课时课件化学能与热能课件第1课时课件
学习目标:
1.了解化学能与热能的相互转化
2.能熟练判断一个化学反应是放热反应还是吸热反应
3.知道常见的吸热反应和放热反应
4.了解化学能的应用及人类能源利用的历史和前景,提高节能意识
加热剂是分开包装的生石灰和水,生石灰和水混合,加热食品。
锭墟同胃行灿换谁辊扛裔胶疫洛愿唱钉亲桩和贿戚狞阻拭端茨饰逃舀剩秸化学能与热能课件第1课时课件化学能与热能课件第1课时课件
自热米饭
摇摇冰
在饮料罐的夹层中分别装有硝酸铵和水。喝的时候将底部的旋钮转一下,旋钮转动将装水的小袋划破,倒过来,摇一摇,使硝酸铵和水混合,罐内饮料就会变成冷饮。
????
利糠爽旦渗植碘熙诉苍耻祖精姨槐泄浸赣清丛龚斜牢劲吸魁蛛秒字又亨刑化学能与热能课件第1课时课件化学能与热能课件第1课时课件
化学上把放出能量的化学反应叫做放热反应。
化学上把吸收能量的化学反应叫做吸热反应。
一.化学反应中的热量变化
1.放热反应和吸热反应
如何确定一个化学反应是放热还是吸热?
微观角度:取决于所有断键吸收的总能量与所有形成新键放出的总能量的相对大小;
宏观角度:即取决于反应物的总能量与生成物的总能量的相对大小。
1.下列各图中,表示该化学反应是吸热反应的是( )
A
下面我们一起通过实验来认识和感受一下化学能与热能的相互转化!
现象
结论
实验
2-1:盐酸与铝条的反应
实验
2-2:Ba(OH)2·
8H2O与NH4Cl的反应
现象
结论
反应放出热量
有气泡放出,温度升高
有刺激性气味,烧杯变冷,烧杯下面的玻璃片被冻在一起,混合物呈糊状
反应吸收热量
金属与酸或水的反应一般都是放热反应。
Ba(OH)2·8H2O+2NH4Cl
=
BaCl2+2NH3↑+10H2O
实验
2-3:盐酸与NaOH的反应
现象
结论
反应后温度升高
反应放出热量
H+
+
OH-
=
H2O
中和热:酸与碱发生中和反应生成1molH2O时
所释放的热量称为中和热
中和热的测定
装置
保温、隔热、减少实验过程中的热量损失
常见的放热反应和吸热反应
吸热反应
放热反应
(1)所有的燃烧反应
(3)酸碱中和反应
(2)金属与酸或水的反应
(4)C与H2O(g)的反应
(5)缓慢氧化:食物的腐败
(1)大多数分解反应
(2)Ba(OH)2·8H2O晶体与
NH4Cl晶体的反应
(3)C、H2或CO还原金属氧
化物的反应
(4)大多数化合反应
(5)C与CO2的反应
判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。
2.高温煅烧石灰石。
3.氧化钙与水的反应。
4.盐酸与氢氧化钠溶液反应
课堂练习:
放热
放热
放热
吸热
5.高温下木炭与CO2反应生成一氧化碳。
6.炸药爆炸
7.Ca(OH)2和NH4Cl的反应
8.炽热的碳与H2O(g)的反应
9.甲烷在氧气中的燃烧
放热
吸热
放热
吸热
吸热
2、吸热反应一定要加热,而放热反应一定不加热?
不一定,反应放热和吸热与反应条件无关如:Ba(OH)2·8H2O与NH4Cl(吸热反应)常温可以进行,Fe+S
FeS(放热反应)
1、浓硫酸溶于水,是放热反应吗?
不是,吸热反应和放热反应是对化学反应的分类结果。浓硫酸溶于水可称为放热过程。
【思考与交流】
[例1]由图
分析,下列说法
正确的是( )。
A.A===B+C
与
B+C===A
两个反应吸收和放出的
热量不等
B.A===B+C
是放热反应
C.A
具有的能量高于
B
和
C
具有的能量总和
D.A===B+C
是吸热反应,B+C===A
必然是放热反应
D
2.在反应H2
+
Cl2
=2HCl中,已知断裂1molH-H需要能量为Q1,断裂1mol
Cl-Cl键需要能量为Q2,形成1mol
H-Cl放出能量为Q3,下列关系式正确的是(
)
A.
Q1+Q2
>
Q3
B.
Q1+Q2
<
Q3
C.
Q1+Q2
>
2Q3
D.
Q1+Q2
<
2Q3
D
弧寸寸曙闸签逢双禽赐循刀樱舌均王乌逮关窟枷考琅涅蹈癸揽装殷莹待谬化学能与热能课件第1课时课件化学能与热能课件第1课时课件
化学能的应用
利用化学反应产生的热量进行生活、生产和科研。
利用热能使很多化学反应得以发生,从
而制备所需的物质。
化学能
热能
提供了人类生存和发展的能量和动力
进行化工生产、研制新的物质
1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
4、化学反应中能量转化遵循能量守衡原则。
【本节小结】
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
【科学视野】
启示:
生物化学过程在利用“能源”上更为合理、有效。
科学视野
生物体中的能量转化
人体内发生的氧化还原反应与体外的燃烧本质相同,最终产物一样(都是二氧化碳和水),都是放热反应,所放出的能量也相等。只是二者反应条件不同。
启示:
生物化学过程在利用“能源”上更为合理、有效。
科学视野
1、社会发展与能源利用
2、人类利用能源的三个阶段
柴草时期
化石能源时期
多能源结构时期
