人教版(2019)高中化学 必修二 学案 5.1硫及其化合物
文档属性
| 名称 | 人教版(2019)高中化学 必修二 学案 5.1硫及其化合物 |

|
|
| 格式 | docx | ||
| 文件大小 | 952.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-07-22 00:00:00 | ||
图片预览




文档简介
硫及其化合物
【学时安排】
2学时
【第1课时 硫和二氧化硫】
【学习目标】
1.认识硫元素在物质中具有不同价态,可通过氧化还原反应实现含有不同价态硫元素的物质的相互转化。
2.结合真实情境中的应用实例或通过实验探究,了解硫、二氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响。
3.能说明二氧化硫的应用对环境的影响。
【学习重难点】
1.和性质的比较
2.常见的漂白剂及漂白原理
【学习过程】
一、硫
1.物理性质
俗称
颜色状态
硬度
溶解性
水
酒精
硫黄
________色晶体
质________,易研成粉末
____溶
____溶
____溶
【微思考】若试管内壁附着有单质硫时,如何洗涤除去:
2.化学性质
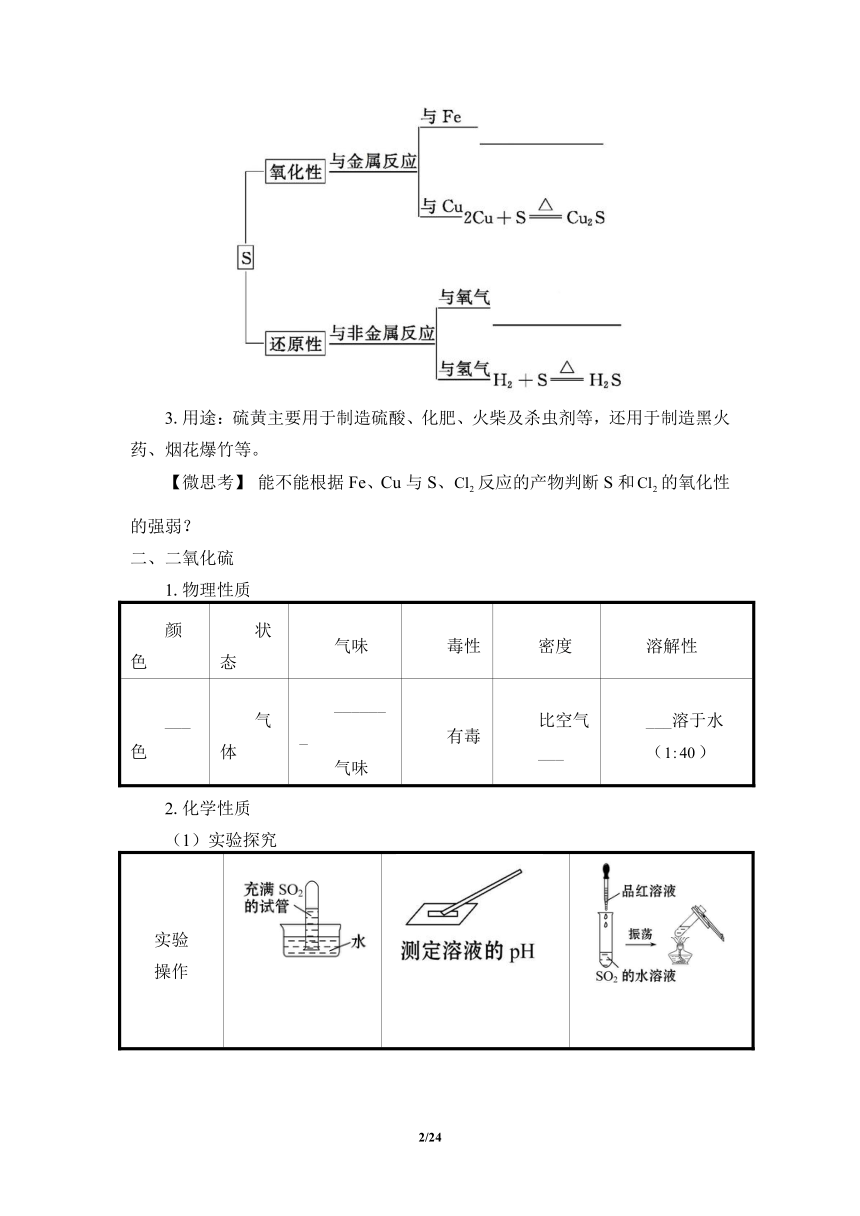
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。如:
3.用途:硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造黑火药、烟花爆竹等。
【微思考】 能不能根据Fe、Cu与S、反应的产物判断S和的氧化性的强弱?
二、二氧化硫
1.物理性质
颜色
状态
气味
毒性
密度
溶解性
___色
气体
_______
气味
有毒
比空气
___
___溶于水
()
2.化学性质
(1)实验探究
实验
操作
463558699500
35560-4191000
1073151397000
实验
现象
_________
_________
pH试纸
_____
振荡后___________
___,再加热溶液___
__________________
结论
_______
_______
_______
_______
_______
________________
________________
(2)可逆反应
①正反应:向_______方向进行的反应;
②逆反应:向_______方向进行的反应;
③可逆反应:在_________下,既能向正反应方向进行,
_____又能向逆反应方向进行的反应。
【微思考】氢气与氧气反应可以生成水,电解水可以得到氢气与氧气,该反应是可逆反应吗?
(3)的“4种性质”
3.用途
制硫酸、漂白剂(漂白纸浆、毛、丝等)、杀菌消毒、食品添加剂。
【情境·思考】
某同学发现夏天爷爷买的白草帽,用了一段时间后变黄了,通过询问身边的人了解到草帽是用“硫黄熏”过的,你是否认可该说法?白草帽变黄的原因是什么?
【重难点突破】
知识点一 和性质的比较
【案例示范】
【典例】(2019·长沙高一检测)浓硫酸和木炭在加热
时发生反应的化学方程式是。用如图所示各装置设计一个实验,验证浓硫酸与木炭在加热条件下反应产生的各种产物。
(1)这些装置的连接顺序(按产物气流从左到右的方向)是________→________→________→________(填装置的序号)。
(2)装置②中要检验产物中有水蒸气,则放入的药品是_________________________;装置③中要检验产物中有二氧化碳气体,则放入的药品是______________;实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是_____________________,B瓶溶液的作用是______________,C瓶溶液的作用是______________。
【迁移·应用】
1.(2019·日照高一检测)能证明具有漂白性的是( )
A.酸性溶液中通入气体后紫红色消失
B.滴有酚酞的NAOH溶液中通入气体后红色消失
C.品红溶液中通入气体后红色消失
D.溴水中通入气体后橙色消失
2.(2019·临沂高一检测)实验室可用如图装置(略去部分夹持仪器)制取并验证其性质。
(1)盛装溶液的仪器名称为________。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若________,则整个装置气密性良好。
2.(2019·临沂高一检测)实验室可用如图装置(略去部分夹持仪器)制取并验证其性质。
(1)盛装溶液的仪器名称为________。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若________,则整个装置气密性良好。
(2)装置B的作用之一是通过观察产生气泡的多少判断生成的快慢,其中的液体最好选择________(填代号)。
a.蒸馏水 b.饱和溶液
c.饱和溶液 d.饱和溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为_______________________。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入溶液,产生白色沉淀。
上述方案合理的是方案______(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为____________________________。
(5)装置E的作用是________。装置F中为________溶液。
知识点二 常见的漂白剂及漂白原理
【案例示范】
【典例】(2019·聊城高一检测)下列说法正确的是( )
A.具有漂白性,能使品红溶液和酸性溶液褪色且常作食品的漂白剂
B.活性炭、胶体、、等都有漂白性
C.氯气具有漂白性
D.也有漂白性,其漂白原理和相似
【迁移·应用】
1.(2019·抚州高一检测)A、B是两种常温下有刺激性气味的气体。将A通入品红溶液中,品红溶液变为无色;将B通入品红溶液中,品红溶液也变为无色。将A通入紫色石蕊溶液中,溶液变为红色;将B通入紫色石蕊溶液中,溶液先变红后褪色。将A和B按的体积比充分混合,通入品红溶液中,品红溶液不褪色,通入紫色石蕊溶液中,溶液只变红不褪色。试回答下列问题:
(1)写出A、B的化学式:A________;B________。
(2)写出A与溶液反应的化学方程式:
_________________或_________________。
(3)写出B与溶液反应的离子方程式:__________________________。
(4)加热通入A后变为无色的品红溶液,现象是________________________;加热通入B后变为无色的品红溶液,现象是_________________。
2.下列物质都可用于漂白,但漂白原理与其他三种物质不相同的是 ( )
A. B.
C. D.
【第2课时 硫酸、硫酸根离子的检验】
【学习目标】
1.结合真实情境中的应用实例或通过实验探究,了解硫酸的主要性质,认识其在生产中的应用和对生态环境的影响。
2.结合真实情境中的应用实例或通过实验探究,了解硫酸根离子的检验方法,认识其在粗盐提纯中的应用。
【学习重难点】
1.浓硫酸的强氧化性
2.的检验及粗盐的提纯
【学习过程】
一、硫酸
1.硫酸的用途与工业制备
(1)用途:
①重要的化工原料,可用于制___________、炸药、染料、盐类等。
②用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
(2)工业制备:
2.稀硫酸的性质
硫酸是强酸,具有酸的通性。
(3)稀硫酸与碱反应,如:_____________。
(4)稀硫酸与部分盐反应,如:_____________________。
3.浓硫酸的特性
(1)吸水性与脱水性
①实验探究
实验
操作
实验
现象
___________________________________
__________________________________
实验
结论
_________________
②对比
吸水性
脱水性
原理
浓硫酸能够吸收______________________及固体中的结晶水
浓硫酸能把有机物中________________________脱去,剩余黑色的炭
区别
_____________
____________________
____________________
应用
_________
【微思考】
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性?
(2)强氧化性
①实验探究
实验
操作
实验
现象
a试管中铜丝表面___________;
b试管中的溶液_____________;
c试管中的_________________________;
将a试管里的溶液慢慢倒入水中,____________。
实验
结论
Cu和浓硫酸反应的化学方程式:
_________________________________
②强氧化性的表现
二、的检验
1.实验探究
实验
操作
实验
现象
先____________,加入盐酸后____________
先___________,加入盐酸后____________
先_____________,加入盐酸后_____________
实验
结论
与反应生成不溶于
盐酸的_________,离子方程
式:___________________
与
反应生成白
色沉淀,
可溶于盐酸
2.检验的正确操作方法:
被检液取清液有无白色沉淀产生(判断有无)。先加稀盐酸的目的是_______________________。
【巧判断】
1.用溶液鉴别和。( )
2.稀硫酸没有氧化性,一般不能发生氧化还原反应。( )
3.铜片溶于热的浓硫酸,体现了浓硫酸的酸性和强氧化性。( )
【重难点突破】
知识点一 浓硫酸的强氧化性
【案例示范】
【典例】(2019·大连高一检测)根据如图所示装置,回答下列问题。
(1)开始加热后,产生的现象是a处______________;b处______________。
(2)停止反应后,用酒精灯在b处微微加热,产生的现象是_______________________。
(3)写出a处发生反应的化学方程式:_________。
(4)蘸有溶液的棉花的作用是______________________________。
(5)实验中,取一定质量的铜片和一定体积的浓硫酸放在试管中共热,直到反应完毕,发现试管中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.铁粉 b.溶液
c.银粉 d.溶液
【迁移·应用】
1.(2019·株洲高一检测)浓硫酸在下列物质的转化中,既表现出氧化性,又表现出酸性的是( )
A.Cu
B.C
C.蔗糖 “黑面包”
D.
2.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制反应生成的量
B.②中选用品红溶液验证的生成
C.③中选用溶液吸收多余的
D.为确认有生成,向①中加水,观察颜色
知识点二 的检验及粗盐的提纯
【案例示范】
同学们都喜欢照相,在照相机底片的处理过程中,照相显影剂(或称显影剂)是一种让感光产生的隐藏影像或印记在底片上显现的化学用剂。亚硫酸钠是照相显影剂中的一种成分。
某亚硫酸钠试剂已部分被氧化,为确定它的纯度,要进行如下实验:
①取样品;
②将样品溶解;
③给溶液加入稍过量的盐酸酸化的溶液;
④过滤、洗涤、干燥沉淀,称其质量为。
试回答:
(1)要用盐酸酸化的原因是什么? (科学探究与创新意识)
(2)溶液要稍过量的原因是什么?(科学探究与创新意识)
(3)判断操作③是否完成的方法是什么?(科学探究与创新意识)
(4)判断沉淀是否洗净的方法是什么?(科学探究与创新意识)
(5)列式计算的纯度。(证据推理与模型认知)
【迁移·应用】
1.(2019·汕头高一检测)向某溶液中滴入溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中( )
A.一定有
B.可能有或
C.一定无
D.可能有
2.(2019·聊城高一检测)下列关于粗盐提纯的说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀一些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中,用大量水洗涤
【第3课时 不同价态含硫物质的转化】
【学习目标】
1.认识硫元素在物质中具有不同价态,可通过氧化还原反应实现含有不同价态硫元素的物质的相互转化。
2.通过实验探究,了解不同价态含硫物质的转化关系。
【学习重难点】
不同价态含硫物质的转化
【学习过程】
自然界中硫的存在和转化
1.自然界中不同价态硫元素间的转化
2.硫元素不同化合价之间的相互转化
(1)硫的化合价与性质的关系
(2)设计实验实现不同价态含硫物质的转化
序号
转化
目标
转化前的
含硫物质
选择试剂
转化后的
含硫物质
①
________
S
________
②
S
________
________
_________
③
________
④
S
________
⑤
________
S
⑥
________
________
⑦
________
书写有关化学方程式:
①______________________________________。
②______________________________________。
③______________________________________。
④______________________________________。
⑤______________________________________。
⑥______________________________________。124777592710△
△
⑦
【重难点突破】
知识点 不同价态含硫物质的转化
【案例示范】
【典例】酸雨被人们称为“天堂的眼泪”或“空中死神”,具有很大破坏力。目前,我国的酸雨主要分布地区是长江以南的四川盆地、贵州、湖南、江西以及沿海的福建、广东等地,占我国国土面积的30%。
现有雨水样品1份,每隔一段时间测定该雨水样品的PH,所得数据如下:
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.63
4.56
4.55
4.55
分析数据,回答下列问题:
(1)①雨水样品的PH变化的原因是什么?(科学探究)
②如何用实验验证①中变化原因?(证据推理)
③如果将刚取样的上述雨水和自来水相混合,PH将如何变化?原因是什么?(科学探究)
(2)减少酸雨产生的途径有哪些?(社会责任)
【迁移·应用】
1.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
2.亚硫酸钠中价的硫既有氧化性又有还原性。现有试剂:氯水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液。
(1)要证明亚硫酸溶液具有还原性,应选用什么试剂?会观察到什么现象?写出反应的离子方程式。
(2)要证明亚硫酸钠溶液具有氧化性,应选用什么试剂?会观察到什么现象?写出反应的离子方程式。
(3)如何通过实验证明亚硫酸钠已被氧化?
实验操作步骤
实验现象
①
②
【参考答案】
第1学时
【重难点突破】
知识点一 和性质的比较
【案例示范】
答案:(1)④
②
①
③
(2)无水硫酸铜粉末
澄清石灰水
检验二氧化硫的存在
除去气体中的
证明气体已完全除尽
【迁移·应用】
【解析】1.选C。气体通入酸性溶液后紫红色消失,通入溴水后橙色消失都是利用了的还原性;滴有酚酞的溶液红色消失,是因为通入的气体与水反应生成了酸,酸消耗了;只有气体通入品红溶液后红色消失,才能证明具有漂白性。
2.【解析】(1)根据仪器特点,该仪器名称为分液漏斗,液柱高度保持不变,说明气密性良好;
(2)易溶于水,能与溶液、溶液反应,但在饱和溶液中溶解度较小,c项正确;
(3)能将氧化,生成硫单质,所以现象为有浅黄色沉淀生成;
(4)方案Ⅰ,氯水中加入溶液也可得到白色沉淀;方案Ⅱ中二氧化硫和氯水均可使品红褪色;方案Ⅲ中产生沉淀可证明与发生了氧化还原反应(因溶液显酸性,不会产生沉淀,而是沉淀),选方案Ⅲ;
(5)E为安全瓶,防止倒吸;装置F起到吸收尾气中的作用,可选用溶液。
答案:(1)分液漏斗
液柱高度保持不变
(2)c
(3)有浅黄色沉淀生成
(4)Ⅲ
(5)防止倒吸
(合理即可)
知识点二 常见的漂白剂及漂白原理
【案例示范】
【解题指南】解答本题应注意以下两点:
(1)具有还原性,可以使一些具有氧化性的有色溶液褪色。
(2)氯气本身没有漂白性,与水反应生成的次氯酸具有漂白性。
【解析】选B。使酸性溶液褪色是因为其具有还原性而不是漂白性,且有毒,不能用于食品漂白,A错误;活性炭、胶体具有吸附性,能吸附色素,、、等有强氧化性,能氧化色素物质,B正确,D错误;氯气没有漂白性,C错误。
【迁移·应用】
1.【解析】具有漂白作用,能使品红溶液褪色的气体有
、、等。A气体不能使紫色石蕊溶液褪色,但能
使紫色石蕊溶液变红色,所以A为:H2O+SO2 H2SO3;
B气体使紫色石蕊溶液先变红后褪色,为Cl2:H2O+Cl2 HCl+HClO,使紫色石蕊溶液变红,能使紫
色石蕊溶液变为无色。如果将与等体积混合通入溶液中,则发生下列反应:,生成的盐酸和硫酸都没有漂白作用,它们只能使紫色石蕊溶液变红。
答案:(1)
(2)
(3)
(4)溶液变为红色
无明显变化
2. 【解析】选B。、、均具有氧化性,具有漂白性,漂白的原理是与有色物质发生氧化还原反应,是永久性的和不可逆的过程;具有漂白性,原理是与有色物质结合成一种无色的不稳定的物质,加热颜色又恢复,因此的漂白是可逆的、非氧化还原反应的、暂时性的过程,答案选B。
第2学时
【巧判断】
1.提示:×。BACl2溶液与 和反应都生成白色沉淀,要鉴别必须再加入足量盐酸,白色沉淀溶解的为,不溶解的为。
2.提示:×。稀硫酸中氢元素具有弱氧化性,可以与活泼金属发生氧化还原反应。
3.提示:√。铜片溶于热的浓硫酸,生成硫酸铜和,分别体现了酸性和强氧化性。
【重难点突破】
知识点一 浓硫酸的强氧化性
【案例示范】
【解析】(1)浓硫酸与铜片反应生成气体,能使品红褪色,生成的使溶液变蓝色。
(2)被漂白的品红纸条加热时会重新变红。
(4)有毒,不能直接排放在空气中,用溶液可以吸收多余的。
(5)随着反应的进行,被不断消耗,且反应生成水,使硫酸的浓度逐渐减小,当变为稀硫酸时,反应将会停止,因为铜与稀硫酸不反应,可向反应结束后的试管中加入铁粉或溶液,若有气泡产生则可证明确有余酸。
答案: (1)有气泡产生,溶液变蓝 纸条褪色
(2)纸条由无色恢复为红色
(3)
(4)吸收多余的,以防止污染环境
(5)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和
稀硫酸反应
②a、d
【迁移·应用】
1.A。
2.D。【解析】上下移动铜丝可以控制铜与浓硫酸的接触与分离,从而可以控制反应生成的量,A项正确;
可使品红溶液褪色,B项正确;有毒,能与溶液反应,C项正确;铜与浓硫酸反应后①中溶液显蓝色即可证明有生成,无需向其中加水,D项错误。
知识点二 的检验及粗盐的提纯
【案例示范】
【解析】(1)与反应也会生成白色沉
淀,干扰实验。
(2)加入稍过量的目的是使完全沉淀。
(3)操作③是为了使沉淀完全,只要检验溶液中有无即可。
(4)沉淀可以吸附溶液中的,若沉淀洗涤干净,则检验不出。
(5)最后沉淀为,由硫元素守恒可知,,则纯度为。
答案:(1)防止沉淀的产生而引起误差。
(2)使试样中的完全转化为沉淀。
(3)将混合液静置,取上层清液少许,继续滴加盐酸酸化的溶液,若无白色沉淀生成,则操作③完成。
(4)取最后一次洗涤液少许,滴加溶液,若无沉淀出现,则已洗净,反之则未洗净。
(5),,则纯度为
【迁移·应用】
1.【解析】选B。溶液中加入,可产生白色沉淀,再加稀盐酸,两者均不溶解,可能为、等,所以B正确。
2. 【解析】选B。溶液中加入,可产生白色沉淀,再加稀盐酸,两者均不溶解,可能为、等,所以B正确。
第3学时
【重难点突破】
知识点 不同价态含硫物质的转化
【案例示范】
【解析】(1)①酸雨放置时pH变小,其原因是雨水中的被空气中氧气氧化所致:,。
②可以通过检验不同时间的雨水中的浓度大小确定的发生。分别取和的雨水于试管中,加入等量盐酸酸化,再加入等量足量的溶液,盛有的雨水的试管中溶液更浑浊,说明浓度大。
③雨水和自来水混合,应考虑与(或)的反应:(或)。因此雨水与自来水混合后溶液pH将变小。
(2)减少酸雨的产生需减少的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。
答案:(1)①雨水中存在反应,,酸性增强,pH变小
②分别取和的雨水于试管中,加入等量盐酸酸化,再加入等量足量的溶液,盛有的雨水的试管中溶液更浑浊,说明浓度大,说明的发生
③变小;自来水使用消毒,含有和,与雨水混合发生反应(或)酸性增强,pH变小
(2)①少用煤作燃料;②燃料脱硫;③开发新能源
【迁移·应用】
1.【解析】选D。X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫。浓硫酸使蔗糖变黑的现象主要体现了它的脱水性,A错误;若A是铁,常温下,铁与浓硫酸发生钝化现象,所以铁不能完全溶解,B错误;若A是碳,浓硫酸和碳反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,C错误;工业上,二氧化硫转化为三氧化硫的反应条件为高温、常压、使用催化剂,D正确。
2.答案:(1)氯水
氯水褪色
(2)硫化钠溶液、稀硫酸
有淡黄色沉淀生成
(3)取少量亚硫酸钠溶液于试管中,加足量盐酸酸化,未见白色沉淀产生
再加少量溶液,如果出现白色沉淀,则亚硫酸钠已被氧化
【学时安排】
2学时
【第1课时 硫和二氧化硫】
【学习目标】
1.认识硫元素在物质中具有不同价态,可通过氧化还原反应实现含有不同价态硫元素的物质的相互转化。
2.结合真实情境中的应用实例或通过实验探究,了解硫、二氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响。
3.能说明二氧化硫的应用对环境的影响。
【学习重难点】
1.和性质的比较
2.常见的漂白剂及漂白原理
【学习过程】
一、硫
1.物理性质
俗称
颜色状态
硬度
溶解性
水
酒精
硫黄
________色晶体
质________,易研成粉末
____溶
____溶
____溶
【微思考】若试管内壁附着有单质硫时,如何洗涤除去:
2.化学性质
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。如:
3.用途:硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造黑火药、烟花爆竹等。
【微思考】 能不能根据Fe、Cu与S、反应的产物判断S和的氧化性的强弱?
二、二氧化硫
1.物理性质
颜色
状态
气味
毒性
密度
溶解性
___色
气体
_______
气味
有毒
比空气
___
___溶于水
()
2.化学性质
(1)实验探究
实验
操作
463558699500
35560-4191000
1073151397000
实验
现象
_________
_________
pH试纸
_____
振荡后___________
___,再加热溶液___
__________________
结论
_______
_______
_______
_______
_______
________________
________________
(2)可逆反应
①正反应:向_______方向进行的反应;
②逆反应:向_______方向进行的反应;
③可逆反应:在_________下,既能向正反应方向进行,
_____又能向逆反应方向进行的反应。
【微思考】氢气与氧气反应可以生成水,电解水可以得到氢气与氧气,该反应是可逆反应吗?
(3)的“4种性质”
3.用途
制硫酸、漂白剂(漂白纸浆、毛、丝等)、杀菌消毒、食品添加剂。
【情境·思考】
某同学发现夏天爷爷买的白草帽,用了一段时间后变黄了,通过询问身边的人了解到草帽是用“硫黄熏”过的,你是否认可该说法?白草帽变黄的原因是什么?
【重难点突破】
知识点一 和性质的比较
【案例示范】
【典例】(2019·长沙高一检测)浓硫酸和木炭在加热
时发生反应的化学方程式是。用如图所示各装置设计一个实验,验证浓硫酸与木炭在加热条件下反应产生的各种产物。
(1)这些装置的连接顺序(按产物气流从左到右的方向)是________→________→________→________(填装置的序号)。
(2)装置②中要检验产物中有水蒸气,则放入的药品是_________________________;装置③中要检验产物中有二氧化碳气体,则放入的药品是______________;实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是_____________________,B瓶溶液的作用是______________,C瓶溶液的作用是______________。
【迁移·应用】
1.(2019·日照高一检测)能证明具有漂白性的是( )
A.酸性溶液中通入气体后紫红色消失
B.滴有酚酞的NAOH溶液中通入气体后红色消失
C.品红溶液中通入气体后红色消失
D.溴水中通入气体后橙色消失
2.(2019·临沂高一检测)实验室可用如图装置(略去部分夹持仪器)制取并验证其性质。
(1)盛装溶液的仪器名称为________。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若________,则整个装置气密性良好。
2.(2019·临沂高一检测)实验室可用如图装置(略去部分夹持仪器)制取并验证其性质。
(1)盛装溶液的仪器名称为________。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若________,则整个装置气密性良好。
(2)装置B的作用之一是通过观察产生气泡的多少判断生成的快慢,其中的液体最好选择________(填代号)。
a.蒸馏水 b.饱和溶液
c.饱和溶液 d.饱和溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为_______________________。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入溶液,产生白色沉淀。
上述方案合理的是方案______(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为____________________________。
(5)装置E的作用是________。装置F中为________溶液。
知识点二 常见的漂白剂及漂白原理
【案例示范】
【典例】(2019·聊城高一检测)下列说法正确的是( )
A.具有漂白性,能使品红溶液和酸性溶液褪色且常作食品的漂白剂
B.活性炭、胶体、、等都有漂白性
C.氯气具有漂白性
D.也有漂白性,其漂白原理和相似
【迁移·应用】
1.(2019·抚州高一检测)A、B是两种常温下有刺激性气味的气体。将A通入品红溶液中,品红溶液变为无色;将B通入品红溶液中,品红溶液也变为无色。将A通入紫色石蕊溶液中,溶液变为红色;将B通入紫色石蕊溶液中,溶液先变红后褪色。将A和B按的体积比充分混合,通入品红溶液中,品红溶液不褪色,通入紫色石蕊溶液中,溶液只变红不褪色。试回答下列问题:
(1)写出A、B的化学式:A________;B________。
(2)写出A与溶液反应的化学方程式:
_________________或_________________。
(3)写出B与溶液反应的离子方程式:__________________________。
(4)加热通入A后变为无色的品红溶液,现象是________________________;加热通入B后变为无色的品红溶液,现象是_________________。
2.下列物质都可用于漂白,但漂白原理与其他三种物质不相同的是 ( )
A. B.
C. D.
【第2课时 硫酸、硫酸根离子的检验】
【学习目标】
1.结合真实情境中的应用实例或通过实验探究,了解硫酸的主要性质,认识其在生产中的应用和对生态环境的影响。
2.结合真实情境中的应用实例或通过实验探究,了解硫酸根离子的检验方法,认识其在粗盐提纯中的应用。
【学习重难点】
1.浓硫酸的强氧化性
2.的检验及粗盐的提纯
【学习过程】
一、硫酸
1.硫酸的用途与工业制备
(1)用途:
①重要的化工原料,可用于制___________、炸药、染料、盐类等。
②用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
(2)工业制备:
2.稀硫酸的性质
硫酸是强酸,具有酸的通性。
(3)稀硫酸与碱反应,如:_____________。
(4)稀硫酸与部分盐反应,如:_____________________。
3.浓硫酸的特性
(1)吸水性与脱水性
①实验探究
实验
操作
实验
现象
___________________________________
__________________________________
实验
结论
_________________
②对比
吸水性
脱水性
原理
浓硫酸能够吸收______________________及固体中的结晶水
浓硫酸能把有机物中________________________脱去,剩余黑色的炭
区别
_____________
____________________
____________________
应用
_________
【微思考】
浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性?
(2)强氧化性
①实验探究
实验
操作
实验
现象
a试管中铜丝表面___________;
b试管中的溶液_____________;
c试管中的_________________________;
将a试管里的溶液慢慢倒入水中,____________。
实验
结论
Cu和浓硫酸反应的化学方程式:
_________________________________
②强氧化性的表现
二、的检验
1.实验探究
实验
操作
实验
现象
先____________,加入盐酸后____________
先___________,加入盐酸后____________
先_____________,加入盐酸后_____________
实验
结论
与反应生成不溶于
盐酸的_________,离子方程
式:___________________
与
反应生成白
色沉淀,
可溶于盐酸
2.检验的正确操作方法:
被检液取清液有无白色沉淀产生(判断有无)。先加稀盐酸的目的是_______________________。
【巧判断】
1.用溶液鉴别和。( )
2.稀硫酸没有氧化性,一般不能发生氧化还原反应。( )
3.铜片溶于热的浓硫酸,体现了浓硫酸的酸性和强氧化性。( )
【重难点突破】
知识点一 浓硫酸的强氧化性
【案例示范】
【典例】(2019·大连高一检测)根据如图所示装置,回答下列问题。
(1)开始加热后,产生的现象是a处______________;b处______________。
(2)停止反应后,用酒精灯在b处微微加热,产生的现象是_______________________。
(3)写出a处发生反应的化学方程式:_________。
(4)蘸有溶液的棉花的作用是______________________________。
(5)实验中,取一定质量的铜片和一定体积的浓硫酸放在试管中共热,直到反应完毕,发现试管中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.铁粉 b.溶液
c.银粉 d.溶液
【迁移·应用】
1.(2019·株洲高一检测)浓硫酸在下列物质的转化中,既表现出氧化性,又表现出酸性的是( )
A.Cu
B.C
C.蔗糖 “黑面包”
D.
2.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制反应生成的量
B.②中选用品红溶液验证的生成
C.③中选用溶液吸收多余的
D.为确认有生成,向①中加水,观察颜色
知识点二 的检验及粗盐的提纯
【案例示范】
同学们都喜欢照相,在照相机底片的处理过程中,照相显影剂(或称显影剂)是一种让感光产生的隐藏影像或印记在底片上显现的化学用剂。亚硫酸钠是照相显影剂中的一种成分。
某亚硫酸钠试剂已部分被氧化,为确定它的纯度,要进行如下实验:
①取样品;
②将样品溶解;
③给溶液加入稍过量的盐酸酸化的溶液;
④过滤、洗涤、干燥沉淀,称其质量为。
试回答:
(1)要用盐酸酸化的原因是什么? (科学探究与创新意识)
(2)溶液要稍过量的原因是什么?(科学探究与创新意识)
(3)判断操作③是否完成的方法是什么?(科学探究与创新意识)
(4)判断沉淀是否洗净的方法是什么?(科学探究与创新意识)
(5)列式计算的纯度。(证据推理与模型认知)
【迁移·应用】
1.(2019·汕头高一检测)向某溶液中滴入溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中( )
A.一定有
B.可能有或
C.一定无
D.可能有
2.(2019·聊城高一检测)下列关于粗盐提纯的说法中正确的是( )
A.溶解粗盐时,应尽量让溶液稀一些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中,用大量水洗涤
【第3课时 不同价态含硫物质的转化】
【学习目标】
1.认识硫元素在物质中具有不同价态,可通过氧化还原反应实现含有不同价态硫元素的物质的相互转化。
2.通过实验探究,了解不同价态含硫物质的转化关系。
【学习重难点】
不同价态含硫物质的转化
【学习过程】
自然界中硫的存在和转化
1.自然界中不同价态硫元素间的转化
2.硫元素不同化合价之间的相互转化
(1)硫的化合价与性质的关系
(2)设计实验实现不同价态含硫物质的转化
序号
转化
目标
转化前的
含硫物质
选择试剂
转化后的
含硫物质
①
________
S
________
②
S
________
________
_________
③
________
④
S
________
⑤
________
S
⑥
________
________
⑦
________
书写有关化学方程式:
①______________________________________。
②______________________________________。
③______________________________________。
④______________________________________。
⑤______________________________________。
⑥______________________________________。124777592710△
△
⑦
【重难点突破】
知识点 不同价态含硫物质的转化
【案例示范】
【典例】酸雨被人们称为“天堂的眼泪”或“空中死神”,具有很大破坏力。目前,我国的酸雨主要分布地区是长江以南的四川盆地、贵州、湖南、江西以及沿海的福建、广东等地,占我国国土面积的30%。
现有雨水样品1份,每隔一段时间测定该雨水样品的PH,所得数据如下:
测试时间/h
0
1
2
3
4
雨水的pH
4.73
4.63
4.56
4.55
4.55
分析数据,回答下列问题:
(1)①雨水样品的PH变化的原因是什么?(科学探究)
②如何用实验验证①中变化原因?(证据推理)
③如果将刚取样的上述雨水和自来水相混合,PH将如何变化?原因是什么?(科学探究)
(2)减少酸雨产生的途径有哪些?(社会责任)
【迁移·应用】
1.已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
2.亚硫酸钠中价的硫既有氧化性又有还原性。现有试剂:氯水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液。
(1)要证明亚硫酸溶液具有还原性,应选用什么试剂?会观察到什么现象?写出反应的离子方程式。
(2)要证明亚硫酸钠溶液具有氧化性,应选用什么试剂?会观察到什么现象?写出反应的离子方程式。
(3)如何通过实验证明亚硫酸钠已被氧化?
实验操作步骤
实验现象
①
②
【参考答案】
第1学时
【重难点突破】
知识点一 和性质的比较
【案例示范】
答案:(1)④
②
①
③
(2)无水硫酸铜粉末
澄清石灰水
检验二氧化硫的存在
除去气体中的
证明气体已完全除尽
【迁移·应用】
【解析】1.选C。气体通入酸性溶液后紫红色消失,通入溴水后橙色消失都是利用了的还原性;滴有酚酞的溶液红色消失,是因为通入的气体与水反应生成了酸,酸消耗了;只有气体通入品红溶液后红色消失,才能证明具有漂白性。
2.【解析】(1)根据仪器特点,该仪器名称为分液漏斗,液柱高度保持不变,说明气密性良好;
(2)易溶于水,能与溶液、溶液反应,但在饱和溶液中溶解度较小,c项正确;
(3)能将氧化,生成硫单质,所以现象为有浅黄色沉淀生成;
(4)方案Ⅰ,氯水中加入溶液也可得到白色沉淀;方案Ⅱ中二氧化硫和氯水均可使品红褪色;方案Ⅲ中产生沉淀可证明与发生了氧化还原反应(因溶液显酸性,不会产生沉淀,而是沉淀),选方案Ⅲ;
(5)E为安全瓶,防止倒吸;装置F起到吸收尾气中的作用,可选用溶液。
答案:(1)分液漏斗
液柱高度保持不变
(2)c
(3)有浅黄色沉淀生成
(4)Ⅲ
(5)防止倒吸
(合理即可)
知识点二 常见的漂白剂及漂白原理
【案例示范】
【解题指南】解答本题应注意以下两点:
(1)具有还原性,可以使一些具有氧化性的有色溶液褪色。
(2)氯气本身没有漂白性,与水反应生成的次氯酸具有漂白性。
【解析】选B。使酸性溶液褪色是因为其具有还原性而不是漂白性,且有毒,不能用于食品漂白,A错误;活性炭、胶体具有吸附性,能吸附色素,、、等有强氧化性,能氧化色素物质,B正确,D错误;氯气没有漂白性,C错误。
【迁移·应用】
1.【解析】具有漂白作用,能使品红溶液褪色的气体有
、、等。A气体不能使紫色石蕊溶液褪色,但能
使紫色石蕊溶液变红色,所以A为:H2O+SO2 H2SO3;
B气体使紫色石蕊溶液先变红后褪色,为Cl2:H2O+Cl2 HCl+HClO,使紫色石蕊溶液变红,能使紫
色石蕊溶液变为无色。如果将与等体积混合通入溶液中,则发生下列反应:,生成的盐酸和硫酸都没有漂白作用,它们只能使紫色石蕊溶液变红。
答案:(1)
(2)
(3)
(4)溶液变为红色
无明显变化
2. 【解析】选B。、、均具有氧化性,具有漂白性,漂白的原理是与有色物质发生氧化还原反应,是永久性的和不可逆的过程;具有漂白性,原理是与有色物质结合成一种无色的不稳定的物质,加热颜色又恢复,因此的漂白是可逆的、非氧化还原反应的、暂时性的过程,答案选B。
第2学时
【巧判断】
1.提示:×。BACl2溶液与 和反应都生成白色沉淀,要鉴别必须再加入足量盐酸,白色沉淀溶解的为,不溶解的为。
2.提示:×。稀硫酸中氢元素具有弱氧化性,可以与活泼金属发生氧化还原反应。
3.提示:√。铜片溶于热的浓硫酸,生成硫酸铜和,分别体现了酸性和强氧化性。
【重难点突破】
知识点一 浓硫酸的强氧化性
【案例示范】
【解析】(1)浓硫酸与铜片反应生成气体,能使品红褪色,生成的使溶液变蓝色。
(2)被漂白的品红纸条加热时会重新变红。
(4)有毒,不能直接排放在空气中,用溶液可以吸收多余的。
(5)随着反应的进行,被不断消耗,且反应生成水,使硫酸的浓度逐渐减小,当变为稀硫酸时,反应将会停止,因为铜与稀硫酸不反应,可向反应结束后的试管中加入铁粉或溶液,若有气泡产生则可证明确有余酸。
答案: (1)有气泡产生,溶液变蓝 纸条褪色
(2)纸条由无色恢复为红色
(3)
(4)吸收多余的,以防止污染环境
(5)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和
稀硫酸反应
②a、d
【迁移·应用】
1.A。
2.D。【解析】上下移动铜丝可以控制铜与浓硫酸的接触与分离,从而可以控制反应生成的量,A项正确;
可使品红溶液褪色,B项正确;有毒,能与溶液反应,C项正确;铜与浓硫酸反应后①中溶液显蓝色即可证明有生成,无需向其中加水,D项错误。
知识点二 的检验及粗盐的提纯
【案例示范】
【解析】(1)与反应也会生成白色沉
淀,干扰实验。
(2)加入稍过量的目的是使完全沉淀。
(3)操作③是为了使沉淀完全,只要检验溶液中有无即可。
(4)沉淀可以吸附溶液中的,若沉淀洗涤干净,则检验不出。
(5)最后沉淀为,由硫元素守恒可知,,则纯度为。
答案:(1)防止沉淀的产生而引起误差。
(2)使试样中的完全转化为沉淀。
(3)将混合液静置,取上层清液少许,继续滴加盐酸酸化的溶液,若无白色沉淀生成,则操作③完成。
(4)取最后一次洗涤液少许,滴加溶液,若无沉淀出现,则已洗净,反之则未洗净。
(5),,则纯度为
【迁移·应用】
1.【解析】选B。溶液中加入,可产生白色沉淀,再加稀盐酸,两者均不溶解,可能为、等,所以B正确。
2. 【解析】选B。溶液中加入,可产生白色沉淀,再加稀盐酸,两者均不溶解,可能为、等,所以B正确。
第3学时
【重难点突破】
知识点 不同价态含硫物质的转化
【案例示范】
【解析】(1)①酸雨放置时pH变小,其原因是雨水中的被空气中氧气氧化所致:,。
②可以通过检验不同时间的雨水中的浓度大小确定的发生。分别取和的雨水于试管中,加入等量盐酸酸化,再加入等量足量的溶液,盛有的雨水的试管中溶液更浑浊,说明浓度大。
③雨水和自来水混合,应考虑与(或)的反应:(或)。因此雨水与自来水混合后溶液pH将变小。
(2)减少酸雨的产生需减少的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。
答案:(1)①雨水中存在反应,,酸性增强,pH变小
②分别取和的雨水于试管中,加入等量盐酸酸化,再加入等量足量的溶液,盛有的雨水的试管中溶液更浑浊,说明浓度大,说明的发生
③变小;自来水使用消毒,含有和,与雨水混合发生反应(或)酸性增强,pH变小
(2)①少用煤作燃料;②燃料脱硫;③开发新能源
【迁移·应用】
1.【解析】选D。X为一种常见酸的浓溶液,能使蔗糖粉末变黑,则X是硫酸,D和水反应生成硫酸,则D是三氧化硫,B和氧气反应生成三氧化硫,则B是二氧化硫。浓硫酸使蔗糖变黑的现象主要体现了它的脱水性,A错误;若A是铁,常温下,铁与浓硫酸发生钝化现象,所以铁不能完全溶解,B错误;若A是碳,浓硫酸和碳反应生成二氧化碳、二氧化硫和水,二氧化碳和少量氢氧化钙反应生成可溶性的碳酸氢钙,C错误;工业上,二氧化硫转化为三氧化硫的反应条件为高温、常压、使用催化剂,D正确。
2.答案:(1)氯水
氯水褪色
(2)硫化钠溶液、稀硫酸
有淡黄色沉淀生成
(3)取少量亚硫酸钠溶液于试管中,加足量盐酸酸化,未见白色沉淀产生
再加少量溶液,如果出现白色沉淀,则亚硫酸钠已被氧化
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
